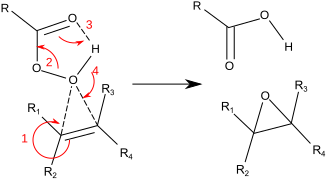Епоксид

Епоксид је циклични етар са трочланим прстеном. Овај прстен приближно дефинише еквилатерални троугао, из ког разлога је високо напрегнут. Напрегнутост прстена чини епоксиде реактивнијим од других етара. Једноставни епоксиди се именују по једињењу из ког су изведени, етилен оксид или оксиран, као у хлорометилоксиран. Као функционална група, епоксиди се означавају са епокси префиксом, нпр. 1,2-епоксициклохептан, који се исто тако назива циклохептен епоксид, или једноставно циклохептен оксид.[1][2][3]
Полимер који садржи неизреаговане епоксидне јединице се назива полиепоксид или епокси. Епокси смоле се користе као адхезиви и структурни материјали. Полимеризација епоксида даје полиетар, нпр. етилен оксид се полимеризује да формира полиетилен гликол, такође познат као полиетилен оксид.
Синтеза
[уреди | уреди извор]Индустријски најзаступљенији епоксиди су етилен оксид и пропилен оксид, који се производе у количинама од око 15 и 3 милиона тона респецктивно.[4] Епоксидација етилена је каталитичка реакција с кисеоником која има следећу стехиометрију:
- 7 H2C=CH2 + 6 O2 → 6 C2H4O + 2 CO2 + 2 H2O
Директна реакција кисеоника и алкена је корисна само за овај епоксид. Други алкени не реагују успешно. То важи чак и за пропилен.
Олефинска пероксидација
[уреди | уреди извор]Већина епоксида се генерише третирањем алкена са реагенсима који садрже пероксид, који донира један атом кисеоника. Типични пероксидни реагенси су водоник-пероксид, пероксикарбоксилна киселина (генерисана in-situ или при-формирана), и алкил хидропероксиди. У специјалним случајевима, други реагенси који садрже пероксид се користе, нпр диметилдиоксиран.
Овај приступ налази примену у производњи пропилен оксида из пропилена користећи било т-бутил хидропероксид или етилбензен хидропероксид.[5] У лабораторијским условима се чешће користи Прилезхаева реакција.[6][7] У овој реакцији долази до оксидације алкена пероксикиселином као што је m-CPBA. Један од примера је епоксидација стирена пербензоинском киселином до стирен оксида:[8]
Ова реакција има такозвани „механизам лептира“.[9] Пероксид делује као електрофил, а алкен као нуклеофил.
Хидропероксиди се такође користе у каталитичкој енантиоселективној епоксидацији, као што су Шарплес епоксидација и Јакобсенова епоксидација. У тим случајевима, кисеоник се преноси са металног оксида или пероксида. Заједно са Ши епоксидацијом, те реакције су корисне за енантиоселективну синтезу хиралних епоксида. Оксазиридински реагенси се исто таком могу користити за генерисање епоксида из алкена.
Интрамолекулска SN2 супституција
[уреди | уреди извор]Овај метод је варијанта Вилиамсонове синтезе етара. У овом случају, алкоксидни јон замењује атом хлора унутар истог молекула. Прекурсорска једињења су халохидрини. На пример, са 2-хлоропропанолом се формира пропилен оксид:[10]
Приближно, половина произведеног пропилен оксида настаје овим путем.[5] Реакција интрамолекуларног формирања епоксида је један од кључних корака у Дарзенсовој реакцији.
Нуклеофилна епоксидација
[уреди | уреди извор]Електрон-дефицитарни олефини, попут енона и акрилних деривата могу да буду епоксидовани употребом нуклеофилних једињења кисеоника (нпр. пероксида). Та реакција има двостепени механизам. Прво кисеоник врши нуклеофилну коњуговану адицију да формира стабилизовани карбањон. Тај карбањон затим напада исти атом кисеоника, замењујући његову одлазећу групу, и затварајући епоксидни прстен.
Асиметрична епоксидација
[уреди | уреди извор]Угљеникови атоми епоксида су приближно sp3-хибридизовани, тако да могу да буду стереогене позиције. У зависности од реакционог механизма и геометрије алкенског почетног материјала, цис и/или транс епоксидни диастереомери се могу формирати. Ако постоје други стереоцентри у почетном материјалу, они могу да утичу на релативну стереохемију епоксидације. Та диастереоселективност је облик „супстратне контроле“ реакције. Епоксидациони агенси који поседују стереогене структуре могу да утичу на стереохемију епоксидног продукта („реагенсна контрола“ реакције).
Реакције
[уреди | уреди извор]Типичне епоксидне реакције су наведен испод.
- Нуклеофилна адиција на епоксид може буде каталисана базом или киселином.
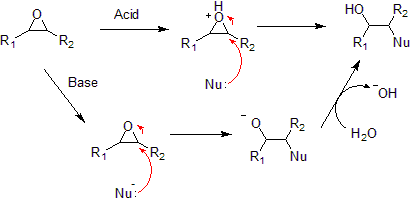
- У киселој средини, нуклеофил напада угљеник који формира најстабилнији карбокатјон. У базној средини, нуклеофил напада најмање супституисани угљеник, у сагласности са стандардним SN2 реакционим процесом нуклеофилне адиције.
- Хидролиза епоксида у присуству киселог катализатора генерише гликол. Процес хидролизе епоксида се може сматрати нуклеофилном адицијом воде до епоксида под киселим условима.
- Редукција епоксида литијум алуминијум хидридом и водом генерише алкохол. Тај редукциони процес се може сматрати нуклеофилном адицијом хидрида (H-) на епоксид под базним условима.
- Редукција са волфрам хексахлоридом и н-бутил литијумом генерише алкене. То је реакција де-епокидације:[11]
- Реакција са NH групом амина. Формирање ове ковалентне везе се користи код епокси лепака, са нпр. триетилентетрамином (ТЕТА) као стврдњивачем.
Референце
[уреди | уреди извор]- ^ Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- ^ Моррисон Роберт Тхорнтон; Боyд Роберт Неилсон (2006). Органиц цхемистрy. Енгелwоод Цлиффс, Неw Јерсеy: Прентице Халл. ИСБН 8120307658.
- ^ Смитх, Мицхаел Б.; Марцх, Јеррy (2007). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-72091-7.
- ^ Siegfried Rebsdat, Dieter Mayer "Ethylene Oxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.. doi:10.1002/14356007.a10_117. Недостаје или је празан параметар
|title=(помоћ) Article Online Posting Date: March 15, 2001. - ^ а б Dietmar Kahlich, Uwe Wiechern, Jörg Lindner “Propylene Oxide” in Ullmann's Encyclopedia of Industrial Chemistry, 2002 by Wiley-VCH, Weinheim. . doi:10.1002/14356007.a22_239. Недостаје или је празан параметар
|title=(помоћ)Article Online Posting Date: June 15, 2000 - ^ March, Jerry. 1985. Advanced Organic Chemistry, Reactions, Mechanisms and Structure. 3rd ed. John Wiley & Sons. ISBN 978-0-471-85472-2.
- ^ Nikolaus Prileschajew (1909). „Oxydation ungesättigter Verbindungen mittels organischer Superoxyde”. Berichte der deutschen chemischen Gesellschaft. 42 (4): 4811—4815. doi:10.1002/cber.190904204100.
- ^ Harold Hibbert and Pauline Burt (1941). „Styrene Oxide”. Org. Synth.; Coll. Vol., 1, стр. 494
- ^ Bartlett Rec. Chem. Prog 1950, 11 47.
- ^ Koppenhoefer, B.; Schurig, V. (1993). „(R)-Alkyloxiranes of High Enantiomeric Purity from (S)-2-Chloroalkanoic Acids via (S)-2-Chloro-1-Alkanols: (R)-Methyloxirane”. Org. Synth.; Coll. Vol., 8, стр. 434
- ^ K. Barry Sharpless; Martha A. Umbreit; Marjorie T. Nieh; Thomas C. Flood (1972). „Lower valent tungsten halides. New class of reagents for deoxygenation of organic molecules”. J. Am. Chem. Soc. 94 (18): 6538—6540. doi:10.1021/ja00773a045.