Kovalentna veza

Kovalentna veza se obrazuje između atoma nemetala, stvaranjem zajedničkih elektronskih parova.[1][2] Kovalentna veza može biti polarna, nepolarna i koordinantna (u zavisnosti od toga atomi kojih hemijskih elemenata stupaju u vezu).[3]
- Nepolarna kovalentna veza podrazumeva da se elektronski parovi jednako privlače jezgru atoma u molekulu (O2,N2,CH4, ...)
- Polarna kovalentna veza podrazumeva da elektronski par privlači više jedno jezgro atoma od drugog. (HCl, HF, HBr, ...)
- Koordinantna veza podrazumeva da elektronski par daje samo jedan atom (donor), drugi atom se naziva akceptor (NO, SO2, SO3, ...)
Kovalentna veza je svojstvena po ujednačenom učešću dva atoma za razliku od jonske veze. Najprostija kovalentna veza je kod atoma vodonika, sistema sa dva protona i dva elektrona. Kako pojedinačni atomi prilaze jedan drugom, talasne funkcije elektrona postaju deformisane i koncentrisane u regionu između dva protona. Ukupno privlačenje elektrona svakom protonu je jače od odbijanja dva protona ili dva elektrona. Privlačna sila je dobijena od para elektrona, po jednog iz svakog atoma, sa naelektrisanjem koje je koncentrisano u regionu između dva atoma. Energija kovalentne veze u molekulu vodonika H2 je -4.48 eV.[4]
Princip isključenja dozvoljava da se dva elektrona nalaze u istom delu prostoru (tj. da budu u istom prostornom kvantnom stanju) samo kad imaju suprotne spinove. Kada su spinovi paralelni, princip isključenja ne dozvoljava molekularno stanje koje bi bilo najpovoljnije iz aspekata energije (sa oba elektrona u regionu između atoma). Suprotni spinovi su osnovni uslov za kovalentnu vezu, i ne mogu više od dva elektrona da učestvuju u takvoj vezi. Ipak, atom sa više elektrona u svojoj spoljnoj ljusci može da formira nekoliko kovalentnih veza. Spajanje atoma vodonika i ugljenika, od centralne važnosti u organskoj hemiji, je primer. U molekulu metana (CH4) atom ugljenika je u centru pravilnog tetraedra, sa atomom vodonika u svakom uglu. Atom ugljenika ima četiri elektrona u L ljusci, i svaki od ovih četiri elektrona formira kovalentnu vezu sa jednim od četiri atoma vodonika. Slični oblici se pojavljuju u još kompleksnijim organskim molekulima.[4]
Zbog uloge principa isključenja, kovalentne veze su veoma direkcione. U talasnoj funkciji molekula metana svaki od ugljenikovih četiri valentnih elektrona je u kombinaciji 2s i 2p talasnih funkcija što se naziva hibridna talasna funkcija. Verovatnoća nalaženja elektrona je najveća u temenima tetraedra. Ova simetrična raspodela umanjuje preklapanja talasnih funkcija za svaki par elektrona, a time smanjuje odbojnu potencijalnu energiju.[4]
Jonske i kovalentne veze predstavljaju dva ekstrema u molekularnom vezivanju, ali ne postoji oštra granica između ova dva tipa. Često se nalazi parcijalni transfer jednog ili više elektrona iz jednog atoma u drugi. Kao rezultat, mnogi molekuli sa različitim atomima, imaju momente električnog dipola, što je u stvari premoć pozitivnog naelektrisanja na jednom kraju i negativnog na drugom. Takvi molekuli su nazvani polarni molekuli. Molekuli vode imaju velike momente dipola; i to je razlog za izuzetno veliku dielektričnu konstantu tečne vode.[4]
Nastanak hemijskih veza
[uredi | uredi izvor]
U prirodi sve teži minimalnoj energiji. Tako je i energija nekog hemijskog jedinjenja manja od zbira energija pojedinačnih elemenata (vidi dijagram). Povezivanjem atoma hemijskim vezama u jedinjenja nastaje stanje minimalne energije. Hemijska veza je zapravo sila koja povezuje atome u nekom molekulu ili strukturi. Hemijskih veza ima više vrsta, a koja će hemijska veza povezati atome zavisi od građe samih atoma i njihovih svojstava. Postoje dva osnovna načina povezivanja atoma. Uvek se radi o tome da se elektroni atoma pregrupišu. Atom može potpuno predati ili primiti jedan ili više elektrona (jonska veza), alternativno, dva atoma mogu deliti elektrone (kovalentna veza).
Gilbert Njutn Luis je predložio prikaz nastajanja hemijske veze simbolom atoma i tačkama koje predstavljaju spoljašnje ili valentne elektrone. Luis je pretpostavio da svaki atom teži oktetnoj elektronskoj konfiguraciji, po uzoru na plemenite gasove, osim helijuma koji ima dubletnu konfiguraciju. Takva konfiguracija istovremeno ima najmanju energiju.[5]
Kovalentna veza između istovrsnih atoma
[uredi | uredi izvor]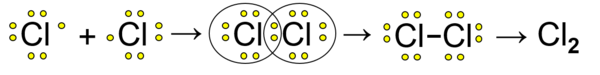



Kovalentna veza povezuje atome nemetala. Atomi nemetala imaju veliku energiju jonizacije i imaju velik elektronski afinitet, teško gube elektron, zato se takvi atomi povezuju preko zajedničkih elektronskih parova. Primer je nastanak molekula hlora, Cl2:
Svaki atom hlora ima po sedam elektrona, a jedan od elektrona atom daje u vezni i zajednički elektronski par. Podelom zajedničkog elektronskog para oba su atoma postigla stabilnu elektronsku konfiguraciju plemenitog gasa argona, deljenjem elektrona svaki atom ih ima po osam.
Približavanjem dva atoma hlora njihove atomske orbitale se preklapaju i nastaje procesom hibridizacije zajednička molekulska orbitala koja sadrži vezni elektronski par, tako je nastala jednostruka kovalentna veza. U molekulu hlora svaki atom ima takođe po tri nevezana elektronska para (crtež).
Kiseonik je postigao oktetnu konfiguraciju sa dva vezana elektronska para i nastala je dvostruka kovalentna veza. Azot postiže oktetnu konfiguraciju s tri vezana elektronska para i nastala je trostruka kovalentna veza. Kovalentne hemijske veze između istovrsnih atoma još se nazivaju homonuklearne i one su takođe nepolarne.[5]
Atomi imaju elektronsku konfiguraciju spoljašnje valentne ljuske koja se može pročitati u Periodnom sistemu elemenata. Približavanjem atoma njihove spoljašnje ljuske se počnu preklapati. Zajednički elektronski par kovalentne veze nastane u zajedničkoj molekulskoj orbitali, koja je nastala od pojedinačnih atomskih orbitala. Eksperimentalna potvrda da su parovi podeljeni najjasnije proističe iz difrakcije rendgenskih zraka. Slika uz tekst prikazuje raspored gustine elektrona oko dva jezgra atoma vodonika u molekulu vodonika. Krive povezuju područja iste gustine elektrona. Najveća gustina je oko samih jezgara, a posebno je gustina elektrona velika između dva atomska jezgra. Elektronski par se nalazi između dva pozitivno nabijena jezgra, on privlači oba jezgra i deluje kao neka vrsta „elektrostatičkog lepka”. To je osnovni razlog jačine kovalentnih veza i stabilnosti molekula.[6]
Kovalentna veza između raznovrsnih atoma
[uredi | uredi izvor]
Pogledajmo kako nastaju jedinjenja hlora, kiseonika, azota i ugljenika sa vodonikom.
- Svi halogeni elementi s vodonikom formiraju halogenovodike, molekule u kojima je uvek vezan jedan atom halogenog elementa sa atomom vodonika jednostrukom vezom. Atom hlora u ovom primeru udružuje jedan elektron, atom vodonika takođe udružuje jedan elektron u zajednički vezni par.
- Atom kiseonika iz 16. grupe elemenata periodnog sistema ima u valentnoj ljusci šest elektrona, zato mora da sa dva atomima vodonika formira dva vezna elektronska para, i tako nastaju dve jednostruke veze. Time je atom kiseonika ostvario oktet, atomi vodonika su ostvarili dublet, a zajedno tri atoma imaju najnižu moguću energiju.
- Atom azota ima u valentnoj ljusci pet elektrona i zato mora s tri atoma vodonika da formira tri vezna elektronska para, i stoga nastaju tri jednostruke veze. Time je atom azota ostvario oktet, atomi vodonika su ostvarili dublet, a zajedno četiri atoma imaju najnižu moguću energiju.
- Atom ugljenika ima u valentnoj ljusci četiri elektrona i zato mora s četiri atoma vodonika da formira četiri vezna elektronska para, i tako nastaju četiri jednostruke veze. Time je atom ugljenika ostvario oktet, atomi vodonika su ostvarili dublet, a zajedno pet atoma imaju najnižu moguću energiju.
Kovalentne hemijske veze između raznovrsnih atoma još se nazivaju heteronuklearne. One su isto tako polarne.[5]
Usmerenost kovalentne veze u prostoru
[uredi | uredi izvor]
Središnji atom nekog molekula najčešće je okružen sa ukupno četiri elektronska para čime taj atom postiže oktetnu konfiguraciju. Ugljenik u molekulu metana vezan je sa četiri atomima vodonika sa četiri vezna elektronska para. Azot u molekulu amonijaka je vezan sa tri vezna para, a ima i jedan elektronski par koji ne učestvuje u stvaranju hemijske veze. Kiseonik je u molekulu vode vezan sa dva vezna elektronska para, a ima i dva elektronska para koji ne učestvuju u hemijskoj vezi.
Od broja atoma u molekulu, kao i od broja veznih i neveznih elektronskih parova oko središnjeg atoma, zavise i međusobni položaji atoma u prostoru i uglovi između kovalentnih veza.
U molekulu metana sva su četiri elektronska para podeljena. Zbog istovrsnog naboja oni se nastoje međusobno što više udaljiti. Na taj način čine najveći mogući ugao u prostoru, koji je jednak između sve četiri kovalentne veza i iznosi 109,5°. Taj ugao je tetraedarski pa i molekul metana ima oblik tetraedra. U molekulu amonijaka ugao je nešto manji, iznosi 107° jer se nevezni elektronski parovi jače odbijaju od veznih. Molekul amonijaka ima oblik niske trostrane piramide. U molekulu vode ugao je još manji iz istog razloga, a molekul ima V-oblik. Kovalentna veza je dakle usmerena u prostoru.[5]
Karakteristike kovalentne veze
[uredi | uredi izvor]
Značajne osobine kovalentne veze su:
- Kovalentna veza povezuje atome nemetala
- Veza nastaje formiranjem zajedničkih elektronskih parova između dva atoma
- Povezivanjem atoma nastaju nove složene čestice molekula
- Veza može biti jednostruka, dvostruka i trostruka
- Kovalentna veza je prostorno usmerena
- Snaga kovalentne veze leži u elektrostatičkoj sili privlačenja između zajedničkih parova (-) i oba jezgara (+) u vezi.
Odstupanja od pravila okteta
[uredi | uredi izvor]
Ako broj parova elektrona oko središnjeg atoma odstupa od broja četiri (osam elektrona) govori se o odstupanju od pravila okteta.
Berilijum hlorid (BeCl2) je kovalentan molekul iako je berilijum metal. Oko berilijuma se nalaze se dva vezna elektronska para koja se odbijaju i atomi u molekulu su maksimalno udaljeni, ugao između kovalentnih veza je 180°. Molekul je linearan.
Bor hlorid (BCl3) ima tri kovalentne veze. Tri elektronska para su najviše udaljena ako su uglovi 120° među kovalentnim vezama. Molekul bor hlorida je planaran.
Fosfor hlorid (PCl5) ima pet kovalentnih veza. Pet elektronskih parova sadržano je u pet kovalentnih veza koje zatvaraju uglove od 90° i 120°, a molekul ima oblik trigonalne bipiramide.
Sumpor fluorid (SF6) ima šest kovalentnih veza. Šest kovalentnih veza sa šest elektronskih parova zatvaraju uglove 90°i 180° i veze su usmerene prema vrhovima oktaedra.
Više od četiri parova elektrona mogu imati samo središnji atomi koji mogu popunjavati d-orbitale.
Luisov prikaz hemijske veze je jedan od teorijskih modela koji ne može da objasni građu složenijih molekula. To tumače novije teorije kao što je VESPR - engl. Valence shell electron pair repulsion (odbijanje elektronskih parova valentne ljuske).[5]
Dužina i energija kovalentne veze
[uredi | uredi izvor]

Molekul etena (H2C=CH2) je jednostavni primer molekula sa dvostrukom vezom. Istraživanja građe molekule etena pokazala su da je taj molekul planaran, tj. svi atomi leže u jednoj ravni. Kovalentne veze međusobno zatvaraju ugao od 120°. Kada se atomi vežu dvostrukom vezom, u vezi učestvuju dva para elektrona. Jedna veza ostvaruje se preklapanjem elektronskih oblaka uzduž ose molekula. Druga veza, odnosno elektronski oblak koji pripada drugom paru elektrona, rasprostire se iznad i ispod ravni koju čine ugljenikovi i vodonikovi atomi. Elektronski oblak tog drugog para elektrona je manje gustine (više je udaljen od jezgara) pa je dvostruka veza slabija od dve jednostruke. Zato ugljovodonici sa dvostrukim vezama lakše stupaju u hemijske reakcije od onih sa jednostrukim vezama. Takođe je utvrđeno da delovi molekula oko dvostruke kovalentne veze ne mogu da rotiraju dok za rotaciju delova molekula oko jednostruke veze nema prepreka.
Molekul etina (H−C≡C−H) je primer jedinjenja sa trostrukom kovalentnom vezom. Energija trostruke veze je takođe manja od tri jednostruke. Energija jednostruke veze C−C je 335 kJ/mol, dvostruke C=C veze je 610 kJ/mol, a trostruke C≡C vete 836 kJ/mol. Zato su ugljenikova jedinjenja s trostrukom vezom još reaktivnija od jedinjenja sa dvostrukim vezama.[7]
Kod nastajanja kovalentne veze atomske orbitale dva atoma ulaze jedna u drugu, stoga je udaljenost između jezgara povezanih atoma uvek manja od zbira poluprečnika atoma. Udaljenost između jezgara atoma u molekulu naziva se dužinom kovalentne veze. Dužina jednostruke C−C kovalentne veze je 154 pm, dvostruke C=C 135 pm, a trostruke C≡C 120 pm. Veza je to jača što je dužina veze manja, a energija veze veća. Svaka hemijska veza je određena dužinom i energijom veze.[5]
Polarnost kovalentne veze
[uredi | uredi izvor]
Elektronegativnost atoma je njegova sposobnosti da privuče elektronski par koji unutar molekula deli s drugim atomom u kovalentnoj vezi.[8]
Kovalentna veza zato može biti nepolarna i polarna. U nepolarnoj vezi između dva jednaka atoma (H2, O2, N2) nema preraspodele naboja i atomi su električno neutralni. Veza postaje polarna kada stvaranje veze ostavlja delimične naboje na atomima. Molekul hlorovodonika ima polarnu kovalentnu vezu, jer dolazi do malog pomaka elektrona prema atomu hlora i nastaje: (δ je oznaka male vrednosti). To se događa zato što atomi hlora i vodonik imaju različitu elektronegativnost, sposobnost privlačenja zajedničkog elektronskog para. Sličan pomak događa se i u molekulu vode:. Polarnost veze znači da veza nije čisto kovalentna već ima deo jonskog karaktera.
Mera za elektronegativnosti atoma je koeficijent elektronegativnosti, χ (grčko hi), koji može imati vrednost do 4,0. Vrednosti koeficijenta elektronegativnosti izračunavaju se iz energije jonizacije i elektronskog afiniteta nekog atoma.
| Elektronegativnost nekih atoma | ||||||
|---|---|---|---|---|---|---|
| H: 2,20 | ||||||
| Li: 0,98 | Be: 1,57 | B: 2,04 | C: 2,55 | N: 3,04 | O: 3,44 | F: 3,98 |
| Na: 0,93 | Mg: 1,31 | Al: 1,61 | Si: 1,90 | P: 2,19 | S:2,58 | Cl: 3,16 |
Elektronegativnosti atoma omogućavaju predviđanje stupnja polarnosti veza. Razlika elektronegativnosti kiseonika i vodonika dovodi do pomaka elektrona prema kiseoniku, težišta pozitivnog i negativnog naboja u molekulu nisu na istom mestu, molekul je polaran i ponaša se kao dipol (vidi sliku). Zato je voda izrazito polaran rastvarač. Mera polarnosti nekog molekula je veličina nazvana dipolni moment.[6] Polarnost molekula izrazito utiče na celi niz svojstava materije: tačku topljenja, tačku ključanja, agregatno stanje, gustinu, svojstvo rastvorljivosti, hidrataciju.
Reference
[uredi | uredi izvor]- ^ Pauling, Linus (1988). General chemistry. Mineola, NY: Dover Publications, Inc. ISBN 978-0-486-65622-9.
- ^ Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7.
- ^ Sears, Francis Weston; Young, Hugh D.; Freedman, Roger A.; Ford, A. G. (2004). Sears and Zemansky's university physics: with modern physics. San Francisco: Pearson Addison Wesley. ISBN 978-0-8053-8684-4.
- ^ a b v g Young & Freedman,. University Physics (11th izd.). ISBN 978-0-8053-8684-4.
- ^ a b v g d đ Habuš, Tomašić, Liber: Opća kemija 1, 1. izd., Profil. . Zagreb. 2014. pp. 102. ISBN 978-953-12-1434-6..
- ^ а б P. W. Atkins, M. J. Clugston: Načela fizikalne kemije, Školska knjiga. . Zagreb. 1996. pp. 34-43. ISBN 978-953-0-30908-1.
- ^ Sikirica, Korpar, Čolig: Kemija s vježbama 1, Školska knjiga. . Zagreb. 2000. pp. 122-124. ISBN 978-953-0-20540-6.
- ^ [1] Leksikografski zavod Miroslav Krleža, Hrvatska enciklopedija, mrežno izdanje: Elektronegativnost, Pristupljeno 31.3.2017.
Literatura
[uredi | uredi izvor]- „Covalent bonding – Single bonds”. chemguide. 2000. Pristupljeno 5. 2. 2012.
- „Electron Sharing and Covalent Bonds”. Department of Chemistry University of Oxford. Pristupljeno 5. 2. 2012.
- „Chemical Bonds”. Department of Physics and Astronomy, Georgia State University. Pristupljeno 5. 2. 2012.
Spoljašnje veze
[uredi | uredi izvor]- Covalent Bonds and Molecular Structure Архивирано на сајту Wayback Machine (10. фебруар 2009)
- Structure and Bonding in Chemistry—Covalent Bonds


