Стент
(интервентна кардиологија, урологија, васкуларна хирургија) | |
|---|---|
 | |
| ICD-9-CM | 00.40 |
| MeSH | D015607 |
| MedlinePlus | 002303 |
Стент или проширница је цевасти жичани уређај који се у медицини користи за одржавање физиолошких вредности величине попречног пресака или увећање, проширење или отварање лумена шупљих цевастих структура као што су крвни судови и неки цевасти канали (мокраћни, жучни итд).[1] Стент се користе у интервентној кардиологији, или васкуларној хирургији за лечење ануризме аорте, и других болести крвних судова. Стентови могу бити од метала (нерђајућег челика, нитинол легуре) или биоразградивих материјала, разних геометријским конфигурација које су прилагођене њиховој примени.
Етимологија
[уреди | уреди извор]Полемике о пореклу речи стент, која се тако често примењује у медицини и свакодневном животу, и данас трају. Назив стент је коришћен вековима за означавање поступка ојачавања женских хаљина (помиње се у Оксфордском енглеском речнику), и неки аутори наводе да је назив потекао одатле. Док други сматрају да је употреба ове речи у медицини потекла од Јан Ф. Есера (хол. Jan F. Esser), холандског пластичног хирурга који је 1916. користио овај термин за описивање стоматолошких отисака чији је састав патентирао 1856. енглески стоматолог Чарлс Стент (1807—1885).[2] Треба истаћи и чињеницу да су први „стентови“, примењивани у медицинској пракси, првобитно имали назив „Велстент“ (енгл. "Wallstents").
Стент (енглеска реч)
Енглески назив изведен из старе енглеске речи (енгл. stan- stein — која означава камен или стену), или њених осталих синонима (енгл. Stein, Steen, Stent, Stone).[2]
Стент (уређај у медицини)
Медицинско средство, или цевасти жичани уређај, дизајниран за одржавање физиолошког вредности величине попречног пресака шупљих цевастих структура, као што су срчане и друге артерије, једњак, мокраћовод итд. Стент такође означава и уређај који се користи за подршку телесних отвор или шупљина у току пресађивања коже или имобилизацију кожних режњева након њиховог постављања.[3] У свакодневној медицинској пракси користе се две врсте стента. Стент од нерђајућег челика (енгл. baloon expandable stents) и самоширећи (енгл. self-expandable) стентови који се израђују од нитинола.
Стент (материјал у стоматологији)
Реч стент (или „esténs”, како је првобитно реч била изговарана)[2] означавала је у 19. веку кључни материјал (акрилни или другог састава) у стоматолошкој протетици. Данас скоро сваки лаик за медицину зна...„да је неки његов пријатељ, јавна личност или рођак уградио стент у артерију уретер или неку другу цевасту структуру у организму. Међутим, мало ко зна, да ова реч води порекло из стоматологије, јер се о стенту далеко више пише у медицинским него у стоматолошким часописима“...[2]
Све је почело од др Чарлса Стента (Charles Stent 1807-1885) стоматолога у Лондону који је да би поправио чврстоћу материјала за отиске у зубној протетици, у њихов састав унео супстанце које су унапредиле њихову пластичност, стабилност (чврстину), а додавањем боје и њихов изглед. Овај поступак који је примењен 1856 био је толико успешан да је 1857. сер Џон Томас (Sir John Tomes), велики енглески орални хирург тога времена, похвалио Стентов изузетан допринос стоматологији.[4]
Др Стент је убрзо у срцу Лондона, уз помоћ два сина, Чарлса Роберта Стента (Charles Robert Stent) и Артура Хауарда Озборна Стента (Arthur Howard Osborne Stent), такође стоматолога, започео комерцијалну производњу производа, који је продавао на тржишту, под именом (енгл. „C. R. and A. Stent“)...„што је заједно са многим другим патентираним проналасцима допринело здрављу становништва и унапређењу стоматологије“...[4] Око 1900, деца су продала сва тржишна права компанији „Клаудије Аш и синови“ (енгл. Claudius Ash and Sons), која је надаље имала сва права на ово име.[4]
Историја
[уреди | уреди извор]Реч стент се примењује у многим областима живота, али је она данас постала једна од најчешће коришћених речи у више медицинских дисциплина. Истраживања Медлајна 1995. о учесталости примене ове речи, је установило да се „стент“ у више од 500 чланака појављује у наслову или је тема објављеног чланка. Стентови се у 21. веку користе у много различитих медицинских интервенција, укључујући реконструкцију носа, у гинекологији, у различитим каналима и крвним судовима који морају да буду реконструисани, у хирургији трахеје, у пластичној хирургију, у лечењу доње вилице, али су најпознатији и најчешће се користе, у кардиоваскуларној интервентној кардиологији, радиологији и хирургији.[5][6]
Након што је 1974. Андреас Гринциг извео прву ангиопластику на перифеним крвним судовима, у локалној анестазији код човека, он је након интервенције на анималном моделу, приказао и прву успешну дилатацију стенозираног срчаног крвног суда. Заједно са Милером и Ханаом, 1977. у Сан Франциску а потом у Цириху, током елективног аортокоронарног премошћавања, Андреас Гринциг је урадио прву коронарну ангиопластику, а затим 16. септембра 1977, по први пут у историји медицине и самосталну перкутану коронарну интервенцију.[7]
Важна открића у интервентној кардиологији настају 1986. када у Тулузу - Француска, (фр. Jacques Puel), а затим 1987. и Улрих Сигвар (Ulrich Sigwar) са сарадници имплантирају први интракоронарни стент, којим је омогућена још шира употреба перкутаних коронарних интервенција широм света. Главни разлог за њихову увођење у интервентну радиологију било је смањење број рестеноза које су се јављале након ангиопластике и боља подршка дилатираном крвном суду или цевастом каналу.[8]
Почетком прве деценије 21. века, започета је клиничка употреба нове техничке иновације, леком обложених стенотова (енгл. drug eluting stents) – (DES). Они су данас у доминантној употреби, у клиничкој пракси, иако за сада нису показали предност у акутном инфаркту миокарда у односу на основне металне стентове.[9]
Стент технологија
[уреди | уреди извор]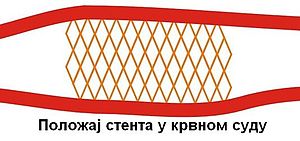
Коронарна артеријска болест (CAD), (енгл. coronary artery disease) је најчешћи узрок морбидитета и морталитета у свету. Ова болест је нпр. одговорна за 1 од 5 смртних случајева у САД, где 13 милиона људи болује од ове болести[10] и преко 4,5 милиона смртних случајева у Европи.[11] Хируршка метода уградње коронарни артеријски бајпас графта (CABG), (енгл. coronary artery bypass graft) је доказала своју ефикасност у лечењу коронарне артеријске болест. Међутим захтеви пацијената и истраживања лекара вођена жељом за развојем нових неинвазивних технологија (процедура) лечења резултовала су развојем новинх интервенција. Третман артеријских болести је знатно промењена од увођења интраканалне и перкутане коронарне интервенција (PCIs), (енгл. introduction of percutaneous coronary interventions) укључујући и перкутану транслуминалну коронарну артеријску ангиопластика (PTCA), (енгл. percutaneous transluminal coronary artery angioplasty) и уградње коронарног артеријског стента (CAS), (енгл. coronary artery stenting). Перкутану транслуминална артеријска ангиопластика била је прва прекретница за настанак и даљи развој „стент технологије“ захваљујући Андреасу Грунтцигу који је крајем седамдесетих година 20. века први започео примену перкутане коронарне интервенције (PCI).[12][13]
Метални стентови
[уреди | уреди извор]Метални стентови се користе од 1994. када су први пут примењени у интервентној кардиологији. Са применом металних стентова стопа учесталост рестеноза, која је након примене балон ангиопластике износила 30-40%, смањена на стопу од 20-25%.[14]
Материјали који се тренутно користе у производњи металних стентова су нерђајући челик, кобалт-хром и нитинол.[15] Добра страна ових материјала је што могу да издрже високе притиске и остану у организму до краја живота пацијента. Међутим примене ове технологије може да изазове и компликације међу којима су најважније;
- Тромбоза и рестеноза због неоинтималне хиперплазија.[14]
- Нееластичност, релативно велика крутост стента.
- Мале димензије арматуре стента, које се могу утиснути у зид крвног суда и изазвати запаљењски процес. (Зато се спроводе истраживања која треба да процене ефекате различитих геометријских облика и величина стента у складу са карактеристикама зида и интраканалним промером артерија или других канала у које се уграђује.[16]
Стентови од метала се обично производе зајено са балоном за дилатацију (проширење лумена цевастог суда) у јасно дефинисаним величинама или коначном облику, који се након апликације (довођења) на место имплантације отвара (проширује) надувавањем балона уграђеног у зид катетера подешава до сталног или коначног облика.[17]
Други начин имплантације стента заснива се на примени „самоекспандирајућег стента“, који је дизајниран у облику и величини у зависности од његове намене. Када се стент („у склопљеном стању“) лоцира у предео интраканалног сужења он се отвара и захваљујући својој еластичности остаје раширен (отворен) у својој оригиналној величини. Зато се за ову намену користе се нитинол стентови који поседују особину „меморисања задате величине“.[17]
Метални самоекспандирајуће стентови изазвају већи проценат рестеноза од балоном проширивих стентова због спољњег притиска који стимулише већи раст неоинтиме.[18]
Леком обложени стентови
[уреди | уреди извор]
Леком обложени метални стентови су посебним технолошким процесом полимером обложени стентови који у себи садржи лек који смањењује неоинтималну хиперплазију. Тренутна технологија, која се примењује, према бројним истраживањима умањила је рестенозу за 60-80%, у односу на необложене, металне стентове.[14][19]
Генерално гледано, ову врсту стента чине следеће три основне компоненте;[20]
- Платформа, скелет или основа стента. Физичке особине платформе стента играју важну улогу у једноставнијем кретању садржаја што ограничава рестенозу. Низ физичких параметара платформе стента, као што је начин ширења, састав материјала, глаткоћа површина, дебљина битно утичу на квалитет стента.
- Преносилац (најчешће је један од потпуно биоразградивих или неразградивих полимера) који у себе може да примеи лек.
- Лек (медикамент), најчешће су то сиролимус (Rapamycin)[21][22] паклитаксел (Paclitaxel),[23] и њихови аналози сиролимус-еверолимус и зотаролимус (sirolimus–everolimus, zotarolimus)[24]. Такролимус и пимеркролимус су још увек у фази истраживања и постоје опречни ставови око успешности њихове примене[20] .
Иако су леком обложени стентови направили велики напредак у лечењу многих кардиоваскуларних болести, још увек је далеко од идеалног да се значајно смање или чак елиминишу неке срчане и друге васкуларне болести применом стента, пре свега због њихове улоге у развоју рестенозе (због неоинтималне хиперплазије и нешто убрзанијег процеса атеросклерозе).[25]) и одложене тромбозе (због непотпуне ендоепителизацији арматуре стента)[25])
Примена биоразградивих и биокомпатибилних биоматеријали би требало да буде првенствена опција у даљем истраживањима и техничким решењима нових генерација стентова, (као што то Ваксман наводи у свом чланку "да раде свој посао, а онда нестану"[26]. При чему лек или комбинација лекова треба да има минимални инфламаторни одговор, да ефикасно спречава појаву запаљења и да не уништава поновну ендотелизацију како би се спречила тромбоза.[20]
Биоресорптивни стентови
[уреди | уреди извор]Традиционални стентови направљени су од металне мрежице и они остају у телу болесника трајно или до њиховог уклањања разним хируршким интервенцијама. За разлику од њих биоресорптивни стентови имају исту намену, али су произведен од растворљивог, ресорптивног или апсорптивног материјала и после одређеног времена ишчезавају из организма. У многим случајевима, ови стентови имају и психолошку предност јер њихову уградњу многи болесници боље прихватају.[27]
Захтеви које морају да испуњавају биоресорптивни (биоразградиви) коронарни стентови према др Ванкатраману (Venkatraman) и сарадницима су следећи;[15]
- Материјал од кога је стент израђен, као и његови деградациони производи морају бити биокомпатибилни.
- Структурни интегритет, до почетка деградације (ресорпције), стент мора да одржи најмање шест месеци од уградње а пуна деградацију треба да настане тек након 12-18 месеци.
- Деградација стента не сме да буде праћена одвајањем комадићима материјала који би он отпушта у лумен.
- Стента мора бити разместив било његовим ширењем уз помоћ балон катетера или сопственим ширењем.
- Након инплантације стент мора да буде безбедно „усидрен“ и не сме да мигрира у лумену. Стент такође мора да буда у стању да издржи структурне контракција мишића крвних судова.
- Стент мора бити радиолошки непрозиран и да омогућава безбедну и лаку примену.
Кардиоваскуларни стентови
[уреди | уреди извор]Коронарни стентови
[уреди | уреди извор]
Коронарна артеријска болест која је најчешће узрокована атеросклерозе има за последицу акумулацију атероматозних плакова на зидовима артерија. Сужавање и стврдњавање зида артерија доводи до смањења или потпуног престанка протока крви што узрокује ангинозне болове и инфаркт.[29]
Интервентном кардиолошком методом под називом ангиопластика балон катетер са стентом се кроз крвни суд лагано помера до места сужења са циљем да се оно прошири (отклони) и обнови проток крви, што боленсику смањује ангинозне болове и друге симптоме дисплазије. Ако је артерија превише мала, обично се на место сужења у оболелом делу артерије током ангиопластике имплантира стент, који подржава проширени зид артерије и спречава његово поновно сужавања и спречава појаву рестенозе или поновљени прекид протока крви. Стента такође може да подржи артерију ако је дошлп до њеног цепања или повреде током ангиопластике.
Стента је за организам страни материјал који изазива природни процес згрушавања крви у организму, што покрећа реакцију крвних плочица и појаву коагулације, која може стварањем тромботичних маса да изазове рестенозу или застој протока крви кроз стент.[30] Тромбоза стента се може спречени применом антикоагулантне терапије која се примењује све док ендотелне ћелије крвног суда потпуно не обложе стент и изолују га од контакта са крвљу.[14]
Процес проширења крвног суда балоном и имплантација стента оштећује зид артерија и доводи до неоинтималне хиперплазија, претеране реакције интиме крвног суда[14]. Неоинтимална реакција изазива хиперплазију ендотела и рестенозу која се дефинише као смањење величине лумена крвног суда након интеревенције.[31]
Ремоделовањем зида артерије настаје процес обновљеног протока крви и пацијенту се спашава живота.
Када се метални стентови користе рестеноза се може јавити приближно до шест месеци након имплантације а лумен крвног суда се повећава између шест месеци и три године након имплантације.[32] тако да после тог времена (око шест месеци) стент више није потребан да обезбеди скелет или потпору проширеном крвном суду након интервенције.[33]
Каротидни стентови
[уреди | уреди извор]Каротидне артерије су магистралниу крвни судови који се налазе са десне и леве стране врата. Ове артерије „транспортују“ „крв“ од срца до мозга. Атероматозни плакови такође могу да сузе и каротидне артерије. Када се то деси, ово стање се назива болест каротидних артерија.
Наслага на каротидним артеријама ограничавају проток крви у мозак и стварају услове за могућу појаву можданог удара. Исти етиолошки фактори који повећавају ризик од дисплазије у коронарним артеријама, повећавају и ризик за настанак болести каротидних артерија.
Стентови се примењују у стенозираним каротидним артеријама да помогну у њиховој потпуном отворању (реканалисању) након извршеног интервентног ширења балон катетером (ангиопластиком). Колико је дугорочно гледано успех овог третман још увек није познато. Истраживања које су у току треба да открију све могуће ризике и користи од уградње каротидног артеријског стента.[28]
Стентови за трбушну или грудну аорту
[уреди | уреди извор]Главна артерија која полази из срца и врши снабдева тела крвљу назива се аорта. Аорте „путује“ кроз грудни кош наниже у трбушну дупљу где се код четвтог слабинског пршљена рачва у леву и десну заједничку илијачну артерију. Током времена, код неких дегенеративних болести делови њеног зида, трпе промене, које ослабљују (истањују) зид аорте. У овим ослабљеним деловима аорте сила крви гура ослабљени зид крвног суда и ствара испупчење познато под називом анеуризма.[34]
Зидови анеуризме аорте могу да се упале и „поцепају“ (руптуририрају), најчешће у њеном трбушном делу али се исти процес може развити и у грудном делу аорте, што доводи до потенцијалног смртоносног унутрашњег крварење. Обе врсте анеуризми аорте се успешно могу лечити ендоваскуларном имплантацијом аорталног стента (стент графта),[35] у пределу ослабљеног или проширеног дела трбушне или грудне аорте, и са унутрашње стране ојачава њен зид.[36]
Још један проблем који може да настане у аорти је појава шупљине (дисекције) у њеном унутрашњем зиду, у коју под силом притиска крви може да дође до њеног све већег ширења. Ова промена може смањити проток крви до ткива која се снабдевају крвљу из тог дела аорте. Током времена, може доћи до потпуног прекида проток крви кроз аорту или до пуцања њеног зида (што се најчешће се дешава у грудном делу аорте).
За ову ендоваскуларну интервенцију постоји посебна врста стентова који се примењују у спречавању продор крви у проширења (дисекцију) у зиду аорте. Имплантација стент графта у оштећени део аорте (види слику десно) може да помогне у обнови нормалног проток крви и смањи ризик од компликација.
...„Колико је функција ових стентова успешна на дужи временски рок још увек није познато јер се ради о релативно новој методи која се и даље истражује кроз бројне медицинске студије“...[28]
Стентови за остале артерије
[уреди | уреди извор]
У бубрежним артеријама, као и у другим крвним судовима, могу настати сужења која смањују проток крви кроз бубрег, што за последицу може имати поремећај његових функција; смањено излучивања мокраће и поремећај контроле крвног притиска са развојем малигне хипертензије.
Плакови у атеросклерози могу сузити лумен и артерија у рукама и ногама током времена. Када се то догоди, ово стање се назива болест периферних артерија или Периферна васкуларна болест. Сужења лумена у периферној васкуларној болести најчешће прати појава бола и грчева (калудикација) у погођеном уду. Ако су сужање крвног суда тешка, може настати и потпуни прекид проток крви кроз погођени уд, што захтева хитну интервенцију због претеће некрозе и гангрене.
Да би се ублажили ови васкуларни поремећаји, и реканалисао лумен (суженог-зачепљеног) крвног суда може се применити интервентна ангиопластика на суженим артеријама бубрега, руку, ногу или на другим артеријама. Поступак ангиопластике је често праћен и инплантацијом стента у сужену артерију што помаже да она остане трајно, потпуно отворена.
Уретерални стент
[уреди | уреди извор]Уретерални стент је танка цев (врста стента) која се умеће у уретер да спречи или лечи застоје у излучивању мокраће из бубрега и штити његове функције, које могу бити угрожене, нпр. бубрежним каменом, крвним угрушком итд.[38]
Стентови који се користи код одраслих пацијената су различите дужине која варира између 24 и 30 cm. и различитог пречника или ширине, како би својим димензијама одговарали различитим промерима лумена уретера. Уретерални стент се обично умеће уз помоћ уролошког инструмента цистоскопа. Један или оба краја стента могу бити са „кружним омчама“ које треба да спрече померање стента са места. Ове врсте стентова се зову; ЈЈ стент, дупли Ј стент или прасећи реп стент (енгл. JJ stent, double J stent or pig-tail stent).[39]

Види још
[уреди | уреди извор]Извори
[уреди | уреди извор]- ^ Pauli, E. M.; Schomisch, S. J.; Furlan, J. P.; Marks, A. S.; Chak, A.; Lash, R. H.; Ponsky, J. L.; Marks, J. M. (2012). „Biodegradable esophageal stent placement does not prevent high-grade stricture formation after circumferential mucosal resection in a porcine model”. Surg Endosc. 26 (12): 3500—3508. PMC 4562670
 . PMID 22684976. doi:10.1007/s00464-012-2373-6.
. PMID 22684976. doi:10.1007/s00464-012-2373-6.
- ^ а б в г Malvin E. Ring How a Dentist's Name Became a Synonym for a Life-saving Device: The Story of Dr. Charles Stent (Journal of the History of Dentistry 200l julio:49 (2)
- ^ (језик: енглески)Stent (skin grafting, etc) „Eponimi na whonamedit”. Приступљено 25. 4. 2013.
- ^ а б в How a Dentist's Name Became a Synonym for a Life-saving Device: The Story of Dr. Charles Stent (Journal of the History of Dentistry 200l julio:49 (2). Citado en [1] Архивирано на сајту Wayback Machine (2. децембар 2008), Приступљено 25. 4. 2013.
- ^ Bloom, D. A., Clayman, R. V. and McDougal, E. „Stents and Related Terms: A brief History.”. Urology. 54: 767—771. 1991..
- ^ Malvin E. Ring The Story of Dr. Charles Stent „Dental History”. Архивирано из оригинала 03. 02. 2011. г.
- ^ Biographic sketch of Andreas Gruentzig. [2] Posećeno 25.01.2011
- ^ Mueller, R. L.; Sanborn, T. A. (1995). „The history of interventional cardiology: Cardiac catheterization, angioplasty, and related interventions”. Am Heart J. 129 (1): 146—72. PMID 7817908. doi:10.1016/0002-8703(95)90055-1.
- ^ King Sb, 3rd (1996). „Angioplasty from bench to bedside to bench”. Circulation. 93 (9): 1621—9. PMID 8653865. doi:10.1161/01.CIR.93.9.1621..
- ^ Brener, S. J. (2006). „Insights into the pathophysiology of ST-elevation myocardial infarction”. American Heart Journal. 151 (6 Suppl): S4—10. PMID 16777509. doi:10.1016/j.ahj.2006.04.007.
- ^ Petersen S, Peto V, Rayner M, Leal J, Luengo-Fernandez R, Gray A. Brussels: European Union; European cardiovascular disease statistics: 2005 edition; pp. 100.
- ^ Gruntzig, A. (1978). „Transluminal dilatation of coronary-artery stenosis”. Lancet (London, England). 1 (8058): 263. PMID 74678. S2CID 54405249. doi:10.1016/s0140-6736(78)90500-7.
- ^ Foschia, F.; De Angelis, P.; Torroni, F.; Romeo, E.; Caldaro, T.; Di Abriola, G. F.; Pane, A.; Fiorenza, M. S.; De Peppo, F.; Dall'Oglio, L. (2011). „Custom dynamic stent for esophageal strictures in children”. Journal of Pediatric Surgery. 46 (5): 848—853. ISSN 0022-3468. PMID 21616239. doi:10.1016/j.jpedsurg.2011.02.014.
- ^ а б в г д Kukreja, N., Onuma, Y., Daemen, J., and Serruys, P., 2008, The future of drug-eluting stents, Pharmacological Research, 57, pp. 171–180.
- ^ а б Venkatraman, S., Boey, F., and Lao, L. L., 2008, Implanted cardiovascular polymers: Natural, synthetic and bio-inspired, Progress in Polymer Science, 33, pp. 853–874.
- ^ Capelli, C., Gervaso, F., Petrini, L., Dubini, G., and Migliavacca, F., 2009, Assessment of tissue prolapse after balloon-expandable stenting: Influence of stent cell geometry, Medical Engineering & Physics, 31, pp. 441–447
- ^ а б Stoeckel D, Bonsignore, C., and Duda, S., 2002, A Survey of Stent Designs, Min. Invas.Ther.&Allied Technol., 11(4), pp. 137-147.
- ^ Morton, A., Crossman, D., and Gunn, J., 2004, The influence of physical stent parameters upon restenosis, Pathologie Biologie, 52, pp. 196-205.
- ^ Tokar, Jeffrey L.; Banerjee, Subhas; Barth, Bradley A.; Desilets, David J.; Kaul, Vivek; Kethi, Sripathi R.; Pedrosa, Marcos C.; Pfau, Patrick R.; Pleskow, Douglas K.; Varadarajulu, Shyam; Wang, Amy; Wong Kee Song, Louis-Michel; Rodriguez, Sarah A. (2011). „Drug-eluting/Biodegradable stents”. Gastrointest Endosc. 74 (5): 954—958. PMID 21944310. doi:10.1016/j.gie.2011.07.028.
- ^ а б в Xiaodong Ma, Tim Wu, Michael P Robich, Xingwei Wang, Hao Wu, Bryan Buchholz, and Stephen McCarthy, Drug-eluting stents. Int J Clin Exp Med. 3 (3): 192—201. 2010. PMC 2929945
 //www.ncbi.nlm.nih.gov/pmc/articles/PMC2929945. Недостаје или је празан параметар
//www.ncbi.nlm.nih.gov/pmc/articles/PMC2929945. Недостаје или је празан параметар |title=(помоћ) - ^ Tanner, F. C.; Boehm, M.; Akyürek, L. M.; San, H.; Yang, Z. Y.; Tashiro, J.; Nabel, G. J.; Nabel, E. G. (2000). „Differential effects of the cyclin-dependent kinase inhibitors p27(Kip1), p21(Cip1), and p16(Ink4) on vascular smooth muscle cell proliferation”. Circulation. 101 (17): 2022—2025. PMID 10790340. S2CID 16171796. doi:10.1161/01.cir.101.17.2022.
- ^ Tanner, F. C.; Boehm, M.; Akyürek, L. M.; San, H.; Yang, Z. Y.; Tashiro, J.; Nabel, G. J.; Nabel, E. G. (2000). „Differential effects of the cyclin-dependent kinase inhibitors p27(Kip1), p21(Cip1), and p16(Ink4) on vascular smooth muscle cell proliferation”. Circulation. 101 (17): 2022—2025. PMID 10790340. S2CID 16171796. doi:10.1161/01.cir.101.17.2022.
- ^ Abal, M.; Andreu, J. M.; Barasoain, I. (2003). „Taxanes: Microtubule and centrosome targets, and cell cycle dependent mechanisms of action”. Current Cancer Drug Targets. 3 (3): 193—203. PMID 12769688. doi:10.2174/1568009033481967.
- ^ Joner, M.; Nakazawa, G.; Finn, A. V.; Quee, S. C.; Coleman, L.; Acampado, E.; Wilson, P. S.; Skorija, K.; Cheng, Q.; Xu, X.; Gold, H. K.; Kolodgie, F. D.; Virmani, R. (2008). „Endothelial cell recovery between comparator polymer-based drug-eluting stents”. Journal of the American College of Cardiology. 52 (5): 333—342. PMID 18652940. doi:10.1016/j.jacc.2008.04.030.
- ^ а б Nakazawa, G., Vorpahl, M., Finn, A. V., Narula, J., and Virmani, R., 2009, One Step Forward and Two Steps Back With Drug-Eluting-Stents, Journal of the American College of Cardiology.: CardiovascularImaging, 2(5), pp. 625-628.
- ^ Waksman, R. (2006). „Biodegradable stents: They do their job and disappear”. The Journal of Invasive Cardiology. 18 (2): 70—74. PMID 16446520.
- ^ Serruys, PW (14. 3. 2009). Ormiston JA, Onuma Y. „A bioabsorbable everolimus-eluting coronary stent system (ABSORB): 2-year outcomes and results from multiple imaging methods”. Lancet. 373 (9667): 897—910..
- ^ а б в How Are Stents Placed? „National Institutes of Health”. Приступљено 25. 4. 2013.
- ^ Venkatraman, S., Boey, F., and Lao, L. L., 2008,Implanted cardiovascular polymers: Natural, synthetic and bio-inspired, Progress in Polymer Science, 33, pp. 853–874.
- ^ Kukreja, N., Onuma, Y., Daemen, J., and Serruys, P., 2008, The future of drug-eluting stents, Pharmacological Research, 57, pp. 171–180
- ^ Brown, D., Lee, E. W., Loh, C. T., and Kee, S. T., 2009, A New Wave in Treatment of Vascular Occlusive Disease: Biodegradable Stents—Clinical Experience and Scientific Principles, J. Vasc. Interv. Radiol., 20, pp. 315–325.
- ^ Kimura, Takeshi; Yokoi, Hiroyoshi; Nakagawa, Yoshihisa; Tamura, Takashi; Kaburagi, Satoshi; Sawada, Yoshihiro; Sato, Yasukazu; Yokoi, Hiroatsu; Hamasaki, Naoya; Nosaka, Hideyuki; Nobuyoshi, Masakiyo (1996). „Three-Year Follow-up after Implantation of Metallic Coronary Artery Stents”. New England Journal of Medicine. 334 (9): 561—567. PMID 8569823. doi:10.1056/NEJM199602293340903.
- ^ Tamai, H., Igaki, K., Kyo, E., Kosuga, K., Kawashima, A., Matsui, S., Komori, H., Tsuji, T., Motohara, S., and Uehata, H., 2000, Initial and 6-Month Results of Biodegradable Poly-lLactic Acid Coronary Stents in Humans, Circulation, 102(4), pp. 399–404
- ^ Gloviczki P, Ricotta JJ II. Aneurysmal vascular disease. In: Townsend CM, Beauchamp RD, Evers BM, Mattox KL, eds. Sabiston Textbook of Surgery. 18th ed. Philadelphia, Pa: Saunders Elsevier; 2008:chap 65.
- ^ Endurant Stent Graft System - P100021, Approval Date: December 16, 2010 U.S. Food and Drug Administration
- ^ Robert A. Cowles. „Aortic aneurysm repair - endovascular”. MedlinePlus Medical Encyclopedia. Приступљено 25. 4. 2013.
- ^ Abdominal Aortic Aneurysm „The Patient Education Institute”. Приступљено 25. 4. 2013.
- ^ Saltzman, B. (1988). „Ureteral stents – indications, variations and complications”. Urological Clinics of North America. 15 (3): 481—491. PMID 3043868. doi:10.1016/S0094-0143(21)01594-9.
- ^ Having a Ureteric Stent - What to Expect and How to Manage. Authors: Mr. H. B. Joshi (Specialist Registrar in Urology, Cambridge. Formerly Research Registrar at Bristol Urological Institute), N. Newns (Staff Nurse), Mr. F. X. Keeley Jr. (Consultant Urologist), Mr. A. G. Timoney (Consultant Urologist), „Bristol Urological Institute, Southmead Hospital, Westbury-on-trym, Bristol BS10 5NB”. Приступљено 25. 4. 2013.
Литература
[уреди | уреди извор]- Myler KR: Coronary And Peripheral Angioplasty. Historical Perspective. U knjizi: Topol E. Textbook Of Interventional Cardiology. WB Saunders 2003. Str 141-161.
- Lepor NE, Madyoon H, Kereiakes D. Effective and efficient strategies for coronarz revascularisation in the drug eluting stent era. Rev Cardiovasc Med 2002; 3 (suppl 5) S38-S50.
- Buffon, A.; Liuzzo, G.; Biasucci, L. M.; Pasqualetti, P.; Ramazzotti, V.; Rebuzzi, A. G.; Crea, F.; Maseri, A. (1999). „Preprocedural serum levels of C-reactive protein predict early complications and late restenosis after coronary angioplasty”. Journal of the American College of Cardiology. 34 (5): 1512—1521. PMID 10551701. doi:10.1016/S0735-1097(99)00348-4..
- Morice MC, Serruys PW, Sousa JE, et al, for the RAVEL Study Group (2002). „A randomized comparison of a sirolimuseluting stent with a standard stent for coronary revascularization”. New England Journal of Medicine. 346 (23): 1773—80. PMID 12050336. doi:10.1056/NEJMoa012843..
- Colombo, A. (2002). „The "0%" restenosis study”. Ital Heart J. 3 (10): 559—561. PMID 12478812..
- Varenne O, Haghighat T, Allouch P, Himbert D, Benamer H, Spaulding C, Vahanian A. Percutaneous coronary intervention in acute coronary syndromes. U knjizi Marco J, Serruzs P, Biamino G, Fajadet J, de Fayter P, Morice MC, Wijns W, de Bruyne B, Vahanian A, Katzen B. The Paris Course on Revascularization, May 2003, str 209-218.
- Lemos, P. A.; Lee, C. H.; Degertekin, M.; Saia, F.; Tanabe, K.; Arampatzis, C. A.; Hoye, A.; Van Duuren, M.; Sianos, G.; Smits, P. C.; De Feyter, P.; Van Der Giessen, W. J.; Van Domburg, R. T.; Serruys, P. W. (2003). „Early outcome after sirolimus-eluting stent implantation in patients with acute coronary syndromes: Insights from the Rapamycin-Eluting Stent Evaluated at Rotterdam Cardiology Hospital (RESEARCH) registry”. Journal of the American College of Cardiology. 41 (11): 2093—2099. PMID 12798587. doi:10.1016/S0735-1097(03)00429-7..
- Redwood S, Patel SJ: Dexamet™ – An Anti-inflammatory Drug-eluting Stent Approach. Biseness briefing. European Pharmacotherapy 2003
- Coppel R et al. (March 2019) “Influence of Collaterals on True FFR Prediction for a Left Main Stenosis with Concomitant Lesions: An In Vitro Study” Annals of Biomedical Engineering 47(24)
- Saito N (July 2016) "Regarding article, “A multi-artery fractional flow reserve (FFR) approach for handling coronary stenosis–stenosis interaction in the multi-vessel disease (MVD) arena” International Journal of Cardiology 214.
Спољашње везе
[уреди | уреди извор] | Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |


