Лед
| Лед | |
|---|---|
 | |
| Физичке особине | |
| Густина (ρ) | 0,9167[1]–0,9168[2] g/cm3 |
| Индекс рефракције (n) | 1,309 |
| Механичка својства | |
| Јунгов модул (E) | 3400 до 37,500 kg-сила/cm3[2] |
| Затезна чврстоћа (σt) | 5 до 18 kg-сила/cm2[2] |
| Компресивна јачина (σc) | 24 до 60 kg-сила/cm2[2] |
| Пуасонов однос (ν) | 0,36±0,13[2] |
| Термална својства | |
| Топлотна проводљивост (k) | 0,0053(1 + 0,105 θ) cal/(cm s K), θ = температура у °C[2] |
| Коефицијент линеарне термичке експанзије (α) | 5,5×10−5[2] |
| Специфични топлотни капацитет (c) | 0,5057 − 0,001863 θ cal/(g K), θ = апсолутна вредност температуре у °C[2] |
| Електрична својства | |
| Диелектрична константа (εr) | ~3,15 |
| Својства леда значајно варирају у зависности од температуре, чистоће и других фактора. | |
Лед представља чврсто агрегатно стање воде, које она достиже на температурама једнаким или мањим од 0 °C (тачка мржњења).[3][4] Због специфичног просторног распореда који молекули воде тада заузимају, лед има мању густину од воде (за око 8,5%) и плута на њеној површини (видети Вода: Агрегатна стања). При смрзавању, запремина воде се повећава за око 11%.[5][6]
Специфична топлота леда је дупло мања од воде у течном стању. Због тога се лед релативно брзо образује на површини воде расхлађене до температуре од 0 °C, а за његово топљење потребна је много мања количина топлоте (79,72 цал г -1) него за упаравање течне воде (539,6 цал г -1). Повећањем салинитета снижава се тачка мржњења воде; тако се морска вода (просечног салинитета од 35 g Л -1) мрзне тек на -1,91 °C.[7][8] Највеће количине леда у биосфери се налазе у поларним капама.
Лед није само својство крутости воде. Наиме, таква врста леда се у науци назива „водени лед“, док готово сваки гасовити спој при одређеним температурама и притиском може прећи у стање леда. Гледано у свемиру, на Марсу постоје одређене количине воденог леда, али нпр. на Плутону постоји тзв. метански лед, на Урану амонијаков лед итд.
У Сунчевом систему леда има у изобиљу и природно се јавља већ на блиском растојању од Сунца, попут Меркура, те све до објеката Ортовог облака. Изван Сунчевог система јавља се као међузвездани лед. Има га доста на површини Земље - нарочито у поларним регионима и изнад снежне границе[9] – и, као уобичајен облик падавина и таложења, игра кључну улогу у циклусу воде Земље и клими. Лед пада у виду пахуљице и града, или се јавља као мраз, леденице или ледени шиљци и агрегати од снега као глечери и ледени покривачи.
Физичка својства
[уреди | уреди извор]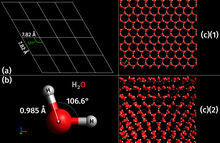
Као природна кристална неорганска чврста супстанца са уређеном структуром, лед се сматра минералом.[12][13] Поседује правилну кристалну структуру засновану на молекулу воде, који се састоји од једног атома кисеоника ковалентно везаног за два атома водоника, или H–O–H. Међутим, многа физичка својства воде и леда контролишу се формирањем водоничних веза између суседних атома кисеоника и водоника; иако је то слаба веза, кључна је за контролу структуре воде и леда.
Необично својство воде је то што је њен чврсти облик - лед замрзнут при атмосферском притиску - приближно 8,3% мање густ од течног облика; ово је еквивалентно запреминском проширењу од 9%. Густина леда је 0,9167[1] –0,9168[2] g/cm3 на 0 °C и стандардном атмосферском притиску (101,325 Pa), док вода има густину од 0,9998[1]–0.999863[2] g/cm3 на истој температури и притиску. Течна вода је најгушћа, у суштини 1,00 g/cm³ на 4 °C и почиње да губи своју густину како молекули воде почињу да формирају хексагоналне кристале леда када се достигне тачка смрзавања. То је због водоничне везе која доминира међумолекулским силама, што доводи до паковања молекула мање компактних у чврстом материјалу. Густина леда се благо повећава са смањењем температуре и има вредност од 0,9340 g/cm3 при -180 °C (93 K).[14]
Када се вода смрзне, повећава се запремина (око 9% за слатку воду).[15] Ефекат ширења током смрзавања може бити драматичан, а ширење леда основни је узрок пропадања стена смрзавањем и одмрзавањем у природи и оштећења темеља зграда и путева услед налета мраза. Такође је чест узрок поплава кућа када пукну водоводне цеви због притиска воде која се шири када се смрзне.
Резултат овог процеса је да лед (у свом најчешћем облику) плута на течној води, што је важна карактеристика у биосфери Земље. Тврдило се да би се без овог својства природна водна тела замрзнула, у неким случајевима трајно, одоздо према горе,[16] што би довело до губитка животињског и биљног света зависног од дна у слаткој и морској води. Довољно танки ледени покривачи омогућавају пролаз светлости штитећи доњу страну од краткотрајних временских екстрема, попут ветра. Ово ствара заштићено окружење за колоније бактерија и алги. Када се морска вода смрзне, лед је прожет каналима испуњеним сланом водом који одржавају симпагичне организме као што су бактерије, алге, копеподи и анелиди, који заузврат обезбеђују храну за животиње као што су крил и специјализоване рибе, попут Pagothenia borchgrevinki, којом се потом хране веће животиње као што су царски пингвини и минке китови.[17]
Када се лед топи, он апсорбује толико енергије колико би било потребно да се једнака маса воде загреје за 80 °C. Током процеса топљења, температура остаје константна на 0 °C. Током топљења, свака додатна енергија прекида водоничне везе између молекула леда (воде). Енергија постаје доступна за повећање топлотне енергије (температуре) тек након што се прекине довољно водоникових веза да се лед може сматрати течном водом. Количина енергије која се троши при разбијању водоникових веза при прелазу из леда у воду позната је као топлота фузије.
Као и код воде, лед апсорбује светлост на црвеном крају спектра, првенствено као резултат призвука истезања везе кисеоник-водоник (O–H). У поређењу са водом, ова апсорпција се помера ка нешто нижим енергијама. Стога лед изгледа плаво, са нешто зеленијом нијансом од течне воде. Будући да је апсорпција кумулативна, ефекат боје се појачава са повећањем дебљине или ако унутрашње рефлексије доводе до тога да светлост иде дужим путем кроз лед.[18]
Друге боје се могу појавити у присуству нечистоћа које апсорбују светлост, при чему нечистоћа диктира боју, а не сам лед. На пример, ледени брегови који садрже нечистоће (нпр. седименте, алге, мехуриће ваздуха) могу изгледати браон, сиво или зелено.[18]
Референце
[уреди | уреди извор]- ^ а б в Harvey, Allan H. (2017). „Properties of Ice and Supercooled Water”. Ур.: Haynes, William M.; Lide, David R.; Bruno, Thomas J. CRC Handbook of Chemistry and Physics (97th изд.). Boca Raton, FL: CRC Press. ISBN 978-1-4987-5429-3.
- ^ а б в г д ђ е ж з и Voitkovskii, K. F., Translation of: "The mechanical properties of ice" ("Mekhanicheskie svoistva l'da") (PDF) (на језику: енглески), Academy of Sciences (USSR), Архивирано (PDF) из оригинала 10. 2. 2017. г.
- ^ „Definition of ICE”. www.merriam-webster.com (на језику: енглески). Приступљено 2018-06-19.
- ^ „the definition of ice”. www.dictionary.com (на језику: енглески). Приступљено 2018-06-19.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Група аутора (2003). Атлас фосила и минерала. Креативни центар: Београд.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ур. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th изд.). Merck Publishing. ISBN 0911910131.
- ^ Prockter, Louise M. (2005). „Ice in the Solar System” (PDF). Johns Hopkins APL Technical Digest. 26 (2): 175. Архивирано из оригинала (PDF) 19. 3. 2015. г. Приступљено 21. 12. 2013.
- ^ R. W. Whitworth (1999). Physics of Ice. Oxford University Press. ISBN 9780198518945.
- ^ Bernal, J. D.; Fowler, R. H. (1933). „A Theory of Water and Ionic Solution, with Particular Reference to Hydrogen and Hydroxyl Ions”. The Journal of Chemical Physics. 1 (8): 515. Bibcode:1933JChPh...1..515B. doi:10.1063/1.1749327.
- ^ Demirbas, Ayhan (2010). Methane Gas Hydrate. Springer Science & Business Media. стр. 90. ISBN 978-1-84882-872-8.
- ^ „The Mineral Ice”. minerals.net. Приступљено 2019-01-09.
- ^ Lide, D. R., ур. (2005). CRC Handbook of Chemistry and Physics (86th изд.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Sreepat, Jain. Fundamentals of Physical Geology. New Delhi: Springer, India, Private, 2014. 135. Print. ISBN 978-81-322-1538-7.
- ^ Tyson, Neil deGrasse. „Water, Water”. haydenplanetarium.org. Архивирано из оригинала 26. 7. 2011. г.
- ^ Sea Ice Ecology Архивирано 21 март 2012 на сајту Wayback Machine. Acecrc.sipex.aq. Retrieved 30 October 2011.
- ^ а б Lynch, David K.; Livingston, William Charles (2001). Color and light in nature. Cambridge University Press. стр. 161—. ISBN 978-0-521-77504-5.
Литература
[уреди | уреди извор]- Група аутора (2003). Атлас фосила и минерала. Креативни центар: Београд.
- Rothrock, D.A.; Zhang, J. (2005). „Arctic Ocean Sea Ice Volume: What Explains Its Recent Depletion?” (PDF). J. Geophys. Res. 110 (C1): C01002. Bibcode:2005JGRC..11001002R. doi:10.1029/2004JC002282
 .
. - „All About Sea Ice”. National Snow and Ice Data Center, University of Colorado, Boulder.
- Vinnikov, K.Y.; Cavalieri, D.J.; Parkinson, C.L. (март 2006). „A model assessment of satellite observed trends in polar sea ice extents”. Geophys. Res. Lett. 33 (5): L05704. Bibcode:2006GeoRL..33.5704V. CiteSeerX 10.1.1.594.2054
 . doi:10.1029/2005GL025282.
. doi:10.1029/2005GL025282. - „Cryosphere Glossary”. National Snow and Ice Data Center, University of Colorado, Boulder.
- „Ice Glossary”. Environment Canada. 2010-09-27.
- „WMO Sea-Ice Nomenclature”. World Meteorological Organization. WMO/OMM/ВМО – No. 259 • Edition 1970–2004.[мртва веза]
- „Sea Ice Ecology”. Sea Ice Physics and Ecosystem eXperiment (SIPEX). Antarctic Climate & Ecosystems CRC. Архивирано из оригинала 2012-03-20. г. Приступљено 23. 6. 2012.
- Barber, D. G.; Iacozza, J. (март 2004). „Historical analysis of sea ice conditions in M'Clintock Channel and the Gulf of Boothia, Nunavut: implications for ringed seal and polar bear habitat”. Arctic. 57 (1): 1—14. JSTOR 40512590. doi:10.14430/arctic478.
- Stirling, I.; Lunn, N. J.; Iacozza, J.; Elliott, C.; Obbard, M. (март 2004). „Polar bear distribution and abundance on the southwestern Hudson Bay coast during open water season, in relation to population trends and annual ice patterns”. Arctic. 57 (1): 15—26. JSTOR 40512591. doi:10.14430/arctic479.
- Stirling, I.; Parkinson, C. L. (септембар 2006). „Possible effects of climate warming on selected populations of polar bears (Ursus maritimus) in the Canadian Arctic” (PDF). Arctic. 59 (3): 261—275. JSTOR 40512813. doi:10.14430/arctic312. hdl:2060/20060020227
 .
.
Спољашње везе
[уреди | уреди извор]- Фазни дијаграм воде, укључујући варијанте леда
- Листинг за лед на сатју Webmineral
- Листинг за лед и подаци о локацији на сајту MinDat.org
- Физика леда
- Фазни дијаграми воде са неким дијаграмима високог притиска
- Недавно откриће о топљењу леда
- 'Незамрзива вода', 'везана вода' и вода хидрације
- Електромеханичка својства леда
- Estimating the bearing capacity of ice
- High-temperature, high-pressure ice
- The Surprisingly Cool History of Ice

