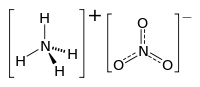
Амонијум нитрат
| |
| |

| |
| Називи | |
|---|---|
| IUPAC назив
Amonijum nitrat
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.026.680 |
| EC број | 229-347-8 |
| RTECS | БР9050000 |
| УНИИ | |
| УН број | 0222 – са > 0,2% запаљивих супстанци 1942 – са <= 0,2% запаљивих супстанци 2067 – ђубрива 2426 – течност |
| |
| Својства | |
| NH4NO3 | |
| Моларна маса | 80,043 g/mol |
| Агрегатно стање | бела чврста материја |
| Густина | 1,725 g/cm³ (20°C) |
| Тачка топљења | 169,6 °C (337,3 °F; 442,8 K) |
| Тачка кључања | aproks. 210 °C (410 °F; 483 K) razlaže se |
| Ендотермичан 118 g/100 ml (0°C) 150 g/100 ml (20°C) 297 g/100 ml (40°C) 410 g/100 ml (60°C) 576 g/100 ml (80°C) 1024 g/100 ml (100°C)[3] | |
| -33,6·10−6 cm³/mol | |
| Структура | |
| Кристална решетка/структура | тригонална |
| Експлозивност | |
| Осетљивост на шок | веома ниска |
| Осетљивост на трење | веома ниска |
| Брзина детонације | 2500 m/s |
| Опасности | |
| Опасност у току рада | Експлозиван, оксидирајући |
| ГХС графикони |   
|
| ГХС сигнална реч | Опасност |
| Х201, Х271, Х319 | |
| П220, П221, П271, П280, П264, П372 | |
| НФПА 704 | |
| Летална доза или концентрација (ЛД, ЛЦ): | |
ЛД50 (ЛД50)
|
2085–5300 mg/kg (орално код пацова, мишева)[4] |
| Сродна једињења | |
Други ањони
|
Амонијум нитрит |
Други катјони
|
Натријум нитрат Калијум нитрат Хидроксиламонијум нитрат |
Сродна једињења
|
Амонијум перхлорат |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Хемијско једињење амонијум нитрат, нитрат амонијака са хемијском формулом NH4NО3, је бела кристална супстанца на собној температури и стандардном притиску, која је веома растворна у води. Он је у широкој употреби у агрикултури као ђубриво са високим садржајем азота.[6] Он се такође користи као оксидациони агенс у експлозивима. Он је главна компонента АНФО експлозива, популарног индустријског експлозива који сачињава 80% експлозива који се користе у Северној Америци; слична формулација је кориштена у импровизованим експлозивним направама. Многе земље поступно укидају његови примену у потрошачким апликацијама због забринутости у погледу могућих злоупотреба.[7]
Појава[уреди | уреди извор]
Амонијум нитрат се налази као природни минерал (гвахабет — амонијумски аналог нитера, и других нитратних минерала као што је натријум нитрата познат као нитратин) у најсувљим регионима пустиње Атакама у Чилеу, често као кора на земљишту и/или у спрези са другим нитратима, јодатима, и халидним минералима. Амонијум нитрат је ископаван тамо у прошлости, док се у данашње време скоро 100% ове хемикалије добија синтетичким путем.
Производња[уреди | уреди извор]
Процеси производње амонијум нитрата у индустрији су хемијски једноставни, мада представљају технолошки изазов. Киселинско-базна реакција амонијака са азотном киселином производи раствор амонијум нитрата:[8]
- HNO3(aq) + NH3(l) → NH4NO3(aq)
Амонијак се користи у својој анхидратној форми (и.е., гасовитој форми) и азотна киселина је концентрована. Ова реакција је бурна услед њене високо егзотермне природе. Након што се формира раствор, типично при концентрацији од око 83%, вишак воде се упарава до амонијум нитратног (АН) садржаја са концентрацијом од 95% до 99,9% (АН истопљен), у зависности од степена. Растопљени АН се затим обликује у глобуле или мале перле у спрејном торњу, или у грануле распршивањем и превртањем у ротирајућем бубњу. Глобуле или грануле се могу додатно сушити, охладити и затим пресвући како би се спречило згрушавање. Ове глобуле или грануле су типични АН продукти у продаји.
Амонијак који је неопходан за овај процес се добија путем Хаберовог процеса из азота и водоника. Амонијак произведен Хаберовим процесом се оксидује до азотне киселине путем Оствалдовог процеса. Алтернативни производни метод је варијанта Одовог процеса:
Продукти, калцијум карбонат и амонијум нитрат, се могу засебно пречистити или продавати у комбинацији као калцијум амонијум нитрат.
Амонијум нитрат се исто тако може формирати путем метатезних реакција:
Реакције[уреди | уреди извор]
Амонијум нитрат реагује са металним хидроксидима, при чему се ослобађа амонијак и формира нитрат алкалног метала:
- NH4NO3 + MOH → NH3 + H2O + MNO3 (M = Na, K)
Амонијум нитрат не оставља остатак кад се загрева:
- NH4NO3 → N2O + 2H2O
Кад се брзо загрева или при експлозијама предоминантна реакција је:
- 2NH4NO3 → 2N2 + O2 + 4H2O
Амонијум нитрат се исто тако формира у атмосфери од емисија NO, SO2, и NH3, и као секундарна компонента појединих ПМ10 честица.[9]
Кристалне фазе[уреди | уреди извор]
Трансформације кристалних стана услед промена услова (температуре, притиска) утичу на физичка својства амонијум нитрата. Следећа кристална стања су била идентификована:
| Систем | Температура ( °Ц) | Стање | Промена запремине (%) |
|---|---|---|---|
| > 169,6 | течности | ||
| I | 169,6 до 125,2 | кубна | −2.1 |
| II | 125,2 до 84,2 | тетрагонална | +1.3 |
| III | 84,2 то 32,3 | α-ромбна | −3,6 |
| IV | 32,3 до −16,8 | β-хомбна | +2.9 |
| V | < −16,8 | тетрагонална |
Тип V кристала је квази кубна форма сродна са цезијум хлоридом, азотни атоми нитратних ањона и амонијум катјони су места у кубној решетци где би Cs и Cl били у CsCl решетци.[10]
Примена[уреди | уреди извор]
Загревање или паљење може да изазове силовито сагоревање или експлозију.[11] Амонијум нитрат реагује са запаљивим и редукујућим материјалима као јак оксиданс. Он је у широкој употреби у ђубривима и експлозивима. Амонијум нитрати се такође користе за модификовање брзине детонације других експлозива. Примери су амонијумски динамити (нитроглицерин).
Ђубриво[уреди | уреди извор]
Амонијум нитрат је важно ђубриво са NPK ознаком 34-0-0 (34% азота).[12] Он је мање концентрован од урее (46-0-0), што даје амонијум нитрату извесну транспортну инфериорност. Амонијум нитратова предност у односу на уреу је да је он стабилнији и да брзо не губи азот у атмосферу.
Експлозиви[уреди | уреди извор]
Амонијум нитрат није, сам по себи, експлозив,[13] али се од њега лако формирају експлозивне смеше разних својстава кад се комбинује са примарним експлозивима као што су азиди или са горивима као што је алуминијумски прах или лож уље.
Смеша са лож уљем[уреди | уреди извор]
АНФО је смеша са 94% амонијум нитрата („АН”) и 6% лож уља („ФО”) која налази широку примену као индустријски експлозив.[14]:1 Он се користи у експлоатацији угља, каменоломима, рудницима метала, и грађевинарству у незахтевним апликацијама где су предности АНФО-ове ниске цене и лакоћа употребе важнији од предности које нуде конвенционални индустријски експлозиви, као што су отпорност на воду, баланс кисеоника, висока брзина детонације и перформансе у малим растојањима.[14]:2
Тероризам[уреди | уреди извор]
Експлозиви базирани на амонијум нитрату су кориштени у бомбардовању Стерлинг Хола у Мадисон, Висконсин, 1970, бомбашком нападу у Оклахома Цитију 1995, Делхијском бомбашком нападу 2011, нападима на Осло 2011, и експлозији у Хајдерабаду 2013. године.
У новембру 2009, забрана употребе амонијум сулфатних, амонијум нитратних, и калцијум амонијум нитратних ђубрива је уведена у бившој Малакандској области — која се састоји од округа Горњег Дира, Доњег Дира, Свата, Читрала и Малаканда Северозападне граничне провинције (НWФП) Пакистана — од стране НWФП владе, након извештаја да те хемикалије користе разне војне формације за прављење експлозива. Услед ових забрана, „калијум хлорат — материјал који узрокује паљење шибица — је заменио ђубрива као сировина за прављење експлозива међу побуњеницима.”[15]
Специјализоване примене[уреди | уреди извор]
Амонијум нитрат се користи у појединим инстантним хладним паковањем, јер је његово растварање у води веома ендотермно. Он се исто тако кориштен у комбинацији са независним експлозивним „горивима” као што је гванидин нитрат,[16][17] као јефтинија (мада мање стабилна) алтернатива за 5-аминотетразол у средствима за надувавање ваздушних јастука које производи Таката корпорација, који су били опозвани након су узроковали 14 смртних случајева.[18]
Референце[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Patnaik, Pradyot (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 978-0-07-049439-8.
- ^ Martel, B; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. стр. 362. ISBN 978-1-903996-65-2.
- ^ „Archived copy”. Архивирано из оригинала 17. 2. 2015. г. Приступљено 13. 3. 2015.
- ^ Karl-Heinz Zapp "Ammonium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2012, Wiley-VCH, Weinheim. . doi:10.1002/14356007.a02_243. Недостаје или је празан параметар
|title=(помоћ) - ^ Ammonium nitrate sold by ton as U.S. regulation is stymied. Архивирано на сајту Wayback Machine (28. фебруар 2018) - Тхе Даллас Морнинг Неwс
- ^ Process of producing concentrated solutions of ammonium nitrate
- ^ Инт Панис, ЛЛР (2008). „Тхе Еффецт оф Цхангинг Бацкгроунд Емиссионс он Еxтернал Цост Естиматес фор Сецондарy Партицулатес”. Опен Енвиронментал Сциенцес. 2: 47—53. дои:10.2174/1876325100802010047.
- ^ Цхои, C. С.; Праск, Х. Ј. (1983). „Тхе струцтуре оф НД4НО3 пхасе V бy неутрон поwдер диффрацтион”. Ацта Црyсталлограпхица Б. 39 (4): 414—420. дои:10.1107/С0108768183002669.
- ^ Патнаик, Прадyот (2002). Хандбоок оф Инорганиц Цхемицалс. МцГраw-Хилл. ИСБН 978-0-07-049439-8.
- ^ „Нутриент Цонтент оф Фертилизер Материалс” (ПДФ). Архивирано из оригинала (ПДФ) 24. 12. 2012. г. Приступљено 27. 6. 2012.
- ^ Манхаттан Бомбс Провиде Трове оф Цлуес - Тхе Неw Yорк Тимес
- ^ а б Цоок, Мелвин А. (1974). Тхе Сциенце оф Индустриал Еxплосивес. ИРЕЦО Цхемицалс. стр. 1. АСИН Б0000ЕГДЈТ.
- ^ Потассиум цхлорате — тхе стуфф тхат макес матцхес цатцх фире — хас сурпассед фертилизер ас тхе еxплосиве оф цхоице фор инсургентс.
- ^ УС 5531941
- ^ Аирбаг Цомпоунд Хас Веxед Таката фор Yеарс - Тхе Неw Yорк Тимес
- ^ А Цхеапер Аирбаг, анд Таката’с Роад то а Деадлy Црисис. - Тхе Неw Yорк Тимес
Литература[уреди | уреди извор]
- Патнаик, Прадyот (2002). Хандбоок оф Инорганиц Цхемицалс. МцГраw-Хилл. ИСБН 978-0-07-049439-8.
- Мартел, Б; Цассидy, К. (2004). Цхемицал Риск Аналyсис: А Працтицал Хандбоок. Буттерwортх–Хеинеманн. стр. 362. ИСБН 978-1-903996-65-2.
- Мартел, Б; Цассидy, К. (2004). Цхемицал Риск Аналyсис: А Працтицал Хандбоок. Буттерwортх–Хеинеманн. стр. 362. ИСБН 978-1-903996-65-2.
- Пропертиес: УНИДО анд Интернатионал Фертилизер Девелопмент Центер , Фертилизер Мануал. . Kluwer Academic Publishers. 1998. ISBN 978-0-7923-5032-3.
Спољашње везе[уреди | уреди извор]
- Интернационална карта хемијске безбедности 0216
- Складиштење и руковање амонијум нитратом
- "Сторинг анд Хандлинг Аммониум Нитрате", Унитед Кингдом Хеалтх анд Сафетy Еxецутиве публицатион ИНДГ230 (1986)
- Цхемицал Адвисорy: Сафе Стораге, Хандлинг, анд Манагемент оф Аммониум Нитрате Унитед Статес Енвиронментал Протецтион Агенцy
- Цалцулаторс: сурфаце тенсионс, анд денситиес, моларитиес анд молалитиес оф аqуеоус аммониум нитрате

