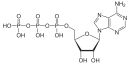Анхидрид органске киселине

ЦООХ и Р2
ЦООХ, са плаво означеном функционалном групом анхидрида карбоксилне киселине, где Р представља било коју групу (обично водоник или органил).
Анхидрид органске киселине је анхидрид киселине који је такође органско једињење. Анхидрид киселине је једињење које има две ацил групе везане за исти атом кисеоника.[1] Уобичајени тип анхидрида органске киселине је анхидрид карбоксилне киселине, где је матична киселина карбоксилна киселина, а формула анхидрида је (РЦ(О))2О. Симетрични анхидриди киселина овог типа добијају називе тако што се реч киселина у називу матичне карбоксилне киселине замењује речју анхидрид.[2] Дакле, (ЦХ3ЦО)2О се назива анхидрид сирћетне киселине. Познати су мешани (или несиметрични) анхидриди киселина, као што је ацетинско формински анхидрид (погледајте испод), при чему се реакција јавља између две различите карбоксилне киселине. Номенклатура несиметричних киселинских анхидрида наводи називе обе реаговане карбоксилне киселине пре речи „анхидрид“ (на пример, реакција дехидратације између бензојеве киселине и пропанске киселине би дала „бенyојев пропански анхидрид“).[3]
Једна или обе ацил групе анхидрида киселине могу такође бити изведене из друге врсте органске киселине, као што је сулфонска киселина или фосфонска киселина. Једна од ацил група анхидрида киселине може бити изведена из неорганске киселине као што је фосфорна киселина. Мешани анхидрид 1,3-бисфосфоглицеринске киселине, интермедијер у формирању АТП-а путем гликолизе,[4] је мешани анхидрид 3-фосфоглицеринске киселине и фосфорне киселине. Кисели оксиди се такође класификују као анхидриди киселина.
Номенклатура[уреди | уреди извор]
Номенклатура анхидрида органских киселина је изведена из назива саставних карбоксилних киселина. У симетричним анхидридима киселина користи се само префикс оригиналне карбоксилне киселине и додаје се суфикс „анхидрид“. За већину несиметричних анхидрида киселина – који се такође називају мешани анхидриди – префикси из обе реаговане киселине су наведени пре суфикса, нпр., бензојев пропаноински анхидрид.[5]
Припрема[уреди | уреди извор]
Анхидриди органских киселина се у индустрији припремају на различите начине. Анхидрид сирћетне киселине се углавном производи карбонилацијом [метхyл ацетате[|метил ацетата]].[6] Малеински анхидрид се производи оксидацијом бензена или бутана. Лабораторијски путеви наглашавају дехидратацију одговарајућих киселина. Услови варирају од киселине до киселине, али фосфор пентоксид је уобичајено средство за дехидратацију:
- 2 ЦХ3ЦООХ + П4О10 → ЦХ3C(О)ОЦ(О)ЦХ3 + "П4О9(ОХ)2"
Кисели хлориди су такође ефикасни прекурсори:[7]
- ЦХ3C(О)Цл + ХЦО2На → ХЦО2ЦОЦХ3 + НаЦл
Из кетена се припремају мешани анхидриди који садрже ацетил групу:
- РЦО2Х + Х2C=C=О → РЦО2C(О)ЦХ3
Реакције[уреди | уреди извор]
Анхидриди киселина су извор реактивних ацил група, а њихове реакције и употреба личе на реакције ацил халида. У реакцијама са протонским супстратима, ове реакције дају једнаке количине ацилираног производа и карбоксилне киселине:
- РЦ(О)ОЦ(О)Р + ХY → РЦ(О)Y + РЦО2Х
за ХY = ХОР (алкохоли), ХНР'2 (амонијак, примарни, секундарни амини), ароматични прстен (видети Фридел-Крафтсова ацилација).
Анхидриди киселина имају тенденцију да буду мање електрофилни од ацил хлорида, и само једна ацил група се преноси по молекулу анхидрида киселине, што доводи до ниже атомске ефикасности. Ниска цена, међутим, анхидрида сирћетне киселине чини га уобичајеним избором за реакције ацетилације.
Примене и појава анхидрида киселина[уреди | уреди извор]
- Илустрација киселих анхидрида
-
Анхидрид сирћетне киселине се производи у великим количинама за многе примене.
-
Нафталентетракарбоксилни дианхидрид, градивни блок за сложена органска једињења, је пример дианхидрида.
-
Малеински анхидрид је циклични анхидрид, који се широко користи за прављење индустријских премаза.
-
АТП у свом протонираном облику је анхидрид добијен из фосфорне киселине.
-
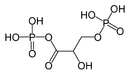
„Мешани анхидрид” 1,3-бисфосфоглицеринске киселине се широко јавља у метаболичким путевима.
-
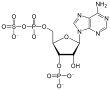
3'-фосфоаденозин-5'-фосфосулфат (ПАПС) је мешани анхидрид сумпорне и фосфорне киселине и најчешћи је коензим у реакцијама биолошког трансфера сулфата.
Анхидрид сирћетне киселине је значајна индустријска хемикалија која се користи у припреми ацетатних естара, е.г. целулозног ацетата. Анхидрид малеинске киселине је прекурзор разних смола које се формирају кополимеризацијом са стиреном. Малеински анхидрид је диенофил у Дилс-Алдеровој реакцији.[8]
Дианхидриди, молекули који садрже две функције киселих анхидрида, користе се за синтезу полиимида, а понекад и полиестара[9] и полиамида.[10] Примери дианхидрида: пиромелитни дианхидрид (ПМДА), 3,3', 4,4' - оксидифтални дианхидрид (ОДПА), 3,3', 4,4'-бензофенон тетракарбоксилни дианхидрид (БТДА), 4,4'-дифтални (хексафлуороизопропилиден) анхидрид (6ФДА), бензохинотетракарбоксилни дианхидрид, етилентетракарбоксилни дианхидрид. Полианхидриди су класа полимера које карактеришу анхидридне везе које повезују понављајуће јединице кичменог ланца.
Биолошка појава[уреди | уреди извор]
Природни производи који садрже анхидриде киселина су изоловани од животиња, бактерија и гљива.[11][12][13] Примери укључују кантаридин из врста мајаца, укључујући шпанску муву, Лyтта весицаториа и таутомицин, из бактерије Стрептомyцес спировертициллатус. Породица малеидридних секундарних метаболита гљивица, који поседују широк спектар антибиотске и антигљивичне активности, су алициклична једињења са функционалним групама анхидрида малеинске киселине.[14] Бројни протеини у прокариотима[15] и еукариотима[16] пролазе кроз спонтано цепање између аминокиселинских остатака аспарагинске киселине и пролина преко киселог анхидридног интермедијера. У неким случајевима, анхидрид тада може да реагује са нуклеофилима других ћелијских компоненти, као што је на површини бактерије Неиссериа менингитидис или на протеинима локализованим у близини.[17]
Аналози[уреди | уреди извор]
Азот[уреди | уреди извор]

Имиди су структурно сродни аналози, где је кисеоник за премошћивање замењен азотом. Они слично настају кондензацијом дикарбоксилних киселина са амонијаком. Замена свих атома кисеоника азотом даје имидине, ретке функционалне групе које су веома склоне хидролизи.
Сумпор[уреди | уреди извор]
Сумпор може заменити кисеоник, било у карбонилној групи или у мосту. У првом случају, назив ацил групе је стављен у заграде да би се избегла двосмисленост у називу,[2] нпр. (тиосирћетни) анхидрид (ЦХ3C(С)ОЦ(С)ЦХ3). Када су две ацил групе везане за исти атом сумпора, добијено једињење се назива тиоанхидрид,[2] нпр. сирћетни тиоанхидрид ((ЦХ3C(О))2С).
Референце[уреди | уреди извор]
- ^ ИУПАЦ. „ацид анхyдридес”. Компендијум хемијске терминологије (Интернет издање).
- ^ а б в IUPAC, A Guide to IUPAC Nomenclature of Organic Compounds (the Blue Book); Oxford: Blackwell Science (1993). ISBN 0-632-03488-2. Online edition: "Recommendation R-R-5.7.7.". pp. 123–25.
- ^ „Nomenclature of Anhydrides”. 8. 11. 2013.
- ^ Nelson, D. L.; Cox, M. M. "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.
- ^ „Nomenclature of Anhydrides”. 8. 11. 2013.
- ^ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. "Eastman Chemical Company Acetic Anhydride Process" Catalysis Today (1992), volume 13, pp.73-91. doi:10.1016/0920-5861(92)80188-S
- ^ Lewis I. Krimen (1988). „Acetic Formic Anhydride”. Org. Synth.; Coll. Vol., 6, стр. 8
- ^ Heimo Held; Alfred Rengstl; Dieter Mayer (2002). "Acetic Anhydride and Mixed Fatty Acid Anhydrides" Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_065.
- ^ Chiang, Wen-Yen; Chiang, Wen-Chang (1988-05-05). „Condensation polymerization of multifunctional monomers and properties of related polyester resins. II. Thermal properties of polyester—imide varnishes”. Journal of Applied Polymer Science. 35 (6): 1433—1439. doi:10.1002/app.1988.070350603.
- ^ Faghihi, Khalil; Ashouri, Mostafa; Hajibeygi, Mohsen (2013-10-25). „High Temperature and Organosoluble Poly(amide-imide)s Based on 1,4-Bis[4-aminophenoxy]butane and Aromatic Diacids by Direct Polycondensation: Synthesis and Properties”. High Temperature Materials and Processes (на језику: енглески). 32 (5): 451—458. ISSN 2191-0324. doi:10.1515/htmp-2012-0164
 .
.
- ^ Saleem, Muhammad; Hussain, Hidayat; Ahmed, Ishtiaq; Draeger, Siegfried; Schulz, Barbara; Meier, Kathrin; Steinert, Michael; Pescitelli, Gennaro; Kurtán, Tibor; Flörke, Ulrich; Krohn, Karsten (фебруар 2011). „Viburspiran, an Antifungal Member of the Octadride Class of Maleic Anhydride Natural Products”. European Journal of Organic Chemistry. 2011 (4): 808—812. doi:10.1002/ejoc.201001324.
- ^ Han, Chunguang; Furukawa, Hiroyuki; Tomura, Tomohiko; Fudou, Ryosuke; Kaida, Kenichi; Choi, Bong-Keun; Imokawa, Genji; Ojika, Makoto (24. 4. 2015). „Bioactive Maleic Anhydrides and Related Diacids from the Aquatic Hyphomycete Tricladium castaneicola”. Journal of Natural Products. 78 (4): 639—644. PMID 25875311. doi:10.1021/np500773s.
- ^ Heard, David M.; Tayler, Emyr R.; Cox, Russell J.; Simpson, Thomas J.; Willis, Christine L. (3. 1. 2020). „Structural and synthetic studies on maleic anhydride and related diacid natural products” (PDF). Tetrahedron. 76 (1): 130717. S2CID 209714625. doi:10.1016/j.tet.2019.130717. hdl:1983/53998d06-9017-4cfb-822b-c6453348000a.
- ^ Chen, Xiaolong; Zheng, Yuguo; Shen, Yinchu (мај 2007). „Natural Products with Maleic Anhydride Structure: Nonadrides, Tautomycin, Chaetomellic Anhydride, and Other Compounds”. Chemical Reviews. 107 (5): 1777—1830. PMID 17439289. doi:10.1021/cr050029r.
- ^ Kuban, Vojtech (2020). „Structural Basis of Ca 2+-Dependent Self-Processing Activity of Repeat-in-Toxin Proteins”. mBio. 11 (2): e00226—20. doi:10.1128/mBio.00226-20.
- ^ Bell, Christian (2013). „Structure of the repulsive guidance molecule (RGM)-neogenin signaling hub”. Science. 341 (6141): 77—80. Bibcode:2013Sci...341...77B. PMC 4730555
 . PMID 23744777. doi:10.1126/science.1232322.
. PMID 23744777. doi:10.1126/science.1232322.
- ^ Scheu, Arne (2021). „NeissLock provides an inducible protein anhydride for covalent targeting of endogenous proteins” (PDF). Nature Communications. 12 (1): 717. Bibcode:2021NatCo..12..717S. doi:10.1038/s41467-021-20963-5.