terc-Butanol
| |||

| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
2-Metilpropan-2-ol[1]
| |||
| Други називи | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| Бајлштајн | 906698 | ||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.809 | ||
| EC број | 200-889-7 | ||
| Гмелин Референца | 1833 | ||
| МеСХ | терт-Бутyл+Алцохол | ||
| RTECS | ЕО1925000 | ||
| УНИИ | |||
| УН број | 1120 | ||
| |||
| Својства | |||
| C4H10O | |||
| Моларна маса | 74,12 g·mol−1 | ||
| Агрегатно стање | Безбојна течност | ||
| Мирис | Мирис камфора | ||
| Густина | 0,775 g/mL | ||
| log P | 0,584 | ||
| Напон паре | 4,1 kPa (на 20 °C) | ||
| Индекс рефракције (nD) | 1,387 | ||
| Термохемија | |||
| Специфични топлотни капацитет, C | 215,37 J K−1 mol−1 | ||
| Стандардна моларна ентропија S |
189,5 J K−1 mol−1 | ||
Стд енталпија
формирања (ΔfH⦵298) |
−360,04–−358,36 kJ mol−1 | ||
| Стд енталпија сагоревања ΔcH |
−2,64479–−2,64321 MJ mol−1 | ||
| Опасности | |||
| Безбедност приликом руковања | inchem.org | ||
| GHS grafikoni |  
| ||
| GHS signalna reč | Opasnost | ||
| H225, H319, H332, H335 | |||
| P210, P261, P305+351+338 | |||
EU klasifikacija (DSD)
|
|||
| R-oznake | R11, R20, R36/37 | ||
| S-oznake | (S2), S9, S16, S46 | ||
| NFPA 704 | |||
| Tačka paljenja | 11 °C | ||
| 480 °Ц (896 °Ф; 753 К) | |||
| Експлозивни лимити | 2,4–8,0% | ||
| Сродна једињења | |||
Сродне бутаноли
|
2-Бутанол | ||
Сродна једињења
|
2-Метил-2-бутанол | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
терц-Бутанол (2-метил-2-пропанол) је најједноставнији терцијарни алкохол. Он је један од четири изомера бутанола. терц-Бутанол је прозирна течност (или безбојна течност) са мирисом сличног камфору. Он је веома растворан у води и меша се са етанолом и етром. Он је јединствен међу изомерима бутанола, јер је обично чврст на собној температури, са тачком топљења која је мало изнад 25 °C.
Хемија
[уреди | уреди извор]Терцијарни алкохол, терц-бутанол је стабилнији у погледу оксидације и мање је реактиван од других изомера бутанола.
Кад се терц-бутанол депротонизује са јаком базом, продукт је алкоксидни ањон. У овом случају, то је терц-бутоксид. На пример, широко кориштени органски реагенс калијум терц-бутоксид се припрема реакцијом сувог терц-бутанола са калијумом.[4]
- K + tBuOH → tBuO−K+ + 1/2 H2
Конверзија у алкил халиде
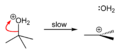
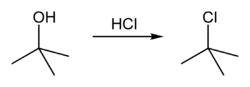
[уреди | уреди извор]терц-Бутанол реагује са хлороводоником да формира терц-бутил хлорид и воду путем SN1 механизма.
-
Корак 1
-
Корак 2
-
Корак 3
Свеукупна реакција је стога:
Пошто је терц-бутанол терцијарни алкохол, релативна стабилност терц-бутил карбокатјона у кораку 2 омогућава SN1 механизам. Примарни алкохоли генерално подлежу SN2 механизму јер је релативна стабилност примарног карбокатјонског интермедијаар веома ниска. Терцијарни карбокатјон је у овом случају стабилизован путем хиперкоњугацијек, при чем суседне C–H сигма везе донирају електроне у празну п-орбиталу карбокатјона.
Референце
[уреди | уреди извор]- ^ а б в „терт-Бутyл Алцохол - Цомпоунд Суммарy”. ПубЦхем Цомпоунд. Натионал Центер фор Биотецхнологy Информатион. 26. 03. 2005. Приступљено 19. 05. 2012.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Еван Е. Болтон; Yанли Wанг; Паул А. Тхиессен; Степхен Х. Брyант (2008). „Цхаптер 12 ПубЦхем: Интегратед Платформ оф Смалл Молецулес анд Биологицал Ацтивитиес”. Аннуал Репортс ин Цомпутатионал Цхемистрy. 4: 217—241. дои:10.1016/С1574-1400(08)00012-1.
- ^ Јохнсон, W. С.; Сцхнеидер, W. П. (1950). „β-Царбетхоxy-γ,γ-дипхенyлвинyлацетиц ацид”. Орг. Сyнтх. 30: 18.; Цолл. Вол., 4, стр. 132