terc-Butanol
| |||

| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
2-Metilpropan-2-ol[1]
| |||
| Drugi nazivi | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| Bajlštajn | 906698 | ||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.809 | ||
| EC broj | 200-889-7 | ||
| Gmelin Referenca | 1833 | ||
| MeSH | tert-Butyl+Alcohol | ||
| RTECS | EO1925000 | ||
| UNII | |||
| UN broj | 1120 | ||
| |||
| Svojstva | |||
| C4H10O | |||
| Molarna masa | 74,12 g·mol−1 | ||
| Agregatno stanje | Bezbojna tečnost | ||
| Miris | Miris kamfora | ||
| Gustina | 0,775 g/mL | ||
| log P | 0,584 | ||
| Napon pare | 4,1 kPa (na 20 °C) | ||
| Indeks refrakcije (nD) | 1,387 | ||
| Termohemija | |||
| Specifični toplotni kapacitet, C | 215,37 J K−1 mol−1 | ||
| Standardna molarna entropija S |
189,5 J K−1 mol−1 | ||
Std entalpija
formiranja (ΔfH⦵298) |
−360,04–−358,36 kJ mol−1 | ||
| Std entalpija sagorevanja ΔcH |
−2,64479–−2,64321 MJ mol−1 | ||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | inchem.org | ||
| GHS grafikoni |  
| ||
| GHS signalna reč | Opasnost | ||
| H225, H319, H332, H335 | |||
| P210, P261, P305+351+338 | |||
EU klasifikacija (DSD)
|
|||
| R-oznake | R11, R20, R36/37 | ||
| S-oznake | (S2), S9, S16, S46 | ||
| NFPA 704 | |||
| Tačka paljenja | 11 °C | ||
| 480 °C (896 °F; 753 K) | |||
| Eksplozivni limiti | 2,4–8,0% | ||
| Srodna jedinjenja | |||
Srodne butanoli
|
2-Butanol | ||
Srodna jedinjenja
|
2-Metil-2-butanol | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
terc-Butanol (2-metil-2-propanol) je najjednostavniji tercijarni alkohol. On je jedan od četiri izomera butanola. terc-Butanol je prozirna tečnost (ili bezbojna tečnost) sa mirisom sličnog kamforu. On je veoma rastvoran u vodi i meša se sa etanolom i etrom. On je jedinstven među izomerima butanola, jer je obično čvrst na sobnoj temperaturi, sa tačkom topljenja koja je malo iznad 25 °C.
Hemija
[уреди | уреди извор]Tercijarni alkohol, terc-butanol je stabilniji u pogledu oksidacije i manje je reaktivan od drugih izomera butanola.
Kad se terc-butanol deprotonizuje sa jakom bazom, produkt je alkoksidni anjon. U ovom slučaju, to je terc-butoksid. Na primer, široko korišteni organski reagens kalijum terc-butoksid se priprema reakcijom suvog terc-butanola sa kalijumom.[4]
- K + tBuOH → tBuO−K+ + 1/2 H2
Konverzija u alkil halide
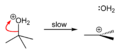
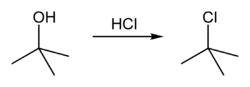
[уреди | уреди извор]terc-Butanol reaguje sa hlorovodonikom da formira terc-butil hlorid i vodu putem SN1 mehanizma.
-
Korak 1
-
Korak 2
-
Korak 3
Sveukupna reakcija je stoga:
Pošto je terc-butanol tercijarni alkohol, relativna stabilnost terc-butil karbokatjona u koraku 2 omogućava SN1 mehanizam. Primarni alkoholi generalno podležu SN2 mehanizmu jer je relativna stabilnost primarnog karbokatjonskog intermedijaar veoma niska. Tercijarni karbokatjon je u ovom slučaju stabilizovan putem hiperkonjugacijek, pri čem susedne C–H sigma veze doniraju elektrone u praznu p-orbitalu karbokatjona.
Reference
[уреди | уреди извор]- ^ а б в „tert-Butyl Alcohol - Compound Summary”. PubChem Compound. National Center for Biotechnology Information. 26. 03. 2005. Приступљено 19. 05. 2012.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Johnson, W. S.; Schneider, W. P. (1950). „β-Carbethoxy-γ,γ-diphenylvinylacetic acid”. Org. Synth. 30: 18.; Coll. Vol., 4, стр. 132