Led
| Led | |
|---|---|
 | |
| Fizičke osobine | |
| Gustina (ρ) | 0,9167[1]–0,9168[2] g/cm3 |
| Indeks refrakcije (n) | 1,309 |
| Mehanička svojstva | |
| Jungov modul (E) | 3400 do 37,500 kg-sila/cm3[2] |
| Zatezna čvrstoća (σt) | 5 do 18 kg-sila/cm2[2] |
| Kompresivna jačina (σc) | 24 do 60 kg-sila/cm2[2] |
| Puasonov odnos (ν) | 0,36±0,13[2] |
| Termalna svojstva | |
| Toplotna provodljivost (k) | 0,0053(1 + 0,105 θ) cal/(cm s K), θ = temperatura u °C[2] |
| Koeficijent linearne termičke ekspanzije (α) | 5,5×10−5[2] |
| Specifični toplotni kapacitet (c) | 0,5057 − 0,001863 θ cal/(g K), θ = apsolutna vrednost temperature u °C[2] |
| Električna svojstva | |
| Dielektrična konstanta (εr) | ~3,15 |
| Svojstva leda značajno variraju u zavisnosti od temperature, čistoće i drugih faktora. | |
Led predstavlja čvrsto agregatno stanje vode, koje ona dostiže na temperaturama jednakim ili manjim od 0 °C (tačka mržnjenja).[3][4] Zbog specifičnog prostornog rasporeda koji molekuli vode tada zauzimaju, led ima manju gustinu od vode (za oko 8,5%) i pluta na njenoj površini (videti Voda: Agregatna stanja). Pri smrzavanju, zapremina vode se povećava za oko 11%.[5][6]
Specifična toplota leda je duplo manja od vode u tečnom stanju. Zbog toga se led relativno brzo obrazuje na površini vode rashlađene do temperature od 0 °C, a za njegovo topljenje potrebna je mnogo manja količina toplote (79,72 cal g -1) nego za uparavanje tečne vode (539,6 cal g -1). Povećanjem saliniteta snižava se tačka mržnjenja vode; tako se morska voda (prosečnog saliniteta od 35 g L -1) mrzne tek na -1,91 °C.[7][8] Najveće količine leda u biosferi se nalaze u polarnim kapama.
Led nije samo svojstvo krutosti vode. Naime, takva vrsta leda se u nauci naziva „vodeni led“, dok gotovo svaki gasoviti spoj pri određenim temperaturama i pritiskom može preći u stanje leda. Gledano u svemiru, na Marsu postoje određene količine vodenog leda, ali npr. na Plutonu postoji tzv. metanski led, na Uranu amonijakov led itd.
U Sunčevom sistemu leda ima u izobilju i prirodno se javlja već na bliskom rastojanju od Sunca, poput Merkura, te sve do objekata Ortovog oblaka. Izvan Sunčevog sistema javlja se kao međuzvezdani led. Ima ga dosta na površini Zemlje - naročito u polarnim regionima i iznad snežne granice[9] – i, kao uobičajen oblik padavina i taloženja, igra ključnu ulogu u ciklusu vode Zemlje i klimi. Led pada u vidu pahuljice i grada, ili se javlja kao mraz, ledenice ili ledeni šiljci i agregati od snega kao glečeri i ledeni pokrivači.
Fizička svojstva[uredi | uredi izvor]
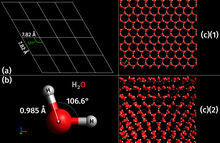
Kao prirodna kristalna neorganska čvrsta supstanca sa uređenom strukturom, led se smatra mineralom.[12][13] Poseduje pravilnu kristalnu strukturu zasnovanu na molekulu vode, koji se sastoji od jednog atoma kiseonika kovalentno vezanog za dva atoma vodonika, ili H–O–H. Međutim, mnoga fizička svojstva vode i leda kontrolišu se formiranjem vodoničnih veza između susednih atoma kiseonika i vodonika; iako je to slaba veza, ključna je za kontrolu strukture vode i leda.
Neobično svojstvo vode je to što je njen čvrsti oblik - led zamrznut pri atmosferskom pritisku - približno 8,3% manje gust od tečnog oblika; ovo je ekvivalentno zapreminskom proširenju od 9%. Gustina leda je 0,9167[1] –0,9168[2] g/cm3 na 0 °C i standardnom atmosferskom pritisku (101,325 Pa), dok voda ima gustinu od 0,9998[1]–0.999863[2] g/cm3 na istoj temperaturi i pritisku. Tečna voda je najgušća, u suštini 1,00 g/cm³ na 4 °C i počinje da gubi svoju gustinu kako molekuli vode počinju da formiraju heksagonalne kristale leda kada se dostigne tačka smrzavanja. To je zbog vodonične veze koja dominira međumolekulskim silama, što dovodi do pakovanja molekula manje kompaktnih u čvrstom materijalu. Gustina leda se blago povećava sa smanjenjem temperature i ima vrednost od 0,9340 g/cm3 pri -180 °C (93 K).[14]
Kada se voda smrzne, povećava se zapremina (oko 9% za slatku vodu).[15] Efekat širenja tokom smrzavanja može biti dramatičan, a širenje leda osnovni je uzrok propadanja stena smrzavanjem i odmrzavanjem u prirodi i oštećenja temelja zgrada i puteva usled naleta mraza. Takođe je čest uzrok poplava kuća kada puknu vodovodne cevi zbog pritiska vode koja se širi kada se smrzne.
Rezultat ovog procesa je da led (u svom najčešćem obliku) pluta na tečnoj vodi, što je važna karakteristika u biosferi Zemlje. Tvrdilo se da bi se bez ovog svojstva prirodna vodna tela zamrznula, u nekim slučajevima trajno, odozdo prema gore,[16] što bi dovelo do gubitka životinjskog i biljnog sveta zavisnog od dna u slatkoj i morskoj vodi. Dovoljno tanki ledeni pokrivači omogućavaju prolaz svetlosti štiteći donju stranu od kratkotrajnih vremenskih ekstrema, poput vetra. Ovo stvara zaštićeno okruženje za kolonije bakterija i algi. Kada se morska voda smrzne, led je prožet kanalima ispunjenim slanom vodom koji održavaju simpagične organizme kao što su bakterije, alge, kopepodi i anelidi, koji zauzvrat obezbeđuju hranu za životinje kao što su kril i specijalizovane ribe, poput Pagothenia borchgrevinki, kojom se potom hrane veće životinje kao što su carski pingvini i minke kitovi.[17]
Kada se led topi, on apsorbuje toliko energije koliko bi bilo potrebno da se jednaka masa vode zagreje za 80 °C. Tokom procesa topljenja, temperatura ostaje konstantna na 0 °C. Tokom topljenja, svaka dodatna energija prekida vodonične veze između molekula leda (vode). Energija postaje dostupna za povećanje toplotne energije (temperature) tek nakon što se prekine dovoljno vodonikovih veza da se led može smatrati tečnom vodom. Količina energije koja se troši pri razbijanju vodonikovih veza pri prelazu iz leda u vodu poznata je kao toplota fuzije.
Kao i kod vode, led apsorbuje svetlost na crvenom kraju spektra, prvenstveno kao rezultat prizvuka istezanja veze kiseonik-vodonik (O–H). U poređenju sa vodom, ova apsorpcija se pomera ka nešto nižim energijama. Stoga led izgleda plavo, sa nešto zelenijom nijansom od tečne vode. Budući da je apsorpcija kumulativna, efekat boje se pojačava sa povećanjem debljine ili ako unutrašnje refleksije dovode do toga da svetlost ide dužim putem kroz led.[18]
Druge boje se mogu pojaviti u prisustvu nečistoća koje apsorbuju svetlost, pri čemu nečistoća diktira boju, a ne sam led. Na primer, ledeni bregovi koji sadrže nečistoće (npr. sedimente, alge, mehuriće vazduha) mogu izgledati braon, sivo ili zeleno.[18]
Reference[uredi | uredi izvor]
- ^ a b v Harvey, Allan H. (2017). „Properties of Ice and Supercooled Water”. Ur.: Haynes, William M.; Lide, David R.; Bruno, Thomas J. CRC Handbook of Chemistry and Physics (97th izd.). Boca Raton, FL: CRC Press. ISBN 978-1-4987-5429-3.
- ^ a b v g d đ e ž z i Voitkovskii, K. F., Translation of: "The mechanical properties of ice" ("Mekhanicheskie svoistva l'da") (PDF) (na jeziku: engleski), Academy of Sciences (USSR), Arhivirano (PDF) iz originala 10. 2. 2017. g.
- ^ „Definition of ICE”. www.merriam-webster.com (na jeziku: engleski). Pristupljeno 2018-06-19.
- ^ „the definition of ice”. www.dictionary.com (na jeziku: engleski). Pristupljeno 2018-06-19.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Grupa autora (2003). Atlas fosila i minerala. Kreativni centar: Beograd.
- ^ Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ur. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th izd.). Merck Publishing. ISBN 0911910131.
- ^ Prockter, Louise M. (2005). „Ice in the Solar System” (PDF). Johns Hopkins APL Technical Digest. 26 (2): 175. Arhivirano iz originala (PDF) 19. 3. 2015. g. Pristupljeno 21. 12. 2013.
- ^ R. W. Whitworth (1999). Physics of Ice. Oxford University Press. ISBN 9780198518945.
- ^ Bernal, J. D.; Fowler, R. H. (1933). „A Theory of Water and Ionic Solution, with Particular Reference to Hydrogen and Hydroxyl Ions”. The Journal of Chemical Physics. 1 (8): 515. Bibcode:1933JChPh...1..515B. doi:10.1063/1.1749327.
- ^ Demirbas, Ayhan (2010). Methane Gas Hydrate. Springer Science & Business Media. str. 90. ISBN 978-1-84882-872-8.
- ^ „The Mineral Ice”. minerals.net. Pristupljeno 2019-01-09.
- ^ Lide, D. R., ur. (2005). CRC Handbook of Chemistry and Physics (86th izd.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Sreepat, Jain. Fundamentals of Physical Geology. New Delhi: Springer, India, Private, 2014. 135. Print. ISBN 978-81-322-1538-7.
- ^ Tyson, Neil deGrasse. „Water, Water”. haydenplanetarium.org. Arhivirano iz originala 26. 7. 2011. g.
- ^ Sea Ice Ecology Arhivirano 21 mart 2012 na sajtu Wayback Machine. Acecrc.sipex.aq. Retrieved 30 October 2011.
- ^ a b Lynch, David K.; Livingston, William Charles (2001). Color and light in nature. Cambridge University Press. str. 161—. ISBN 978-0-521-77504-5.
Literatura[uredi | uredi izvor]
- Grupa autora (2003). Atlas fosila i minerala. Kreativni centar: Beograd.
- Rothrock, D.A.; Zhang, J. (2005). „Arctic Ocean Sea Ice Volume: What Explains Its Recent Depletion?” (PDF). J. Geophys. Res. 110 (C1): C01002. Bibcode:2005JGRC..11001002R. doi:10.1029/2004JC002282
 .
. - „All About Sea Ice”. National Snow and Ice Data Center, University of Colorado, Boulder.
- Vinnikov, K.Y.; Cavalieri, D.J.; Parkinson, C.L. (mart 2006). „A model assessment of satellite observed trends in polar sea ice extents”. Geophys. Res. Lett. 33 (5): L05704. Bibcode:2006GeoRL..33.5704V. CiteSeerX 10.1.1.594.2054
 . doi:10.1029/2005GL025282.
. doi:10.1029/2005GL025282. - „Cryosphere Glossary”. National Snow and Ice Data Center, University of Colorado, Boulder.
- „Ice Glossary”. Environment Canada. 2010-09-27.
- „WMO Sea-Ice Nomenclature”. World Meteorological Organization. WMO/OMM/VMO – No. 259 • Edition 1970–2004.[mrtva veza]
- „Sea Ice Ecology”. Sea Ice Physics and Ecosystem eXperiment (SIPEX). Antarctic Climate & Ecosystems CRC. Arhivirano iz originala 2012-03-20. g. Pristupljeno 23. 6. 2012.
- Barber, D. G.; Iacozza, J. (mart 2004). „Historical analysis of sea ice conditions in M'Clintock Channel and the Gulf of Boothia, Nunavut: implications for ringed seal and polar bear habitat”. Arctic. 57 (1): 1—14. JSTOR 40512590. doi:10.14430/arctic478.
- Stirling, I.; Lunn, N. J.; Iacozza, J.; Elliott, C.; Obbard, M. (mart 2004). „Polar bear distribution and abundance on the southwestern Hudson Bay coast during open water season, in relation to population trends and annual ice patterns”. Arctic. 57 (1): 15—26. JSTOR 40512591. doi:10.14430/arctic479.
- Stirling, I.; Parkinson, C. L. (septembar 2006). „Possible effects of climate warming on selected populations of polar bears (Ursus maritimus) in the Canadian Arctic” (PDF). Arctic. 59 (3): 261—275. JSTOR 40512813. doi:10.14430/arctic312. hdl:2060/20060020227
 .
.
Spoljašnje veze[uredi | uredi izvor]
- Fazni dijagram vode, uključujući varijante leda
- Listing za led na satju Webmineral
- Listing za led i podaci o lokaciji na sajtu MinDat.org
- Fizika leda
- Fazni dijagrami vode sa nekim dijagramima visokog pritiska
- Nedavno otkriće o topljenju leda
- 'Nezamrziva voda', 'vezana voda' i voda hidracije
- Elektromehanička svojstva leda
- Estimating the bearing capacity of ice
- High-temperature, high-pressure ice
- The Surprisingly Cool History of Ice

