Inhibitor enzima — разлика између измена
| Ред 208: | Ред 208: | ||
Enzimski inhibitori su važni u [[Metabolička mreža|metaboličkoj]] kontroli.<ref>{{cite book|title=An Introduction to Metabolic Pathways by S. DAGLEY|date=1971|publisher=Sigma Xi, The Scientific Research Society|edition=Vol. 59, No. 2|page=266 |last1=Nicholson |first1=Donald E.}}</ref> Mnogi ćelijski [[metabolički put|metabolički patevi]] su inhibirani [[metabolit]]ima, koji kontrolišu enzimsku aktivnost putem [[Alosterna regulacija|alosterne regulacije]] ili inhibicije supstrata. Dobar primer je alosterna regulacija [[glikoliza|glikolitičkog puta]].<ref name="Campbell">{{cite book|last1=Reece|first1=Jane B.|title=Campbell biology / Jane B. Reece ... [et al.].|date=2011|publisher=Benjamin Cummings|location=Boston|isbn=978-0-321-55823-7|pages=143|edition=9th}}</ref> Ovaj [[Katabolizam|katabolički]] put konzumira [[glukoza|glukozu]] i proizvodi [[Adenozin trifosfat|ATP]], [[Nikotinamid adenin dinukleotid|NADH]] i [[piruvat]].<ref>{{cite web|last=Bailey|first=Regina|title=10 Steps of Glycolysis|url=http://biology.about.com/od/cellularprocesses/a/aa082704a.htm}}</ref><ref>{{cite journal | first1=AH | last1=Romano | title=Evolution of carbohydrate metabolic pathways | last2=Conway | first2=T | journal=Res Microbiol | year=1996 | volume=147 | issue=6–7 | pages=448–55 | doi=10.1016/0923-2508(96)83998-2 | pmid=9084754}}</ref> Ključni korak u regulaciji glikolize je jedna rana reakcija puta koja je katalizovana [[Fosfofruktokinaza|fosfofruktokinazom-1]] (PFK1).<ref name="PUB00014238">{{cite journal |vauthors=Wegener G, Krause U |title=Different modes of activating phosphofructokinase, a key regulatory enzyme of glycolysis, in working vertebrate muscle |journal=Biochem. Soc. Trans. |volume=30 |issue=2 |pages=264–270 |year=2002 |pmid=12023862 |doi=10.1042/bst0300264}}</ref><ref name="PUB00000020">{{cite journal |vauthors =Raben N, Exelbert R, Spiegel R, Sherman JB, Nakajima H, Plotz P, Heinisch J |title=Functional expression of human mutant phosphofructokinase in yeast: genetic defects in French Canadian and Swiss patients with phosphofructokinase deficiency |journal=Am. J. Hum. Genet. |volume=56 |issue=1 |pages=131–141 |year=1995 |pmid=7825568 |pmc=1801305}}</ref> Kad se ATP nivo povisi, ATP se vezuje za alosterno mesto na PFK1 čime se snižava brzina enzimske reakcije; glikoliza se inhibira i opada produkcija ATP. Ovaj oblik kontrole [[Повратна спрега|negativnom povratnom spregom]] pomaže u održavanju stabilnih nivoa koncentracije ATP molekula u ćeliji.<ref>{{cite book |first=W. B.|last=Cannon|chapter=Physiological regulation of normal states: some tentative postulates concerning biological homeostatics|editor=A. Pettit(ed.)|title=A Charles Richet : ses amis, ses collègues, ses élèves|page=91|publisher=Paris: Les Éditions Médicales|year=1926}}</ref> Međutim, metabolički putevi se ne regulišu samo inhibicijom, već je aktivacija enzima jednako važna. U tom smislu su PFK1, [[fruktoza 2,6-bisfosfat]] i [[Adenozin difosfat|ADP]] primeri metabolita koji deluju kao alosterini aktivatori.<ref>{{cite journal|last1=Okar|first1=DA|last2=Lange|first2=AJ|title=Fructose-2,6-bisphosphate and control of carbohydrate metabolism in eukaryotes|journal=BioFactors (Oxford, England)|volume=10|issue=1|pages=1–14|year=1999|pmid=10475585|doi=10.1002/biof.5520100101}}</ref> |
Enzimski inhibitori su važni u [[Metabolička mreža|metaboličkoj]] kontroli.<ref>{{cite book|title=An Introduction to Metabolic Pathways by S. DAGLEY|date=1971|publisher=Sigma Xi, The Scientific Research Society|edition=Vol. 59, No. 2|page=266 |last1=Nicholson |first1=Donald E.}}</ref> Mnogi ćelijski [[metabolički put|metabolički patevi]] su inhibirani [[metabolit]]ima, koji kontrolišu enzimsku aktivnost putem [[Alosterna regulacija|alosterne regulacije]] ili inhibicije supstrata. Dobar primer je alosterna regulacija [[glikoliza|glikolitičkog puta]].<ref name="Campbell">{{cite book|last1=Reece|first1=Jane B.|title=Campbell biology / Jane B. Reece ... [et al.].|date=2011|publisher=Benjamin Cummings|location=Boston|isbn=978-0-321-55823-7|pages=143|edition=9th}}</ref> Ovaj [[Katabolizam|katabolički]] put konzumira [[glukoza|glukozu]] i proizvodi [[Adenozin trifosfat|ATP]], [[Nikotinamid adenin dinukleotid|NADH]] i [[piruvat]].<ref>{{cite web|last=Bailey|first=Regina|title=10 Steps of Glycolysis|url=http://biology.about.com/od/cellularprocesses/a/aa082704a.htm}}</ref><ref>{{cite journal | first1=AH | last1=Romano | title=Evolution of carbohydrate metabolic pathways | last2=Conway | first2=T | journal=Res Microbiol | year=1996 | volume=147 | issue=6–7 | pages=448–55 | doi=10.1016/0923-2508(96)83998-2 | pmid=9084754}}</ref> Ključni korak u regulaciji glikolize je jedna rana reakcija puta koja je katalizovana [[Fosfofruktokinaza|fosfofruktokinazom-1]] (PFK1).<ref name="PUB00014238">{{cite journal |vauthors=Wegener G, Krause U |title=Different modes of activating phosphofructokinase, a key regulatory enzyme of glycolysis, in working vertebrate muscle |journal=Biochem. Soc. Trans. |volume=30 |issue=2 |pages=264–270 |year=2002 |pmid=12023862 |doi=10.1042/bst0300264}}</ref><ref name="PUB00000020">{{cite journal |vauthors =Raben N, Exelbert R, Spiegel R, Sherman JB, Nakajima H, Plotz P, Heinisch J |title=Functional expression of human mutant phosphofructokinase in yeast: genetic defects in French Canadian and Swiss patients with phosphofructokinase deficiency |journal=Am. J. Hum. Genet. |volume=56 |issue=1 |pages=131–141 |year=1995 |pmid=7825568 |pmc=1801305}}</ref> Kad se ATP nivo povisi, ATP se vezuje za alosterno mesto na PFK1 čime se snižava brzina enzimske reakcije; glikoliza se inhibira i opada produkcija ATP. Ovaj oblik kontrole [[Повратна спрега|negativnom povratnom spregom]] pomaže u održavanju stabilnih nivoa koncentracije ATP molekula u ćeliji.<ref>{{cite book |first=W. B.|last=Cannon|chapter=Physiological regulation of normal states: some tentative postulates concerning biological homeostatics|editor=A. Pettit(ed.)|title=A Charles Richet : ses amis, ses collègues, ses élèves|page=91|publisher=Paris: Les Éditions Médicales|year=1926}}</ref> Međutim, metabolički putevi se ne regulišu samo inhibicijom, već je aktivacija enzima jednako važna. U tom smislu su PFK1, [[fruktoza 2,6-bisfosfat]] i [[Adenozin difosfat|ADP]] primeri metabolita koji deluju kao alosterini aktivatori.<ref>{{cite journal|last1=Okar|first1=DA|last2=Lange|first2=AJ|title=Fructose-2,6-bisphosphate and control of carbohydrate metabolism in eukaryotes|journal=BioFactors (Oxford, England)|volume=10|issue=1|pages=1–14|year=1999|pmid=10475585|doi=10.1002/biof.5520100101}}</ref> |
||
Fiziološka enzimska inhibicija se takođe može proizvesti putem specifičnih proteinskih inhibitora. |
Fiziološka enzimska inhibicija se takođe može proizvesti putem specifičnih proteinskih inhibitora. Taj mehanizam se javlja u [[pankreas]]u, koji sinhetiše mnoštvo digestivnih prekursorskih enzima, poznatih kao [[zimogen]]i.<ref>{{cite journal |title = Mechanisms of Zymogen Activation |journal = Annual Review of Biophysics and Bioengineering |volume = 6 |pages = 177-193 |date = 1977 |doi = 10.1146/annurev.bb.06.060177.001141 |author = Robert M. Stroud |author2 = Anthony A. Kossiakoff |author3 = John L. Chambers |url = http://www.annualreviews.org/doi/abs/10.1146/annurev.bb.06.060177.001141?journalCode=biophys.1 }} </ref><ref>{{cite journal |journal =Proc. Natl. Acad. Sci. USA |volume = 73 |issue = 11 |pages = 3825-3832 | date = 1976 |title = Biochemistry Role of proteolytic enzymes in biological regulation (A Review) (limited proteolysis/zymogen activation/control mechanisms) |author = Hans Neurath |author2 = Kenneth A. Walsh |url = http://www.pnas.org/content/73/11/3825.full.pdf }}</ref> Mnogi od njih se aktiviraju dejstvom proteaze [[tripsin]],<ref name="pmid7845208">{{cite journal |vauthors=Rawlings ND, Barrett AJ | title = Families of serine peptidases | journal = Meth. Enzymol. | volume = 244 | issue = | pages = 19–61 | year = 1994 | pmid = 7845208 | doi = 10.1016/0076-6879(94)44004-2| url = | series = Methods in Enzymology | isbn = 978-0-12-182145-6 }}</ref> tako da je važno da se inhibira aktivnost tripsina u pankreasu da bi se sprečila situacija u kojoj oragan samog sebe svaruje.<ref>{{cite journal |author1=N. Levilliers |author2=M. Péron |author3=B. Arrio |author4=J. Pudles |title=On the mechanism of action of proteolyticinhibitors: IV. Effect of 8murea on the stability of trypsin in trypsin-lnhibitor complexes |journal=Archives of Biochemistry and Biophysics |volume=140|issue=2|pages=474–483|pmid=5528741 |date=October 1970|doi=10.1016/0003-9861(70)90091-3}}</ref> Jedan način kontrole aktivnosti tripsina je produkcija specifičnog i potentnog proteinskog [[inhibitor tripsina|inhibitora tripsina]] u pankreasu.<ref>{{cite journal |author = Dreon M. S. |author2 = Ituarte S. |author3 = Heras H. |year = 2010 |title = The Role of the Proteinase Inhibitor Ovorubin in Apple Snail Eggs Resembles Plant Embryo Defense against Predation |journal = PLoS ONE |volume = 5 |issue = 12 |pages = e15059 |doi = 10.1371/journal.pone.0015059 |pmid = 21151935 |url = http://www.pubfacts.com/detail/21151935/The-role-of-the-proteinase-inhibitor-ovorubin-in-apple-snail-eggs-resembles-plant-embryo-defense-aga }}</ref> Taj inhibitor se čvrsto vezuje za tripsin, sprečavajući aktivnost tripsina koja bi inaće bila štetna za organ.<ref>{{cite book |author = Price, Nicholas |author2 = Stevens, Lewis |year = 1999 |title = Fundamentals of Enzymology |publisher = Oxford University Press |isbn = 0-19-850229-X.}}</ref> Mada je tripsinski inhibitor protein, on izbegava da postane supstrat proteaze tako što uklanja vodu iz aktivnog mesta tripsina i time destabilizuje prelazno stanje.<ref>{{cite journal|last1=Smyth|first1=TP|title=Substrate variants versus transition state analogues as noncovalent reversible enzyme inhibitors|journal=Bioorganic & Medicinal Chemistry|volume=12 |issue=15 |pages=4081–8 |year=2004|pmid=15246086|doi=10.1016/j.bmc.2004.05.041}}</ref> Drugi primeri fizioloških enzimskih inhibitornih proteina su [[barstar]] koji je inhibitor bakterijske [[ribonukleaza|ribonukleaze]] [[barnaza|barnaze]]<ref>{{cite journal|doi=10.1016/0968-0004(89)90104-7 |last1=Hartley |first1=RW |title=Barnase and barstar: two small proteins to fold and fit together|journal=Trends in Biochemical Sciences |volume=14 |issue=11|pages=450–4|year=1989|pmid=2696173}}</ref><ref name="pmid1569557">{{cite journal |vauthors=Serrano L, Kellis JT, Cann P, Matouschek A, Fersht AR |title=The folding of an enzyme. II. Substructure of barnase and the contribution of different interactions to protein stability |journal=J. Mol. Biol. |volume=224 |issue=3 |pages=783–804 |date=April 1992 |pmid=1569557 |doi= 10.1016/0022-2836(92)90562-X|url=}}</ref><ref name="pmid1569558">{{cite journal |vauthors=Serrano L, Matouschek A, Fersht AR |title=The folding of an enzyme. III. Structure of the transition state for unfolding of barnase analysed by a protein engineering procedure |journal=J. Mol. Biol. |volume=224 |issue=3 |pages=805–18 |date=April 1992 |pmid=1569558 |doi= 10.1016/0022-2836(92)90563-Y|url=}}</ref><ref name="pmid1569559">{{cite journal |vauthors=Matouschek A, Serrano L, Fersht AR |title=The folding of an enzyme. IV. Structure of an intermediate in the refolding of barnase analysed by a protein engineering procedure |journal=J. Mol. Biol. |volume=224 |issue=3 |pages=819–35 |date=April 1992 |pmid=1569559 |doi= 10.1016/0022-2836(92)90564-Z|url=}}</ref> i inhibitori [[fosfataza|proteinskih fosfataza]].<ref>{{cite journal|last1=Oliver |pmid=9727084|first1=CJ |year=1998|pages=D961–72 |volume=3 |last2=Shenolikar |journal=Frontiers in Bioscience|first2=S|title=Physiologic importance of protein phosphatase inhibitors |url=http://www.bioscience.org/1998/v3/d/oliver/list.htm}}</ref> |
||
== Reference == |
== Reference == |
||
Верзија на датум 20. септембар 2016. у 22:51

Inhibitor enzima je molekul koji se vezuje za enzim i umanjuje njegovu aktivnost. Pošto blokiranje enzimske aktivnosti može da ubije patogen, ili da koriguje metaboličku neuravnoteženost, mnogi lekovi su inhibitori enzima. Inhibitori enzima se isto tako koriste u pesticidima. Nisu svi molekuli koji se vezuju za enzime inhibitori; aktivatori enzima se vezuju za enzime i povećavaju njihovu aktivnost, dok se enzimski supstrati vezuju i bivaju konvertovani do produkata u normalnom katalitičkom ciklusu enzima.
Vezivanje inhibitora može da spreči pristup supstrata enzimskom aktivnom mestu i/ili da omete enzim pri katalizi njegove reakcije. Vezivanje inhibitora može da bude bilo reverzibilno ili ireverzibilno. Ireverzibilni inhibitori obično reaguju sa enzimom i hemijski ga menjaju (e.g. putem formiranja kovalentne veze). Ti inhibitori modifikuju ključne aminokiselinske ostatke koji su neophodni za enzimatsku aktivnost. U kontrastu s tim, reverzibilni inhibitori se nekovalentno vezuju, i različiti tipovi inhibicije se javljaju u zavisnosti od toga da li se inhibitori vezuju za enzim, enzimsko-supstratni kompleks, ili za oba.[1]
Mnogi molekuli lekova su inhibitori enzima, tako da je njihovo otkrivanje i poboljšanje aktivna oblast istraživanja u biohemiji i farmakologiji. Medicinski enzimski inhibitori se često vrednuju po njihovoj specifičnosti (njihovom odsustvu vezivanja za druge proteine) i njihovoj potentnosti (njihovoj konstanti disocijacije, koja je indikator koncentracije neophodne za inhibiciju enzima). Visoka specifičnost i potentnost su preduslovi da lek ima mali broj nuspojava i stoga nisku toksičnost.
Enzimski inhibitori se isto tako javljaju u prirodi i učestvuju u regulaciji metabolizma. Na primer, enzimi u metaboličkom putu mogu da budu inhibirani produktima daljih koraka puta. Ovaj tip povratne sprege usporava ćelijsku proizvodnu liniju kad produkti počnu da se nakupljaju, i to je jedan od važnih načina održavanja homeostaze u ćelijama. Drugi ćelijski enzimski inhibitori su proteini, koji se specifično vezuju za i inhibiraju enzimsku metu. To može da pomogne u kontroli enzima, koji bi inače mogli da oštete ćeliju, kao što su proteaze ili nukleaze. Dobro okarakterisani primer je ribonukleazni inhibitor, koji se vezuje za ribonukleaze u jednoj od najčvršćih poznatih protein–protein interakcija.[2] Prirodni enzimski inhibitori takođe mogu da budu otrovi i da se koriste kao oblik odbrane od predatora, ili kao način ubijanja plena.
Reverzibilni inhibitori
Tipovi reverzibilnih inhibitora
Reverzibilni inhibitori se vezuju za enzime putem nekovalentnih interakcija kao što su vodonične veze, hidrofobne interakcije i jonske veze. Višestruke slabe veze između inhibitora i aktivnog mesta se kombinuju i proizvode jako i specifično vezivanje. Za razliku od supstrata i ireverzibilnih inhibitora, reverzibilni inhibitori generalno ne podležu hemijskim reakcijama pri vezivanju za enzim i mogu se lako ukloniti razblaživanjem ili dijalizom.
Postoje četiri vrste reverzibilnih enzimskih inhibitora. Oni se klasifikuju na osnovu efekta variranja koncentracije enzimskog supstrata na inhibitor.[3]

- U konkurentnoj inhibiciji, supstrat i inhibitor se ne mogu istovremeno vezati za enzim, kao što je prikazano na slici sa desne strane. To je obično posledica toga da inhibitor ima afinitet za aktivno mesto enzima za koje se takođe vezuje supstrat; supstrat i inhibitor se nadmeću za pristup aktivnom mestu enzima. Ovaj tip inhibicije se može prevazići primenom dovoljno visokih koncentracija supstrata (Vmax ostaje konstantna), i.e., putem nadmašivanja inhibitora. Međutim, dolazi do povećanja pojavne Km vrednosti, jer je potrebna veća koncentracija supstrata da bi se dosegla Km tačka, ili polovina Vmax vrednosti.[4] Konkurentni inhibitori su obično strukturno slični sa realnim supstratom (vidi primer ispod).
- U nekonkurentnoj inhibiciji, inhibitor se jedino vezuje za supstrat-enzimski kompleks. Ovaj tip inhibicije uzrokuje sniženje Vmax vrednosti (maksimalna brzina se smanjuje usled uklanjanja activiranog kompleksa) i Km vrednosti (usled povećane efikasnosti vezivanja koja proizilazi iz Le Šateljeovog principa i efektivne eliminacije ES kompleksa čime se umanjuje Km, što je indikator povećanog afiniteta vezivanja).[4]
- U ne-konkurentnoj (bez-konkurentnoj) inhibiciji, vezivanjem inhibitora za enzim se redukuje njegova aktivnost, mada to nema uticaja na vezivanje supstrata. Rezult toga je da stepen inhibicije jedino zavisi od koncentracije inhibitora. Vmax se smanjuje, jer se reakcija manje efikasno odvija, dok se Km vrednost ne menja, jer se samo vezivanje supstrata, po definiciji, i dalje normalno odvija.[4]
- U mešovitoj inhibiciji, inhibitor se može istovremeno vezati za enzim sa supstratom. Ovaj tip vezivanja inhibitora utiče na vezivanje supstrata, i obrnuto. Inhibicija se može umanjiti, ali ne i prevazići povećanjem koncentracije substrata. Mada postoji mogućnost da se inhibitori mešovitog tipa vežu za aktivno mesto, ovaj tip inhibicije generalno proizilazi iz alosternog dejstva, pri čemu se inhibitor vezuje na različitom mestu na enzimu. Vezivanje inhibitora za alosterno mesto menja konformaciju (i.e., tercijarnu strukturu ili trodimenzionalni oblik) enzima, tako da je afinitet supstrata za aktivno mesto umanjen.[4]
Kvantitativni opis reverzibilne inhibicije
Reverzibilna inhibicija se može kvantitativno opisati putem vezivanja inhibitora za enzim i za enzim-supstratni kompleks, i njegovog uticaja na kinetičke konstante enzima. U klasičnoj Mihaelis-Mentenovoj šemi enzim (E) vezuje svoj supstrat (S) i formira se enzim–supstratni kompleks ES. Nakon katalize, ovaj kompleks se razlaže i oslobađaju se produkt P i slobodni enzim. Inhibitor (I) se može vezati za bilo E ili ES sa konstantama disocijacije Ki ili Ki', respektivno.
Kad enzim ima višestruke supstrate, inhibitori mogu da ispolje različite tipove inhibicije u zavisnosti od supstrata. Do toga dolazi zato što aktivno mesto sadrži dva različita mesta vezivanja, po jedno za svaki supstrat. Na primer, inhibitor se može nadmetati sa supstratom A za prvo mesto vezivanja, i biti ne-konkurentni inhibitor supstrata B u drugom mestu vezivanja.[5]
Merenje konstante disocijacije reverzibilnog inhibitora
Kao što je gore napomenuto, enzimski inhibitor se opisuje putem svoje dve konstante disocijacije, Ki i Ki', od enzima i enzim-supstratnog kompleksa, respektivno. Enzim-inhibitorska konstanta Ki se može direktno meriti različitim metodima. Jedan od izuzetno preciznih metoda je izotermalna titraciona kalorimetrija, u kojoj se inhibitor titrira u rastvor enzima i meri se oslobođena ili apsorbovana toplota.[6] Drugu kontantu disocijacije Ki' je teško direktno meriti, pošto je enzim-supstratni kompleks kratkotrajan i podleže hemijskoj reakciji kojom se formira produkt. Stoga se Ki' obično indirektno meri putem posmatranja enzimske aktivnosti pri različitim koncentracijama supstrata i inhibitora, i postavljanjem podataka[7] u modifikovanu Mihaelis-Mentenovu jednačinu
gde su modifikujući faktori α i α' definisani putem koncentracije inhibitora i njegove dve konstante disocijacije

Stoga, u prisustvu inhibitora, enzimske efektivne Km i Vmax vrednosti postaju (α/α')Km i (1/α')Vmax, respektivno. Treba imati u vidu da modifikovana Mihaelis-Mentenovova jednačina podrazumeva da je ostvarena ravnoteža vezivanja inhibitora za enzim, što može da bude veoma spor proces za inhibitore sa pod-nanomolarnim konstantama disocijacije. U tim slučajevima, obično je praktičnije da se tretira čvrsto vezujući inhibitor kao ireverzibilni inhibitor (vidi ispod); mada još uvek može da postoji opcija kinetičkog procenjivanja Ki', ako se nezavisno izmeri Ki.
Uticaji različitih tipova reverzibilnih inhibitora enzima na enzimatsku aktivnost se mogu prikazati koristeći grafičke reprezentacije Mihaelis-Mentenovove jednačine, kao što su Lajnviver–Burkov i Edi-Hofstijevi dijagrami. Na primer, na Lajnviver–Burkom dijagramu linija konkurentne inhibicije preseca y-osu, što ilustruje da takvi inhibitori nemaju uticaja na Vmax. Slično tome, linije ne-konkurentne inhibicije presecaju x-osu, što pokazuje da ti inhibitori ne utiču na Km. Međutim često je teško da se precizno procene Ki i Ki' vrednosti sa tih dijagrama,[8] te se preporučuje da procene konstanti vrše koristeći pouzdanije metode nelinearne regresije, kao što je gore opisano.
Reverzibilni inhibitori
Tradicionalno se reverzibilni inhibitori enzima klasifikuju kao konkurentni, nekonkurentni ili mešoviti, na osnovu njihovog uticaja na Km i Vmax parametre. Ti različiti uticaji direktno proizilaze iz načina vezivanja inhibitora za enzim E, enzim–supstratni kompleks ES, ili oba. Podela u ove klase proističe iz problema sa određivanjem parametara i stvara potrebu za korišćenjem različitih konstanti vezivanja za opisivanje čina vezivanja. Vezivanje inhibitora i njegov uticaj na enzimatsku aktivnost su dve potpuno različite svari, što je još jedan problem koji tradicionalne jednačine ne odražavaju. Kod nekonkurentne inhibicije vezivanje inhibitora sledstveno jednačinama jedino dovodi do potpune (100%) inhibicije enzima, i jednačine ne ostavljaju mogućnost postojanja bilo čega između tih krajnosti.[9] Zajednički oblik inhibitornog člana takođe zamagljuje odnos između vezivanja inhibitora za enzim i njegovog odnosa sa drugim članovima vezivanja, bilo da je to Mihaelis-Mentenova jednačina ili dozno-responsna kriva asocirana sa vezivanjem liganda za receptor. Da bi se demonstrirao odnos, može se napraviti sledeći rearanžman:
Dodavajući nulu na dno ([I]-[I])
Deleći sa [I]+Ki
Ova notacija demonstrira da slično Mihaelis–Mentenovoj jednačini, gde brzina reakcije zavisi od procenta enzimske populacije koja formira interakcije sa supstratom, , uticaj inhibitora je rezultat procenta populacije enzima koja formira interakcije sa inhibitorom, .
Problem sa ovom jednačinom je da u njenoj trenutnoj formi ona podrazumeva apsolutnu inhibiciju enzima vezivanjem inhibitora, dok se u stvarnosti može javiti širok opseg uticaja, od 100% inhibicije supstrata do samo izvesnog procenta, >0%. Da bi se to uzelo u obzir, jednačina se može jednostavno promeniti uvođenjem delta Vmax člana, tako da dozvoljava različite stepene inhibicije.
ili
Ovaj član može onda da definiše rezidualni procenat enzimatske aktivnosti kad inhibitor interaguje sa individualnim enzimima u populaciji. Uključivanje ovog termina ima dodatnu prednost dozvoljavanja mogućnosti aktivacije ako se ispostavi da je sekundarni Vmax član veći od inicijalnog člana. Da bi se uzela u obzir mogućnost aktivacije, notacija se može prilagoditi zamenjivanjem inhibitorske oznake "I" opštijom oznakom "X".
Dok ova terminologija dovodi do pojednostavljenog načina rukovanja kinetičkim efektima vezanim za maksimalnu brzinu Mihaelis–Mentenove jednačine, ona isto tako naglašava potencijalne probleme sa članovima koji se koriste za opisivanje efekata vezanih za Km. Km vrednost vezana za afinitet enzima za supstrat je u većini slučaja povezana sa promenama potencijala aktivnog mesta enzima, što je direktna posledica interakcije enzima i inhibitora. Stoga je član sličan gore navedenom članu za korekciju Vmax podesan u većini situacija:[10][11]
Specijalni slučajevi
- Mehanizam parcijalno konkurentne inhibicije je sličan sa ne-konkurentnim, izuzev da EIS kompleks ima katalitičku aktivnost, koja može da bude niža ili čak viša (parcijalno kompetitivna aktivacija), nego aktivnost enzimsko–supstratnog (ES) kompleksa. Ova inhibicija tipično ispoljava nižu Vmax vrednost, do se Km vrednost ne menja.[5][12]
- Inhibicija supstrata i produkata se javlja kad bilo supstrat ili produkt enzimatske reakcije inhibira enzimsku aktivnost. Ovaj oblik inhibicije može da sledi kompetitivne, nekompetitne ili mešovite obrasce. Pri supstratnoj inhibiciji dolazi do progresivnog smanjenja aktivnosti pri visokim koncentracijama supstrata. To može da bude indikacija postojanja dva mesta vezivanja suptrata na enzimu. Pri niskim koncentracijama supstrata, mesto visokog afiniteta je okupirano i normalna kinetika dolazi do izražaja. Međutim, pri visokim koncentracijama, dolazi do zauzeća sekundarnog, inhibitornog mesta, čime se inhibira enzim.[13] Produkt inhibicije često služi kao regulatorno svojstvo pri metabolizmu i može da formira negativnu povratnu spregu.[14]
- Spora i jaka inhibicija se javlja kad inicijalni kompleks enzima i inhibitora (EI) podleže izomerizaciji do drugog, čvršće pakovanog kompleksa, EI*, iako je sveukupni proces inhibicije reverzibilan.[15] Ovo se manifestuje kao sporo rastuća inhibicija enzima. Pod ovim uslovima, tradicionalna Mihaelis-Mentenovova kinetika daje pogrešnu vrednost za Ki, jer je ona zavisna od vremena. Korektna Ki vrednost se može dobiti putem kompleksnije analize konstanti brzina asocijacije (kon) i disocijacije (koff) inhibitora. Dodatne informacije su dostupne u sekciji o ireverzibilnoj inhibiciji.
Primeri reverzibilnih inhibitora

Enzimi su eviluciono razvili sposobnost čvrstog vezivanja svojih substrata. Pošto se većina reverzibilnih inhibitora vezuje za aktivno mesto enzima, nije iznenađujuće da neki od tih inhibitora imaju veoma slične strukture sa substratima njihove mete. Jedan od primera oponašanja supstrata su proteazni inhibitori. Oni su veoma uspešna klasa antiretroviralnih lekova koji se koriste za tretman HIV infekcije.[16] Struktura ritonavira, proteaznog inhibitora baziranog na peptidu, koji sadrži tri peptidne veze, je prikazana sa desne strane. Ovaj lek nalikuje na protein koji je supstrat HIV proteaze, i nadmeće sa tim supstratom za pristup aktivnom mestu enzima.
Enzimski inhibitori se često dizajniraju tako da oponašaju prelazno stane ili intermedijer enzimski katalizovane reakcije. Time se osigurava da inhibitor iskoristi stabilizijući efekat prelaznog stanja enzima, što dovodi do poboljšanog afiniteta vezivanja (niže Ki vrednosti), nego što je slučaj sa dizajnima baziranim na substratu. Primer takvog inhibitora prelaznog stanja je antiviralni lek oseltamivir. Ovaj lek oponaša planarnu strukturu prstena oksonijumskog jona u reakciji viralnog enzima neuraminidaze.[17]
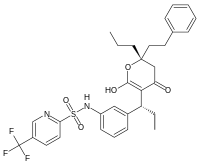
Međutim, nisu svi inhibitori bazirani na strukturama substrata. Na primer, struktura inhibitora HIV proteaze tipranavira je prikazana na levoj strani. Ovaj molekul nije baziran na peptidu i nije očigledno strukturno sličan sa proteinskim supstratom. Ti nepeptidni inhibitori mogu da budu stabilniji od inhibitora koji sadrže peptidne veze, pošto oni nisu supstrati peptidaza i manje su skloni degradaciji.[18]
Pri dizajnu lekova je važno da se uzmu u obzir koncentracije supstrata kojima su izloženi ciljni enzimi. Na primer, neki inhibitori proteinskih kinaza imaju hemijske strukture koje su slične sa adenozin trifosfatom, jednim od supstrata tih enzima. Međutim, lekovi koji su jednostavni kompetitivni inhibitori će morati da se nadmeću sa visokim koncentracijama ATP molekula u ćeliji. Proteinske kinaze se isto tako mogu inhibirati konkurencijom za mesta vezivanja na kojima kinaze formiraju interakcije sa njihovim supstratnim proteinima. Većina proteina je prisutna u ćelijama na koncentracijama koje su daleko niže od koncentracije ATP molekula. Konsekventno, ako se dva inhibitora proteinske kinaze vezuju za aktivna mesta sa sličnim afinitetom, ali samo jedan od njih mora da se nadmeće sa ATP molekulima, onda će kompetitivni inhibitor na mestu proteinskog vezivanja ispoljiti efektivniju inhiciju enzima.[19]
Ireverzibilni inhibitori
Tipovi ireverzibilne inhibicije

Ireverzibilni inhibitori obično kovalentno modifikuju enzim, i inhibicija stoga ne može da bude povratna. Ireverzibilni inhibitori često sadrže reaktivne funkcionalne grupe, kao što su azotni iperiti, aldehidi, haloalkani, alkeni, Majklovi akceptori, fenil sulfonati, or fluorofosfonati. Te elektrofilne grupe reaguju sa aminokiselinskim bočnim lancima i formiraju kovalentne dodatke. Modifikovani ostaci su oni sa bočnim lancima koji sadrže nukleofile kao što su hidroksilne ili sulfhidrilne grupe; tu se ubrajaju aminokiseline serin (kao u slučaju DFP molekula, prikazano na desnoj strani), cistein, treonin, ili tirozin.[20]
Ireverzibilna inhibicija se razlikuje od ireverzibilne enzimske inaktivacije. Ireverzibilni inhibitori su generalno specifični za jednu klasu enzima i ne inaktiviraju sve proteine. Oni ne funkcionišu putem uništavanja proteinske strukture, nego putem specifičnih promena aktivnog mesta njihove mete. Na primer, ekstremne vrednosti pH ili temperature obično uzrokuju denaturaciju svih proteinskih struktura, što je nespecifičan efekat. Slično tome, pojedini nespecifični hemijski tretmani uništavaju proteinsku strukturu: na primer, zagrevanje u koncentrovanoj hlorovodoničnoj kiselini će hidrolizovati peptidne veze koje su u osnovi proteina, oslobađajući time slobodne aminokiseline.[21]
Ireverzibilni inhibitori ispoljavaju vremenski zavisnu inhibiciju i njihova potentnost se stoga ne može okarakterisati pomoću IC50 vrednosti. Razlog za to je da se količina aktivnog enzima na datoj koncentraciji ireverzibilnog inhibitora razlikuje u zavisnosti od toga koliko dugo je inhibitor bio pre-inkubiran sa enzimom. Umesto toga se koriste kobs/[I] vrednosti,[22] gde je kobs uočena brzina inaktivacije pseudo-prvog reda (izvedena is odnosa log vrednost % aktivnosti i vremena), a [I] je koncentracija inhibitora. kobs/[I] parameter je validan dokle god se inhibitor ne zasiti vezivanjem za enzim (u kom slučaju kobs = kinact).
Analiza ireverzibilne inhibicije

Kao što je prikazano na slici sa leve strane, ireverzibilni inhibitori formiraju reverzibilni nekovalentni kompleks sa enzimom (EI ili ESI), i zatim dolazi do reakcije kojom se formira kovalentno modifikovani neaktivni kompleks EI*. Brzina kojom se EI* formira se naziva brzinom inaktivacije, ili kinact. Pošto formiranje EI može da se nadmeće sa ES, vezivanje ireverzibilnih inhibitora se može sprečiti konkurencijom bilo sa supstratom ili sa drugim, reverzibilnim inhibitorom. Ovaj protekcioni efekat je dobra potvrda specifičnosti reakcije ireverzibilnog inhibitora sa aktivnim mestom.
Koraci vezivanja i inaktivacije ove reakcije se ispituju putem inkubacije enzima sa inhibitorom i utvrđivanjem stepena aktivnosti koji preostaje tokom vremena. Aktivnost će opadati u vremenski zavisnom maniru, obično sledeći eksponentni raspad. Uklapanjem tih podataka u jednačinu brzine daje brzinu inaktivacije pri datoj koncentraciji inhibitora. To se radi za nekoliko različih koncentracija inhibitora. Ako dolazi do formiranja reverzibilnog EI kompleksa, biće uočljivo zasićenje brzine inaktivacije. Iz korespondirajuće krive se može izvesti kinact i Ki.[23]
Drugi metod koji je u širokoj upotrebi u ovim analizama je masena spektrometrija. Ovde precizno merenje mase nemodifikovanog prirodnog enzima i inaktiviranog enzima daje povećanje mase uzrokovano reakcijom sa inhibitorom i pokazuje stehiometriju reakcije.[24] To se obično radi koristeći MALDI-TOF maseni spektrometer. U komplementarnoj tehnici zvanoj peptidni maseni otisci prstiju vrši se razlaganje prirodnog i modifikovanog proteina dejstvom proteaze, kao što je tripsin. Time nastaje set peptida koji se mogu analizirati koristeći maseni spektrometar. Peptidi koji promene masu nakon reakcije sa inhibitorom su oni koji sadrže mesto modifikacije.
Specijalni slučajevi

Ne formiraju svi ireverzibilni inhibitori kovalentne dodatke na njihovim enzimskim metama. Neki reverzibilni inhibitori se tako čvrsto vežu za svoje ciljne enzime da su esencijalno ireverzibilni. Ovi potentno vezujući inhibitori mogu da ispolje kinetike slične kovalentnim ireverzibilnim inhibitorima. Neki od tih inhibitora se brzo vezuju za enzim u EI kompleks sa niskim afiniteta i zatim dolazi do sporog rearanžmana do veoma čvrsto vezanog EI* kompleksa (pogledajte gornju sliku). Ovakvo kinetičko ponašanje se naziva sporim vezivanjem.[26] Spori rearanžman nakon vezivanja često obuhvata konformacionu promenu pri čemu se enzim obavije oko molekula inhibitora. Primeri sporo vezujućih inhibitora uključuju neke od važnih lekova, kao što su metotreksat,[27] alopurinol,[28] i aktivirani oblik aciklovira.[29]
Primeri ireverzibilnih inhibitora

Diizopropilfluorofosfat (DFP) je prikazan kao primer ireverzibilnog proteaznog inhibitora na slici gore desno. Enzim hidrolizuje fosfor–fluornu vezu, ali fosfatni ostatak ostaje vezan za serin u aktivnom mestu, čime se enzim deaktivira.[30] Slično tome, DFP isto tako reaguje sa aktivnim mestom acetilholinske esteraze u sinaptičkim neuronima, i konsekventno je potentan neurotoksin, sa letalnom dozom manjom od 100 mg.[31]
Samoubilačka inhibicija je neobični tip ireverzibilne inhibicije gde enzim konvertuje inhibitor u reaktivnu formu u svom aktivnom mestu. Primer takvog jedinjenja je inhibitor poliaminske biosinteze, α-difluorometilornitin ili DFMO, koji je analog aminokiseline ornitina, i koristi se za treatiranje Afričke tripanosomijaze (bolesti spavanja). Ornitinska dekarboksilaza može da katalizuje dekarboksilaciju DFMO umesto ornitina, kao što je prikazano gore. Međutim, toj reakciji dekarboksilacije sledi eliminacija atoma fluora, čime se konvertuje ovaj katalitički intermedijer u konjugovani imin, koji je veoma elektrofilno jedinjenje. Ova reaktivna forma DFMO molekula zatim reaguje bilo sa cisteinom ili sa lizinom u aktivnom mestu čime se ireverzibilno inaktivira enzim.[25]
Pošto ireverzibilna obično obuhvata inicijalno formiranje nekovalentnog EI kompleksa, ponekad je moguće da se inhibitor veže za enzim na više od jednog načina. Na primer, na slici je prikazana tripanotionska reduktaza iz ljudskog protozoanskog parazita Trypanosoma cruzi. Dva molekula inhibitora zvanog kvinakrinski iperit su vezana u aktivnom mestu ovog enzima. Gornji molekul je reverzibilno vezan, dok je donji vezan kovalentno pošto je reagovao sa aminokiselinskim ostatkom putem azotno iperitne grupe.[32]
Otkriće i dizajn inhibitora

Novi lekovi su produkti dugotrajnog procea razvoja lekova. Prvi korak u tom procesu je često otkriće novog enzimskog inhibitora. U prošlosti je jedini način da se otkriju novi inhibitori bio pristup pokušaja i greške: testiranje ogromnih kolekcija jedinjenja na ciljnom enzimu u nadi da će se doći korisnih molekula. Ovaj pristup grube sile je još uvek uspešan i bio je proširen primenom kombinatorno hemijskih pristupa koji brzo proizvode ogromne brojeve novih jedinjenja i tehnologijom visokopropusnog skrininga da bi se brzo testirale ogromne hemijske kolekcije s ciljem nalaženja inhibitora.[33]
Jedan od alternativnih pristupa je racionalni dizajn lekova pri čemu se koristi tridimenziona struktura aktivnog mesta enzima da bi se predvidelo koji molekuli bi mogli da budu inhibitori.[34] Ta predviđanja se zatim testiraju. Novi inhibitori se nakon toga koriste za dobijanje strukture enzima u kompleksu inhibitor/enzim, da bi se potvrdilo na koji način su molekuli vezani za aktivno mesto. Na bazi struktura je moguće dizajnirari izmenjenje inhibitore s ciljem dalje optimizacije vezivanje. Ovaj ciklus testiranja i popoljšanja se zatim ponavlja dok se ne dođe do dovoljno potentnih inhibitora.[35] Niz pristupa baziranih na primeni računara za predviđanje afiniteta inhibitora za enzim je razvijen. Primeri takvih metoda su molekularni doking[36] i molekulska mehanika.[37][38]
Upotrebe inhibitora
Enzimski inhibitori se mogu naći u prirodi. Osim njih postoji i znatan broj inhibitora koji su dezajnirani i proizvode se za farmakološke svrhe i biohemijska istraživanja. Prirodni otrovi su često enzimski inhibitori koji su evoluirali da štite biljke ili životinje od predatora. Ti prirodni toksini obuhvataju neke od najsmrtonosnijih otrova. Veštački inhibitori se često koriste kao lekovi, mada oni isto tako mogu da budu insekticidi kao što je malation, herbicidi kao što je glifosat, ili dizinfektanti kao što je triklosan. Deo veštačkih enzimski inhibitora blokira acetilholinesterazu, enzim koji razlaže acetilholin, i koriste se kao nervni agensi u bojnim otrovima.
Hemoterapija
 |
 |
 |
Enzimski inhibitori se najčešće koriste kao lekovi za tretman bolesti. Mnogi od njih deluju na ljudske enzime s ciljom korigovanja patološkog stanja. Međutim, nisu svi lekovi enimski inhibitori. Neki, kao što su anti-epileptički lekovi, menjaju aktivnost enzima uzrokujući da se enzim proivodi u manjoj ili većoj količini. Ti efekti se nazivaju enzimskom indukcija i inhibicija[42] i oni su promene u izražavanju gena. To nije direkno povezano sa tipom enzimske inhibicije koji se ovde diskutuju. Drugi lekovi formiraju interakcije sa ćelijskim metama koje nisu enzimi, kao što su jonski kanali ili membranski receptori.
Primer medicinskog enzimskog inhibitora je sildenafil (Viagra), popularni treatment za mušku erektilnu disfunkciju. Ovo jedinjenje je potentni inhibitor cGMP specifične fosfodiesteraze tipa 5, enzima kogi degradera signalni molekul ciklični guanozin monofosfat.[43] Ovaj signalni molekul podstiče relaksaciju glatkih mišića i omogućava protok krvi u corpus cavernosum, što uzrokuje erekciju. Pošto lek umanjuje aktivnost enzima koji zaustavlja signal, produžava se trajanje signala.
Još jedan primer strukturne sličnosti pojedinih inhibitora sa supstratima enzima na koje deluju je prikazan na slici u kojoj se poredi lek metotreksat sa folnom kiselinom. Folna kiselina je supstrat dihidrofolatne reduktaze, enzima koji učestvuje u formiranju nukleotida, i koji biva potentno inhibiran metotreksatom. Metotreksat blokira dejstvo dihidrofolatne reduktaze i time zaustavlja produkciju nukleotida. Ova blokada nukleotidne biosinteze je toksičnija za brzorastuće ćelije nego za one koje se ne dele, zato što brzorastuće ćelije moraju da izvode replikaciju DNK. Stoga se metotreksat obično koristi za hemoterapiju kancera.[44]
Antibiotici
Lekovi se isto tako koriste za inhibranje enzima koji su neophodni za opstanak patogena.[45][46] Na primer, bakterije su okružene debelim ćelijskim zidom sačinjenim od polimera koji nalikuje na mrežu i naziva se peptidoglikan. Mnogi antibiotici, kao što su penicilin i vankomicin, inhibiraju enzime koji proizvode i zatim umrežavanju niti tog polimera.[47] Posledica njihovog dejstva je da bakterijski ćelijski zid gubi jačinu i bakterije se rasprsnu.[48] Na slici je prikazan molekul penicilina (prikazan u notacija kugle-i-štapa) vezan sa svoj ciljni enzim, transpeptidazu iz bakterije Streptomyces R61 (protein je prikazan kao trakasti dijagram).[49]
Antibiotički dizajn lekova je olakžan kad je enzim koji je esencijalan za opstanak patogena odsutan ili veoma različit kod ljudi.[50] U gornjem primeru, ljudsko telo ne pravi peptidoglikan, i stoga su inhibitori tog procesa selektivno toksični za bakterije. Selektivna toksičnost se isto tako ostvaruje kod antibiotika putem iskorištavanja razlika u strukturi ribozoma kod bakterija,[51] ili načina na koji one prave masne kiseline.[52]
Metabolička kontrola
Enzimski inhibitori su važni u metaboličkoj kontroli.[53] Mnogi ćelijski metabolički patevi su inhibirani metabolitima, koji kontrolišu enzimsku aktivnost putem alosterne regulacije ili inhibicije supstrata. Dobar primer je alosterna regulacija glikolitičkog puta.[54] Ovaj katabolički put konzumira glukozu i proizvodi ATP, NADH i piruvat.[55][56] Ključni korak u regulaciji glikolize je jedna rana reakcija puta koja je katalizovana fosfofruktokinazom-1 (PFK1).[57][58] Kad se ATP nivo povisi, ATP se vezuje za alosterno mesto na PFK1 čime se snižava brzina enzimske reakcije; glikoliza se inhibira i opada produkcija ATP. Ovaj oblik kontrole negativnom povratnom spregom pomaže u održavanju stabilnih nivoa koncentracije ATP molekula u ćeliji.[59] Međutim, metabolički putevi se ne regulišu samo inhibicijom, već je aktivacija enzima jednako važna. U tom smislu su PFK1, fruktoza 2,6-bisfosfat i ADP primeri metabolita koji deluju kao alosterini aktivatori.[60]
Fiziološka enzimska inhibicija se takođe može proizvesti putem specifičnih proteinskih inhibitora. Taj mehanizam se javlja u pankreasu, koji sinhetiše mnoštvo digestivnih prekursorskih enzima, poznatih kao zimogeni.[61][62] Mnogi od njih se aktiviraju dejstvom proteaze tripsin,[63] tako da je važno da se inhibira aktivnost tripsina u pankreasu da bi se sprečila situacija u kojoj oragan samog sebe svaruje.[64] Jedan način kontrole aktivnosti tripsina je produkcija specifičnog i potentnog proteinskog inhibitora tripsina u pankreasu.[65] Taj inhibitor se čvrsto vezuje za tripsin, sprečavajući aktivnost tripsina koja bi inaće bila štetna za organ.[66] Mada je tripsinski inhibitor protein, on izbegava da postane supstrat proteaze tako što uklanja vodu iz aktivnog mesta tripsina i time destabilizuje prelazno stanje.[67] Drugi primeri fizioloških enzimskih inhibitornih proteina su barstar koji je inhibitor bakterijske ribonukleaze barnaze[68][69][70][71] i inhibitori proteinskih fosfataza.[72]
Reference
- ^ Robert A. Copeland (2013-05-06). Evaluation of Enzyme Inhibitors in Drug Discovery: A Guide for Medicinal Chemists and Pharmacologists (2nd изд.). ISBN 9781118488133. doi:10.1002/9781118540398.
- ^ Shapiro, R; Vallee, BL (1991). „Interaction of human placental ribonuclease with placental ribonuclease inhibitor”. Biochemistry. 30 (8): 2246—55. PMID 1998683. doi:10.1021/bi00222a030.
- ^ Berg J.; Tymoczko J.; Stryer L. (2002). Biochemistry.. W. H. Freeman and Company. ISBN 0-7167-4955-6.
- ^ а б в г д Cleland WW (1963). „The kinetics of enzyme-catalyzed reactions with two or more substrates or products. II. Inhibition: nomenclature and theory”. Biochim. Biophys. Acta. 67: 173—87. PMID 14021668. doi:10.1016/0926-6569(63)90226-8.
- ^ а б Segel, Irwin H. (1993). Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (New изд.). Wiley-Interscience. ISBN 0-471-30309-7.
- ^ Holdgate, GA (2001). „Making cool drugs hot: isothermal titration calorimetry as a tool to study binding energetics”. BioTechniques. 31 (1): 164—6, 168, 170 passim. PMID 11464510.
- ^ Leatherbarrow, RJ (1990). „Using linear and non-linear regression to fit biochemical data”. Trends in Biochemical Sciences. 15 (12): 455—8. PMID 2077683. doi:10.1016/0968-0004(90)90295-M.
- ^ Tseng, SJ; Hsu, JP (1990). „A comparison of the parameter estimating procedures for the Michaelis-Menten model”. Journal of Theoretical Biology. 145 (4): 457—64. PMID 2246896. doi:10.1016/S0022-5193(05)80481-3.
- ^ Walsh, R.; Martin, E.; Darvesh, S. (2011). „Limitations of conventional inhibitor classifications”. Integrative Biology. Royal Society of Chemistry. 3 (12): 1197—1201. PMID 22038120. doi:10.1039/c1ib00053e.
- ^ Walsh, R.; Martin, E.; Darvesh, S. (2007). „A versatile equation to describe reversible enzyme inhibition and activation kinetics: Modeling β-galactosidase and butyrylcholinesterase”. Biochimica et Biophysica Acta (BBA) - General Subjects. 1770 (5): 733—746. PMID 17307293. doi:10.1016/j.bbagen.2007.01.001.
- ^ Walsh, Ryan (2012). „Ch. 17. Alternative Perspectives of Enzyme Kinetic Modeling”. Ур.: Ekinci, Deniz. Medicinal Chemistry and Drug Design (PDF). InTech. стр. 357—371. ISBN 978-953-51-0513-8.
- ^ Chris G Whiteley (2010-06-30). „Enzyme Kinetics: Partial and Complete Competitive Inhibition”. Biochemical Education. 25 (3).
- ^ Dixon, M.; Webb, E.C.; Thorne, C.J.R.; Tipton K.F. (1979). Enzymes (3rd изд.). London: Longman. стр. 126. ASIN: B001MVGNNO.
- ^ „Hormonal Regulation of Metabolism: The levels of glucose in the blood are regulated by the hormones insulin and glucagon from the pancreas, and T3 and T4 from the thyroid”. 2016-05-26.
- ^ John F. Morrison (1982). „The slow-binding and slow, tight-binding inhibition of enzyme-catalysed reactions”. Trends in Biochemical Sciences. 7 (3): 102—105. doi:10.1016/0968-0004(82)90157-8.
- ^ Hsu, JT; Wang, HC; Chen, GW; Shih, SR (2006). „Antiviral drug discovery targeting to viral proteases”. Current pharmaceutical design. 12 (11): 1301—14. PMID 16611117. doi:10.2174/138161206776361110.
- ^ Lew W, Chen X, Kim CU (2000). „Discovery and development of GS 4104 (oseltamivir): an orally active influenza neuraminidase inhibitor”. Curr. Med. Chem. 7 (6): 663—72. PMID 10702632. doi:10.2174/0929867003374886.
- ^ Fischer PM (2003). „The design, synthesis and application of stereochemical and directional peptide isomers: a critical review”. Curr. Protein Pept. Sci. 4 (5): 339—56. PMID 14529528. doi:10.2174/1389203033487054.
- ^ Bogoyevitch, MA; Barr, RK; Ketterman, AJ (2005). „Peptide inhibitors of protein kinases-discovery, characterisation and use”. Biochimica et Biophysica Acta. 1754 (1–2): 79—99. PMID 16182621. doi:10.1016/j.bbapap.2005.07.025.
- ^ Lundblad R. L. (2004). Chemical Reagents for Protein Modification. CRC Press Inc. ISBN 0-8493-1983-8.
- ^ Price, N.; Hames, B.; Rickwood, D., ур. (1996). Proteins LabFax. Academic Press. ISBN 0-12-564710-7.
- ^ Adam, GC; Cravatt, BF; Sorensen, EJ (2001). „Profiling the specific reactivity of the proteome with non-directed activity-based probes”. Chemistry & Biology. 8 (1): 81—95. PMID 11182321. doi:10.1016/S1074-5521(00)90060-7.
- ^ Maurer, T; Fung, HL (2000). „Comparison of methods for analyzing kinetic data from mechanism-based enzyme inactivation: application to nitric oxide synthase”. AAPS PharmSci. 2 (1): 68—77. PMC 2751003
 . PMID 11741224. doi:10.1208/ps020108.
. PMID 11741224. doi:10.1208/ps020108.
- ^ Loo JA, DeJohn DE, Du P, Stevenson TI, Ogorzalek LR (1999). „Application of mass spectrometry for target identification and characterization”. Med Res Rev. 19 (4): 307—19. PMID 10398927. doi:10.1002/(SICI)1098-1128(199907)19:4<307::AID-MED4>3.0.CO;2-2.
- ^ а б Poulin, R; Lu, L; Ackermann, B; Bey, P; Pegg, AE (1992). „Mechanism of the irreversible inactivation of mouse ornithine decarboxylase by alpha-difluoromethylornithine. Characterization of sequences at the inhibitor and coenzyme binding sites”. The Journal of Biological Chemistry. 267 (1): 150—8. PMID 1730582.
- ^ Szedlacsek, SE; Duggleby, RG (1995). „Kinetics of slow and tight-binding inhibitors”. Enzyme Kinetics and Mechanism Part D: Developments in Enzyme Dynamics. Methods in Enzymology. 249. стр. 144—80. ISBN 978-0-12-182150-0. PMID 7791610. doi:10.1016/0076-6879(95)49034-5.
- ^ Stone, SR; Morrison, JF (1986). „Mechanism of inhibition of dihydrofolate reductases from bacterial and vertebrate sources by various classes of folate analogues”. Biochimica et Biophysica Acta. 869 (3): 275—85. PMID 3511964. doi:10.1016/0167-4838(86)90067-1.
- ^ Pick, FM; McGartoll, MA; Bray, RC (1971). „Reaction of formaldehyde and of methanol with xanthine oxidase”. European Journal of Biochemistry / FEBS. 18 (1): 65—72. PMID 4322209. doi:10.1111/j.1432-1033.1971.tb01215.x.
- ^ Reardon, JE (1989). „Herpes simplex virus type 1 and human DNA polymerase interactions with 2'-deoxyguanosine 5'-triphosphate analogues. Kinetics of incorporation into DNA and induction of inhibition”. The Journal of Biological Chemistry. 264 (32): 19039—44. PMID 2553730.
- ^ Cohen, J.A.; Oosterbaan, R.A.; Berends, F. (1967). „[81] Organophosphorus compounds”. Enzyme Structure. Methods in Enzymology. 11. стр. 686. ISBN 978-0-12-181860-9. doi:10.1016/S0076-6879(67)11085-9.
- ^ Brenner, G. M. (2000). Pharmacology. Philadelphia, PA: W.B. Saunders Company. ISBN 0-7216-7757-6.
- ^ Saravanamuthu, A; Vickers, TJ; Bond, CS; Peterson, MR; Hunter, WN; Fairlamb, AH (2004). „Two interacting binding sites for quinacrine derivatives in the active site of trypanothione reductase: a template for drug design”. The Journal of Biological Chemistry. 279 (28): 29493—500. PMC 3491871
 . PMID 15102853. doi:10.1074/jbc.M403187200.
. PMID 15102853. doi:10.1074/jbc.M403187200.
- ^ Koppitz M, Eis K; Eis (2006). „Automated medicinal chemistry”. Drug Discov. Today. 11 (11–12): 561—8. PMID 16713909. doi:10.1016/j.drudis.2006.04.005.
- ^ Scapin G (2006). „Structural biology and drug discovery”. Curr. Pharm. Des. 12 (17): 2087—97. PMID 16796557. doi:10.2174/138161206777585201.
- ^ Gohlke H, Klebe G; Klebe (2002). „Approaches to the description and prediction of the binding affinity of small-molecule ligands to macromolecular receptors”. Angew. Chem. Int. Ed. Engl. 41 (15): 2644—76. PMID 12203463. doi:10.1002/1521-3773(20020802)41:15<2644::AID-ANIE2644>3.0.CO;2-O.
- ^ Glen RC, Allen SC; Allen (2003). „Ligand-protein docking: cancer research at the interface between biology and chemistry”. Curr. Med. Chem. 10 (9): 763—7. PMID 12678780. doi:10.2174/0929867033457809.
- ^ Allinger NL, Burkert U (1982). Molecular Mechanics. An American Chemical Society Publication. ISBN 0-8412-0885-9.
- ^ Box VG (1997). „The Molecular Mechanics of Quantized Valence Bonds”. J Mol Model. 3 (3): 124—41. doi:10.1007/s008940050026.
- ^ „Sildenafil Citrate”. The American Society of Health-System Pharmacists. Приступљено 2014-12-01.
- ^ Peters GJ, van der Wilt CL, van Moorsel CJ, Kroep JR, Bergman AM, Ackland SP (2000). „Basis for effective combination cancer chemotherapy with antimetabolites”. Pharmacol. Ther. 87 (2–3): 227—53. PMID 11008002. doi:10.1016/S0163-7258(00)00086-3.
- ^ Silvaggi, N.R.; Josephine, H.R.; Kuzin, A.P.; Nagarajan, R.; Pratt, R.F.; Kelly, J.A. (2005). „Crystal structures of complexes between the R61 DD-peptidase and peptidoglycan-mimetic beta-lactams: a non-covalent complex with a "perfect penicillin"”. J.Mol.Biol. 345: 521—533. PMID 15581896. doi:10.1016/j.jmb.2004.10.076.
- ^ Park BK, Breckenridge AM (1981). „Clinical implications of enzyme induction and enzyme inhibition.”. Clin Pharmacokinet. 6 (1): 1—24. PMID 6113907. doi:10.2165/00003088-198106010-00001.
- ^ Maggi, M; Filippi, S; Ledda, F; Magini, A; Forti, G (2000). „Erectile dysfunction: from biochemical pharmacology to advances in medical therapy”. European Journal of Endocrinology. Bioscientifica. 143 (2): 143—54. PMID 10913932. doi:10.1530/eje.0.1430143.
- ^ McGuire, JJ (2003). „Anticancer antifolates: current status and future directions”. Current pharmaceutical design. 9 (31): 2593—613. PMID 14529544. doi:10.2174/1381612033453712.
- ^ „Antibiotics”. NHS. 2014-06-05. Приступљено 2015-01-17.
- ^ „Factsheet for experts”. European Centre for Disease Prevention and Control. Приступљено 2014-12-24.
- ^ Katz, AH; Caufield, CE (2003). „Structure-based design approaches to cell wall biosynthesis inhibitors”. Current pharmaceutical design. 9 (11): 857—66. PMID 12678870. doi:10.2174/1381612033455305.
- ^ Tan, Siang Yong; Tatsumura, Yvonne (2015-07-01). „Alexander Fleming (1881–1955): Discoverer of penicillin”. Singapore Medical Journal. 56 (7): 366—367. ISSN 0037-5675. PMC 4520913
 . PMID 26243971. doi:10.11622/smedj.2015105.
. PMID 26243971. doi:10.11622/smedj.2015105.
- ^ Gualerzi, Claudio O.; Brandi, Letizia; Fabbretti, Attilio; Pon, Cynthia L. (2013-12-04). Antibiotics: Targets, Mechanisms and Resistance. John Wiley & Sons. ISBN 9783527333059.
- ^ Calderon CB, Sabundayo BP (2007). Antimicrobial Classifications: Drugs for Bugs. In Schwalbe R, Steele-Moore L, Goodwin AC. Antimicrobial Susceptibility Testing Protocols. CRC Press. Taylor & Frances group. ISBN 978-0-8247-4100-6
- ^ Srivastava A, Talaue M, Liu S, Degen D, Ebright RY, Sineva E, Chakraborty A, Druzhinin SY, Chatterjee S, Mukhopadhyay J, Ebright YW, Zozula A, Shen J, Sengupta S, Niedfeldt RR, Xin C, Kaneko T, Irschik H, Jansen R, Donadio S, Connell N, Ebright RH (2011). „New target for inhibition of bacterial RNA polymerase: 'switch region'”. Curr. Opin. Microbiol. 14 (5): 532—43. PMC 3196380
 . PMID 21862392. doi:10.1016/j.mib.2011.07.030.
. PMID 21862392. doi:10.1016/j.mib.2011.07.030.
- ^ Cunha BA. Antibiotic Essentials 2009. Jones & Bartlett Learning, ISBN 978-0-7637-7219-2 p. 180, for example.
- ^ Nicholson, Donald E. (1971). An Introduction to Metabolic Pathways by S. DAGLEY (Vol. 59, No. 2 изд.). Sigma Xi, The Scientific Research Society. стр. 266.
- ^ Reece, Jane B. (2011). Campbell biology / Jane B. Reece ... [et al.]. (9th изд.). Boston: Benjamin Cummings. стр. 143. ISBN 978-0-321-55823-7.
- ^ Bailey, Regina. „10 Steps of Glycolysis”.
- ^ Romano, AH; Conway, T (1996). „Evolution of carbohydrate metabolic pathways”. Res Microbiol. 147 (6–7): 448—55. PMID 9084754. doi:10.1016/0923-2508(96)83998-2.
- ^ Wegener G, Krause U (2002). „Different modes of activating phosphofructokinase, a key regulatory enzyme of glycolysis, in working vertebrate muscle”. Biochem. Soc. Trans. 30 (2): 264—270. PMID 12023862. doi:10.1042/bst0300264.
- ^ Raben N, Exelbert R, Spiegel R, Sherman JB, Nakajima H, Plotz P, Heinisch J (1995). „Functional expression of human mutant phosphofructokinase in yeast: genetic defects in French Canadian and Swiss patients with phosphofructokinase deficiency”. Am. J. Hum. Genet. 56 (1): 131—141. PMC 1801305
 . PMID 7825568.
. PMID 7825568.
- ^ Cannon, W. B. (1926). „Physiological regulation of normal states: some tentative postulates concerning biological homeostatics”. Ур.: A. Pettit(ed.). A Charles Richet : ses amis, ses collègues, ses élèves. Paris: Les Éditions Médicales. стр. 91.
- ^ Okar, DA; Lange, AJ (1999). „Fructose-2,6-bisphosphate and control of carbohydrate metabolism in eukaryotes”. BioFactors (Oxford, England). 10 (1): 1—14. PMID 10475585. doi:10.1002/biof.5520100101.
- ^ Robert M. Stroud; Anthony A. Kossiakoff; John L. Chambers (1977). „Mechanisms of Zymogen Activation”. Annual Review of Biophysics and Bioengineering. 6: 177—193. doi:10.1146/annurev.bb.06.060177.001141.
- ^ Hans Neurath; Kenneth A. Walsh (1976). „Biochemistry Role of proteolytic enzymes in biological regulation (A Review) (limited proteolysis/zymogen activation/control mechanisms)” (PDF). Proc. Natl. Acad. Sci. USA. 73 (11): 3825—3832.
- ^ Rawlings ND, Barrett AJ (1994). „Families of serine peptidases”. Meth. Enzymol. Methods in Enzymology. 244: 19—61. ISBN 978-0-12-182145-6. PMID 7845208. doi:10.1016/0076-6879(94)44004-2.
- ^ N. Levilliers; M. Péron; B. Arrio; J. Pudles (октобар 1970). „On the mechanism of action of proteolyticinhibitors: IV. Effect of 8murea on the stability of trypsin in trypsin-lnhibitor complexes”. Archives of Biochemistry and Biophysics. 140 (2): 474—483. PMID 5528741. doi:10.1016/0003-9861(70)90091-3.
- ^ Dreon M. S.; Ituarte S.; Heras H. (2010). „The Role of the Proteinase Inhibitor Ovorubin in Apple Snail Eggs Resembles Plant Embryo Defense against Predation”. PLoS ONE. 5 (12): e15059. PMID 21151935. doi:10.1371/journal.pone.0015059.
- ^ Price, Nicholas; Stevens, Lewis (1999). Fundamentals of Enzymology. Oxford University Press. ISBN 0-19-850229-X. Проверите вредност параметра
|isbn=: invalid character (помоћ). - ^ Smyth, TP (2004). „Substrate variants versus transition state analogues as noncovalent reversible enzyme inhibitors”. Bioorganic & Medicinal Chemistry. 12 (15): 4081—8. PMID 15246086. doi:10.1016/j.bmc.2004.05.041.
- ^ Hartley, RW (1989). „Barnase and barstar: two small proteins to fold and fit together”. Trends in Biochemical Sciences. 14 (11): 450—4. PMID 2696173. doi:10.1016/0968-0004(89)90104-7.
- ^ Serrano L, Kellis JT, Cann P, Matouschek A, Fersht AR (април 1992). „The folding of an enzyme. II. Substructure of barnase and the contribution of different interactions to protein stability”. J. Mol. Biol. 224 (3): 783—804. PMID 1569557. doi:10.1016/0022-2836(92)90562-X.
- ^ Serrano L, Matouschek A, Fersht AR (април 1992). „The folding of an enzyme. III. Structure of the transition state for unfolding of barnase analysed by a protein engineering procedure”. J. Mol. Biol. 224 (3): 805—18. PMID 1569558. doi:10.1016/0022-2836(92)90563-Y.
- ^ Matouschek A, Serrano L, Fersht AR (април 1992). „The folding of an enzyme. IV. Structure of an intermediate in the refolding of barnase analysed by a protein engineering procedure”. J. Mol. Biol. 224 (3): 819—35. PMID 1569559. doi:10.1016/0022-2836(92)90564-Z.
- ^ Oliver, CJ; Shenolikar, S (1998). „Physiologic importance of protein phosphatase inhibitors”. Frontiers in Bioscience. 3: D961—72. PMID 9727084.
Literatura
- Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (5th изд.). New York, NY: W. H. Freeman. ISBN 0-7167-3051-0.
- Cornish-Bowden A, ур. (1997). New Beer in an Old Bottle: Eduard Buchner and the Growth of Biochemical Knowledge. Universitat de València. ISBN 84-370-3328-4.
- Suzuki H (2015). How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ISBN 978-981-4463-92-8.
- Cornish-Bowden A (2012). Fundamentals of Enzyme Kinetics (4th изд.). Weinheim: Wiley-VCH. ISBN 978-3527330744.
- G. E. Briggs; J. B. S. Haldane (1925). „A note on the kinetics of enzyme action”. Biochem. J. 19: 339—339. PMC 1259181
 .
. - R.R. Dogonadze; V.G. Levich (1959). „Theory of Non-radiative Electronic Transitions between Ions in Solution”. Dokladi Akademii Nauk SSSR. Ser. Fizicheskoy Khimii. Moscow. 124: 123—126.
- R.R. Dogonadze (1960). „Rate of Electron Transfer Reactions in Solutions”. Dokladi Akademii Nauk SSSR. Ser. Fizicheskoy Khimii. Moscow. 133: 1368—1371.
- Nishimura M; Chance B. (1963). „Studies on the electron-transfer systems in photosynthetic bacteria I. The light-induced absorption-spectrum changes and the effect of phenylmercuric acetate”. Biochim Biophys Acta. 66: 1—16. doi:10.1016/0006-3002(63)91162-4.
- V.G. Levich; R.R. Dogonadze; E.D. German; A.M. Kuznetsov; Yu.I. Kharkats (1970). „Theory of Homogeneous Reactions Involving Proton Transfer”. Electrochim.Acta. 15: 353—367.
- M.V. Volkenshtein; R.R. Dogonadze; A.K. Madumarov; Z.D. Urushadze; Yu. I. Kharkats (1972). „Theory of Enzyme Catalysis”. Molekuliarnaya Biologia: 431—439.
Vidi još
- Inhibicija enzimskih reakcija
- Proteomika bazirana na aktivnosti – grana proteomike koja koristi kovalentne inhibitore enzima kao indikatore pri izučavanju enzimske aktivnosti
- Antimetabolit
- Farmakofor
- Analog prelaznog stanja
Spoljašnje veze
- Web tutorial on enzyme inhibition, Tutorial by Dr Peter Birch of the University of Paisley, containing very clear animations
- Symbolism and Terminology in Enzyme Kinetics, Recommendations of the Nomenclature Committee of the International Union of Biochemistry (NC-IUB) on enzyme inhibition terminology
- PubChem from NCBI, Database of drugs and enzyme inhibitors
- BRENDA, Database of enzymes giving lists of known inhibitors for each entry
- Enzymes, Kinetics and Diagnostic Use, On-line lecture concentrating on medical applications of enzyme inhibitors: by Dr. Michael W. King of the IU School of Medicine
- BindingDB, a public database of measured protein-ligand binding affinities.
- Enzyme Inhibition Animated Exercise (tutorial + quizzes).


![{\displaystyle V={\frac {V_{max}[S]}{\alpha K_{m}+\alpha ^{\prime }[S]}}={\frac {(1/\alpha ^{\prime })V_{max}[S]}{(\alpha /\alpha ^{\prime })K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a8f0a9dda1d308de7f090f99c2833f944f11a09)
![{\displaystyle \alpha =1+{\frac {[I]}{K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57fcf54938a9784f9313437681b220079ff43ee5)
![{\displaystyle \alpha ^{\prime }=1+{\frac {[I]}{K_{i}^{\prime }}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/65bf16742482cae7b0743781f47c327ddcf537e3)
![{\displaystyle {\cfrac {V_{\max }}{1+{\cfrac {\ce {[I]}}{K_{i}}}}}={\cfrac {V_{\max }}{\cfrac {[{\ce {I}}]+K_{i}}{K_{i}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/974bf2132f8729fe17e42bcf5e6835fd9bf541fc)
![{\displaystyle {\cfrac {V_{\max }}{\cfrac {[{\ce {I}}]+K_{i}}{[{\ce {I}}]+K_{i}-[{\ce {I}}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea1e5957a1680cbbd38b9a6157e59859632c37ba)
![{\displaystyle {\cfrac {V_{\max }}{\cfrac {1}{1-{\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}}}=V_{\max }-V_{\max }{\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1dd17bc78dc831a088b059c70ea9b734c99f15a5)
![{\displaystyle {\cfrac {\ce {[S]}}{[{\ce {S}}]+K_{m}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb08dd139085a394e6e7370f47ebfa255f1ad685)
![{\displaystyle {\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ed50a1f7a5f2c52f406b52263916ab48b268e07)
![{\displaystyle V_{\max }-\Delta V_{\max }{\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dff424ec79284c3a1cea14f0f82b0eaace53c69)
![{\displaystyle V_{\max 1}-(V_{\max 1}-V_{\max 2}){\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3874623edd9524ba2741fe448927bf5cf0ab257)
![{\displaystyle V_{\max 1}-(V_{\max 1}-V_{\max 2}){\cfrac {\ce {[X]}}{[{\ce {X}}]+K_{x}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/306d44733a89308883053e3b8372a8cf9ce0239b)
![{\displaystyle K_{m1}-(K_{m1}-K_{m2}){\cfrac {\ce {[X]}}{[{\ce {X}}]+K_{x}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4e0de216e1e625bb803ee725bf85c9989a15f5)