Пеницилин
Пеницилини су група бета-лактамских антибиотика који се користе у лечењу инфекција изазваних бактеријама. На дејство пеницилина осетљиви су превасходно Грам-позитивни патогени, док је један број полусинтетских пеницилина ефикасан и против Грам-негативних бактерија. Природни пеницилини су производ метаболизма гљивица из рода Penicillium. Њихово антибактеријско дејство препознао је Александер Флеминг 1928. године, али су први пеницилини у широку клиничку примену ушли тек током и након завршетка Другог светског рата. И данас се широко употребљавају, али њихов терапијски значај полако опада, добрим делом услед растуће учесталости појаве резистентних сојева.[1]
Историја[уреди | уреди извор]
Откриће пеницилина[уреди | уреди извор]
Мада се откриће пеницилина конвенционално приписује Флемингу и описује као једна од највећих случајности у историји науке, лековити учинак појединих гљивица био је познат и веома старим културама где су биљке и поједине плесни коришћене у емпиријској терапији, односно најчешће за превијање рана у спречавању развитка инфекције.
Са развојем микробиологије почела је да се учвршћује и веза између појединих гљивица и њиховог антибактеријског учинка. Низ британских истраживача објавио је налазе по којима присуство плесни у бактеријским културама ефективно инхибира раст бактерија. Међу првима је био Џон Скот Бурдон-Сендерсон чији су налази из 1870. постали основа за даље истраживање Листера и Тиндала. Тиндал је 1875. пред Краљевским друштвом објавио налазе о бактерицидном учинку извесне врсте рода Penicillium, која је, по њему, чинила да бактерије пуцају.[2] Пастер је у Француској две године касније објавио сличне налазе о антибактеријском учинку гљивица из рода Penicillium на бациле антракса.[3]
У периоду након открића пеницилина посебно је у Француској дошло до изражаја препознавање ранијег рада Ернеста Дишена на потенцијалној терапијској примени споменутих плесни. Дишен је 1897. завршио докторску дисертацију која се бавила проучавањем еволутивне компетиције и антагонизма између бактерија и гљивица. Дишен је у њој описао бактерицидан учинак врсте Penicillium glaucum на E. coli in vitro, а затим и дао резултате in vivo испитивања антибактеријског учинка ове гљивице. Дишен је дао низу експерименталних животиња потенцијално смртоносну дозу културе бацила тифуса, а затим им је инокулисао непречишћену културу споменуте гљивице, што би доводило до излечења животиња. Дишен, међутим, није тврдио постојање специфичне антибактеријске супстанце коју продукује гљивица, већ је само забележио њен антагонизам према бактеријама.[3] У ово време, он је имао само 23 године и био је непознат у научним круговима што је допринело да Институт Пастер занемари његову тезу. Дишен је у последњем пасусу своје тезе назначио да додатно истраживање ове појаве може довести до открића других особина плесни од значаја за њихову профилактичку и терапијску примену, али ова истраживања никада није спровео јер је постао ангажован као војни лекар, да би 1904. задобио извесно плућно обољење (неки извори кажу да је реч о туберкулози), од последица кога је преминуо 1912, у 37. години живота.[4] Мада релевантан, Дишенов рад никада није предвидео постојање самих пеницилина, а како је касније и констатовано да природни пеницилини не показују активност против изазивача тифуса, остаје питање природе саме супстанце која је у Дишеновом раду довела до излечења замораца.

У септембру 1928. Флеминг је током уобичајеног лабораторијског рада уочио једну Петријеву шољу са културом стафилокока која је постала контаминирана плавичастозеленкастом плесни. Флеминг је уочио и забележио појаву зоне инхибиције раста бактерија у околини плесни, наводећи уочљиво светлије подручје у којем долази до лизе бактерија.[5] Флеминг је затим изоловао чисту културу гљивице која је идентификована као Penicillium notatum, а ова култура послужила је за прављење секундарних култура све до 1945. године, при чему су каснија упоредна тестирања америчких научника показала да од свих до тада изолованих плесни рода Penicillium, ова показује треће по јачини антибактеријско дејство.[5] Флеминг је даље претпоставио да гљива лучи извесну супстанцу која делује слично лизозиму (који је идентификовао шест година раније), и за коју је сковао назив пеницилин. Флеминг је постулирао да је та супстанца дифундовала кроз подлогу и да је она одговорна за антибактеријску активност гљивице.
О пореклу плесни која је контаминирала споменуту културу постоји више теорија, мада се чини највероватнијим да је спора ваздухом доспела из миколошке лабораторије која се налазила у подруму испод Флемингове лабораторије до отворене културе стафилокока.[5] Мада се само откриће може окарактерисати као случајност, Флеминг се нашао пред низом научних проблема. Он је препознао потенцијалне терапијске импликације пеницилина, мада је иницијално био заинтересованији за његову примену у справљању селективних подлога за изоловање бактерија као што је Haemophilus influenzae.[6] Важно је напоменути да Флеминг није одмах посматрао пеницилин као потенцијални системски антибактеријски агенс, јер је у његово време то био прилично далек концепт.[7][n 1] Он га је видео превасходно као антисептик. Први покушаји изоловања пеницилина нису били претерано успешни и обухватали су употребу филтрата течне културе, али су принос и чистоћа били на релативно ниском нивоу. Након испитивања на мишевима која су се првенствено бавила проценом токсичности пеницилина, Флеминг 1931. прекида даљи рад, убеђен да је пеницилин исувише нестабилан у организму да би био од терапијског значаја код људи. Ипак, 1934. године је смањеним интензитетом наставио истраживање, истовремено тражећи некога ко би адекватније пречистио филтрате које је употребљавао.[3] Са изузетком неколико раних покушаја примене као антисептика у превијању инфицираних рана, Флеминг није спроводио in vivo испитивања антимикробног учинка пеницилина.[5]
Рад на изоловању чистог пеницилина и прве примене[уреди | уреди извор]
У периоду непосредно након открића, Флеминг није предузимао значајније покушаје да in vivo покаже антимикробна својства пеницилина. Ово је значило да пун потенцијал пеницилина није одмах постао очигледан, па је и рад на изоловању његове чисте форме готово целу трећу деценију 20. века био веома успорен.
Каснија истраживања су показала да најранији записи о успешној клиничкој примени пеницилина датирају из 1930. и 1931. Сесил Џорџ Пејн, патолог који је у то време радио у болници у Шефилду, узгајао је културе гљивице коју је Флеминг изоловао, и накнадно добијао, користећи се сличним методама као и Флеминг, филтрате пеницилина мале чистоће. Први покушаји његове примене као антисептика у лечењу сикоза (вид бактеријског фоликулитиса) били су неуспешни, па је Пејн даље покушаје усмерио ка лечењу офталмије неонаторум код беба. Према преживелим записима, први случај излечења бактеријске инфекције помоћу пеницилина забележен је 25. новембра 1930. Пејн је успешно излечио још 2 бебе, и једну одраслу особу, док код петог пацијента терапија није била успешна. Пејн је ускоро напустио рад са пеницилином, великим делом због варијабилне ефикасности екстраката и уопштено малог интересовања за пеницилин у то време. Из истог разлога своје налазе никада није објавио.[8]
Крајем 1938. и почетком 1939. године на Универзитету у Оксфорду окупљен је тим научника чију су окосницу чинили Хауард Флори и Ернст Борис Чејн, а који је почео интензивно да ради на пречишћавању пеницилина и испитивању његовог системског дејства. Количине пеницилина који су успели да добију нису, међутим, биле довољне да произведу значајне резултате код људи. Ипак, Флори и Чејн са сарадницима успешно су показали да је пеницилин, примењен мишевима инфицираним стрептококама, ефикасан и нетоксичан системски антибактеријски агенс.[9] Публикација ових резултата у мају 1940. означила је омасовљење и интензивирање напора на изоловању потпуно чистог пеницилина, његовој масовној производњи и решавању структуре.[7]
Први пацијент који је успешно излечен применом пеницилина била је Ен Милер оболела од дисеминоване инфекције бета-хемолитичким стрептококом која је у то време била летална у огромном броју случајева. Њени лекари, Џон Бамстед и Орван Хес, 14. марта 1942. постали су први појединци који су забележили успешну примену пеницилина као системског антимикробног хемотерапеутика код људи.[10][11]
Масовна производња[уреди | уреди извор]
Иако су пионирски рад на изоловању пеницилина и његовој примени као антибиотика Флори и Чејн спровели у Уједињеном Краљевству, са разбуктавањем рата у Европи, тежиште истраживања могућности масовне производње пеницилина преместило се у САД. Норман Хитли, један од чланова оксфордског тима, и Хауард Флори су 1941. године отпутовали у Америку где су успешно развили први значајнији погон за производњу пеницилина у једној лабораторији у градићу Пеорија, у Илиноису. Производња је константно усавршавана у циљу повећања приноса и смањења трошкова добијања, па се тако напустила употреба плесни коју је првобитно изоловао Флеминг, јер је 1943. откривена друга, са повољнијим особинама. Осим у Пеорији, неколико других лабораторија радило је на производњи пеницилина, укључујући и фармацеутске куће Мерк и Фајзер, док је читав низ лабораторија без успеха покушавало да синтетски добије пеницилин. До 1944. припремљено је око 300 милијарди јединица пеницилина које су стављене на располагање америчкој војсци као део припрема за савезничко искрцавање на Нормандију.[12]

Пеницилин је играо значајну улогу у смањењу смртности међу рањеницима у Другом светском рату. Био је, међутим, веома ограничено доступан, а трајније постизање терапијских концентрација је захтевао учесталу примену због његовог кратког времена елиминације. Производња пеницилина није била довољна да подмири растуће потребе, па се установила пракса прикупљања урина пацијената на терапији; како се пеницилин у великој мери излучује у непромењеном облику, прикупљени урин се користио за његову изолацију и поновну примену.[13] Са завршетком рата, пеницилин је постепено постајао све доступнији, а у производњу се укључио низ фармацеутских компанија у Европи и другде, мада је по количини произведеног лека предњачио амерички Фајзер. Студије које су се бавиле усавршавањем поступка настављене су и током доброг дела 50-их.
Дороти Хоџкин, зачетница рендгенске кристалографије, је 1945. решила структуру пеницилина, што ће касније омогућити развој полусинтетских деривата. Исте године је Флемингу, Флорију и Чејну, за откриће пеницилина и његовог лековитог ефекта код различитих инфективних болести[14], додељена Нобелова награда.
Структура, хемијске особине и SAR[уреди | уреди извор]
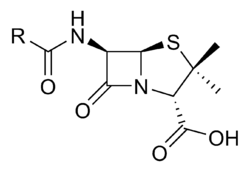
Сви пеницилини, било природног или полусинтетског порекла, деле заједничку структуру која се често назива пеницилинским језгром.[15] Костур пеницилинског језгра — пенама — чини бициклични систем који се може посматрати као спрегнут систем два хетероциклуса: азетидинона и тиазолидина. Пеницилини се често посматрају и као N-ацил деривати 6-аминопенициланске киселине (6-APA). Структура бочног ланца у великој мери одређује стабилност и особине пеницилина. 6-APA садржи три стереогена центра који одговарају положајима 2, 5 и 6 и за које је одређена апсолутна конфигурација. Тако се сви пеницилини хемијски могу означавати као деривати (2S,5R,6R)-3,3-диметил-6-амино-7-оксо-4-тиа-1-азабицикло[3.2.0]хептан-2-карбоксилне киселине. У употреби је и нешто другачији систем нумерације, али су системски називи често прегломазни, па се примарно користе генерички. Очување назначене стереохемије представља услов за дејство.
SAR студијама додатно је утврђено да је за дејство неопходно присуство слободне карбоксилне групе у положају 2 (естарске пролек форме не показују активност док не дође до хидролизе), амида у положају 6, као и постојање описаног бицикличног система, мада су могуће изостерне замене сумпора, али су овакве модификације ретке.[16]
Најнестабилнији део структуре пеницилина је ß-лактамски прстен. Овај амид се налази под великим угаоним и торзионим напоном јер је у четворочланом циклусу, а додатно је и карбонилни угљеник, као електрон дефицитаран, активиран за напад нуклеофила. Ово је и последица немогућности учествовања слободног електронског пара азота у резонантној стабилизацији структуре, јер би резултујући углови веза били неодрживи.[16] Водени раствори су, при собној температури, стабилни али у алкалној средини као и у присуству јаких нуклеофила (алкохола, амина) веома лако долази до отварања прстена. У алкалној средини настаје пеницилоинска киселина (односно њени ацил деривати), која може подлећи даљој метаболичкој декарбоксилацији. Ови производи не показују антимикробну активност. Са алкохолима или аминима настају одговарајући естри/амиди. Ове реакције су од значаја за објашњење настанка преосетљивости на пеницилине. Активираност β-лактама код пеницилина за нуклеофилни напад представља и основ осетљивости на β-лактамазе које реагују као јаки нуклеофили. Увођење резидуа које стерно ометају приступ ензиму повећава стабилност таквих пеницилина на дејство бета-лактамаза.
Један број пеницилина нестабилан је и у киселој средини у којој долази до деградације пеницилина до пенициламина и пеналдинске киселине (односно њених ацил деривата). Ови производи немају антимикробну активност, мада пенициламин има примену као имуносупресив у лечењу реуматоидног артритиса. Повећање стабилности у киселој средини може се постићи увођењем додатних базних центара или електрон-привлачећих бочних супституената који смањују електронску густину у лактамском прстену. Овакве модификације дозвољавају per os примену пеницилина. Бензилпеницилин, и други пеницилини нестабилни у киселој средини, при pH која одговара желудачној средини имају полуживот од тек неколико минута. Амидска група у положају 6 такође може подлећи хидролизи, али ова реакција, са изузетком метаболичке трансформације појединих пеницилина, нема значаја при физиолошком условима, а чини се ни значаја у развитку резистенције.[15]
Деградационе реакције у in vitro условима могу се успорити пуферовањем препарата и њиховим чувањем на нижим температурама. Чак и мале концентрације металних јона катализују разградњу пеницилина па се бочице за чување или спремање препарата за парентералну примену израђују са поклопцима од инертне пластике.
Липофилност бочне резидуе одређује и степен везивања за протеине плазме, при чему пеницилини са липофилнијим бочним остацима показују већи афинитет према протеинима плазме. Ипак, удео везаног облика лека не утиче на време елиминације због постојања транспортних механизама који активно екскретују пеницилин и евентуалне метаболите у тубуле бубрега. Утолико је време елиминације превасходно одређено радом бубрега.[15]
Поједини пеницилини имају способност да инактивирају аминогликозиде, реагујући као ацилујући агенси са њиховим екваторијалним хидроксилним или амино групама. Мада је постојање овог вида интеракције јасно показано у in vitro условима[17], значајнији утицај на успешност терапијских режима који обухватају истовремену примену пеницилина и аминогликозида може се испољити само код пацијената са угроженом функцијом бубрега.[18][19] Овакве формулације које се користе у лечењу тежих инфекција изазваних Грам-негативним бактеријама садрже најчешће неки уреидопеницилин и тобрамицин ради постизања синергистичког ефекта два лека. Новија истраживања показују да се in vivo инактивација тобрамицина, истовремено примењеног са пиперацилином, не одвија на значајном нивоу ни код пацијената са оштећењима бубрега, односно да је ова интеракција занемарљива.[20]
Механизам дејства[уреди | уреди извор]
Пеницилини спадају у групу антибиотика који ремете синтезу ћелијског зида бактерије. Ћелијски зид је одговоран за постојаност бактеријске ћелије у различитим условима средине, а нарочито је значајан у спречавању прекомерног бубрења бактерије у хипотоничној средини. Ремећење интегритета ћелијског зида бактерију чини подложну прекомерном уласку воде, а коначан ефекат јесте, уз нагомилавање прекурсора пептидогликана, бактерицидан. Бактерија пуца, или подлеже лизи, а на дејство пеницилина најосетљивија је у фази деобе.[21]
Пеницилини се везују за групу бактеријских протеина карактеристичних по свом афинитету према пеницилину који се због тога називају и пеницилин-везујући протеини — ПВП (енгл. Penicillin-binding protein — PBP). Пеницилин-везујући протеини лоцирани су са спољашње стране плазма мембране бактерија и обављају различите ензимске улоге, најчешће понашајући се као транспептидазе, карбоксипептидазе или ендопептидазе. Идентификован је низ ПВП, при чему постоје значајне варијације у њиховој структури између појединих бактеријских врста, чиме се објашњава и различита ефикасност пеницилина против различитих бактерија.[15]
Од фундаменталног значаја за дејство пеницилина је иреверзибилна инхибиција транспептидаза. Транспептидазе, током нормалног процеса биосинтезе ћелијског зида, катализују уклањање једног остатка D-аланина из пептида везаног за N-ацетилмураминску киселину што омогућава реакцију преосталог терминалног D-аланина са пентаглицинским остатком оближњег пептида. На овај начин се формирају унакрсне пептидне везе неопходне за стабилност ћелијског зида.
Активно место ових транспептидаза у потпуности је прилагођено ацилованом D-Ala-D-Ala дипептиду. Серинска резидуа ензима реагује као нуклеофил, раскида пептидну везу између два аланина, при чему се један ослобађа а други остаје у активном месту и реагује са пентаглицинским остатком другог пептида. Пеницилини деле структурну а вероватно и конформациону сличност са овим дипептидом, што им омогућава да интерагују са активним местом. Серинска резидуа као нуклеофил реагује са бета-лактамом, при чему је он, као последица цикличне структуре, далеко реактивнији од амидне везе пептидогликанских прекурсора. Везани пеницилин, међутим, не подлеже даље раскидању својих веза, чиме настала структура остаје интактна. Овиме се пеницилин трајно везује за ензим, јер је приступ пентаглицинском ланцу стерно спречен, а вода, као широко доступан а стерно компактан молекул, није довољно јак нуклеофил да раскине формирану естарску везу. Иреверзибилна инхибиција транспептидаза остварује два ефекта: резултујући ћелијски зид је нестабилан због изостанка унакрсних веза а повећана концентрација пептидогликанских прекурсора стимулише синтезу бактеријских аутолизина. Комбинација ова два фактора доводи до одумирања бактерије.[15][16]
Овакво објашњење механизма дејства пеницилина такође објашњава и њихову селективну токсичност. Наиме, будући да је претпоставка да конформација пеницилина одговара активним местима транспептидаза које катализују реакције D-аминокиселина, јасно је да пеницилин неће реаговати са транспептидазама сисара, које су прилагођене стандардним (L-) аминокиселинама.[16]
Постоји, међутим, и алтернативна, мање прихваћена хипотеза о механизму дејства пеницилина. Синтезом и одређивањем антибактеријске ефикасности 6α-метилпеницилина дошло се до открића да ово једињење, мада структурно сличније D-Ala-D-Ala дипептиду, показује знатно слабије антибактеријско дејство од самих природних пеницилина и њихових деривата. На основу ових налаза, формулисана је претпоставка да пеницилини не конкуришу заправо за активно место транспептидаза, већ да се везују, реагујући са нуклеофилом, за неки близак домен на протеину и да стерно (по „кишобран“ механизму) спречавају приступ природног супстрата ензиму.[16]
Пеницилини се везују за читав спектар ПВП које једна бактерија експримира. Међутим, везивање тек за неке од ових протеина узрокује смрт бактерије, док везивање за друге у мањој или већој мери мења њену функционалност или морфологију. Сваки пеницилин има сопствени аранжман афинитета према различитим ПВП којим је и одређена његова ефикасност против дате бактерије. У неким случајевима се тек веома мала фракција лека везује за ПВП чија инхибиција даје бактерицидан резултат.[15]
Биосинтеза пеницилина[уреди | уреди извор]

Пеницилин је продукт метаболизма малог броја филаментозних гљива, међу којима су најпознатије Penicillium chrysogenum и Aspergillus (Emericella) nidulans.
У синтези пеницилина учествује три ензима - ACVS (δ-(L-α-аминоадипил)-L-цистеинил-D-валин синтетаза), IPNS (изопеницилин Н синтетаза) и IAT (ацил-коензим А:изопеницилин Н ацилтрансфераза). ACVS катализује синтезу ACV трипептида од почетних метаболита — L-α-аминоадипске киселине, L-цистеина и D-валина. IPNS катализује стварање прстена унутар ACV трипептида чиме као продукт настаје изопеницилин Н. Ове реакције се одвијају у цитоплазми. Трећи ензим (IAT) смештен је у микротелашцима где катализује пренос ацил групе на изопеницилин Н.
Ензими синтезе пеницилина су продукти гена acvA (pcbAB), ipnA (pcbC) и aatA (penDE), који су физички организовани у генске кластере на истом хромозому. Код различитих врста гљива овај генски кластер се налази на различитом хромозому.
Иако продукција пеницилина као секундарног метаболита није од животног значаја за преживљавање гљива, одређени еколошки фактори (фактори станишта) утичу на регулацију експресије поменутих гена, нпр. киселост подлоге и количина хранљивих материја.
Производња[уреди | уреди извор]
Рад на развитку ефикасног начина производње великих количина пеницилина уједно је био и прекретница у развитку индустријских техника производње антибиотика. Ово је у доброј мери заслуга Флорија и Хитлија, мада су различите студије о побољшању приноса пеницилина и условима у ферментационим смешама спроводили и други научници током 50-их година 20. века.
Процес производње обухвата следеће. У велике резервоаре стављају се медијуми раста (често се назива и подлога), који су суштински супстанце које фаворизују раст изабране плесни. У случају пеницилина то је најчешће Penicillium notatum. Услови у овим резервоарима се пажљиво контролишу: за успешно завршен процес као и повољан принос потребно је константно одржавати оптималну температуру, концентрације хранљивих састојака и кисеоника, као и pH. Како су антибиотици секундарни метаболити, пажљиво регулисање величине популације је такође од пресудног значаја. Након завршене ферментације, приступа се изоловању пеницилина из раствора, његовом пречишћавању, и накнадној, уколико је то потребно, хемијској модификацији.
Џон Шинан је 50-их година потпуном синтезом успешно добио поједине природне пеницилине и њихове аналоге. Међутим, добијање пеницилина потпуном синтезом, између осталог и због специфичне стереохемије молекула, није практично нити економски оправдано, па се не користи у производњи.
Полусинтетски пеницилини добијају се дејством одговарајућих киселинских халогенида, анхидрида или сличних реагенаса, на 6-аминопенициланску киселину. Мада се 6-АПА може добити ферментацијом, приноси нису значајни а добијање компликовано, па се као полазна сировина користи бензилпеницилин, ређе феноксиметилпеницилин, контролишући услове у ферментационој смеши тако да се тај пеницилин добије у великом вишку. На бензилпеницилин се делује пеницилин-амидазама бактеријског порекла које врше његову селективну хидролизу до 6-АПА. Овај процес је 1959. прва развила и патентирала фармацеутска компанија Бичам уз употребу деацилаза добијених од бактерије Streptomyces lavendulae. Од тада је откривен низ других деацилаза.[7]
Природни пеницилини[уреди | уреди извор]
Природни пеницилини производ су микроорганизама и добијају се ферментацијом. У природне пенцилине убрајају се пеницилин G, V, F, K и X, али значајнију клиничку примену имају само прва два представника. Као последица слабог пролажења кроз њихов ћелијски зид, за природне пеницилине се сматра да нису ефикасни против Грам-негативних бактерија.
Бензилпеницилин (пеницилин G)[уреди | уреди извор]


Бензилпеницилин је први пеницилин који је уведен у терапију. По увођењу, показивао је до тада незабележено добре резултате у борби против Грам-позитивних бактерија, посебно против стафилокока, стрептокока, али и Грам-негативних најсерија. Нестабилан је у киселој средини желуца у којој обилно деградира и има полуживот од тек неколико минута. Примењен перорално, има биорасположивост од тек 15%, па се примењује искључиво парентерално. За интравенску примену користе се калијумова или натријумова со. Бензилипеницилин се, међутим, реналним путем из организма излучује изузетно брзо, са временом полуживота од око 45 минута. Приступ продужењу дејства иницијално је подразумевао истовремену оралну примену пробеницида, који смањује ефикасност тубуларне екскреције пеницилина конкуришући за иста места овог система активног транспорта.[22] Слично је могуће применити и јако велике дозе пеницилина, јер је лек готово потпуно нетоксичан.
Ипак, за постизање терапијских концентрација пеницилина у плазми на дужи временски период користе се веома нерастворне соли бензилпеницилина са органским базама: прокаин-бензилпеницилин и бензатин-бензилпеницилин. Ове соли представљају депо облике бензилпеницилина — по интрамускуларној примени постепено се ослобађају из ткива и прелазе у системску циркулацију. Применом прокаин-бензилпеницилина смањује се и бол приликом апликације због анестетичког дејства прокаина, а инхибиторне концентрације у крви одржавају се и 24 часа након примене.[22] Бензатин-бензилпеницилин се ослобађа далеко спорије, али су и одговарајуће концентрације у плазми ниже; бензилпеницилин је могуће детектовати у плазми и 12 недеља након примене само једне дозе од милион и. ј. бензатин-бензилпеницилина.[23] Терапијске дозе се пак одржавају само 2-4 недеље.
Око једна трећина бензилпеницилина која доспе у системску циркулацију подлеже реакцијама метаболичке биотрансформације које обухватају различите хидролитичке и оксидационе реакције. Метаболити су инактивни, са изузетком p-хидроксибензилпеницилина (производ ароматичне оксидације), који испољава антимикробну активност.[23]
Појавом резистентних сојева, клинички значај бензилпеницилина почео је да се смањује. Веома је осетљив на дејство бета-лактамаза, па је често неопходно урадити испитивање осетљивости изоловане бактерије. Поједини сојеви су умерено толерантни на бензилпеницилин, и код њих се минимална инхибиторна концентрација (МИК) повећава са уобичајених 0,02 mg/l на 0,1-1 mg/l, али је жељени терапијски ефекат могуће постићи повећањем доза.[22] Сојеви са већом МИК од назначене (1 mg/l) типично не одговарају на терапију бензилпеницилином.
Иако је учесталост изоловања резистентних сојева у порасту, бензилпеницилин се и данас, због своје приступачности и добре ефикасности, сматра леком избора за умерено-тешке инфекције доњих и горњих дисајних путева као и код урогениталних инфекција. Изузетак су инфекције које изазивају Staphylococcus aureus и Staphylococcus epidermidis који су готово увек резистентни на бензилпеницилин.
Индикације за примену бензилпеницилина (као прокаин-бензилпеницилина) обухватају:[15][24]
- Инфекције изазване β-хемолитичким стрептококама групе А: тонзилитис, фарингитис, шарлах, упала средњег уха, целулитис, синуситис;
- Стрептококне инфекције код новорођенчета: пнеумонија, менингитис, сепса;
- Сифилис
- Менингитис (N. meningitidis)
- Некомпликовани случајеви гонореје
- Лајмска болест
- Стрептококни ендокардитис
- Профилакса у предоперативном току
- Допунска терапија код антракса
Примена бензатин-бензилпеницилина индикована је у случајевима када је потребно дужи период одржавати ниже концентрације лека у организму. Његова терапијска примена је веома ограничена. Користи се у профилакси реуматоидне грознице, и код рано дијагностикованог сифилиса.
Феноксиметилпеницилин (пеницилин V)[уреди | уреди извор]

Феноксиметилпеницилин је стабилнији од бензилпеницилина у желудачној средини па се даје per os. Повећана стабилност у киселој средини објашњава се негативним индуктивним ефектом фенокси групе која доприноси смањењу електронске густине у лактамском прстену. Око 60-70% орално примењеног лека бива апсорбовано у непромењеном облику, а већи део се везује за протеине плазме. Један део лека који доспе у системску циркулацију подлеже метаболичким реакцијама оксидације и хидролизе, док се други део излучује у непромењеном облику.[23] Време елиминације је нешто дуже него код пеницилина G, али феноксиметилпеницилин показује слабију антибактеријску активност.[15]
Пеницилин V има приближно исти спектар дејства као и пеницилин G, а подједнако је и осетљив на дејство бета-лактамаза. Феноксиметилпеницилин се не примењује код тешких акутних инфекција, без обзира на подложност бактерије, јер су степен апсорпције и концентрације у плазми веома варијабилне, а терапијске концентрације се у ткивима задржавају релативно кратко. У том случају је могуће увести терапију феноксиметилпеницилином након започете терапије бензилпеницилином која је довела до задовољавајућег ефекта на инфекцију. Не даје се код гонококних или менингококних инфекција. Индикације за примену феноксиметилпеницилина обухватају:[24]
- Инфекције изазване стрептококом групе А
- Тонзилитис
- Фарингитис
- Упала средњег уха (акутна)
- Кожне инфекције (целулитис, црвени ветар)
- Профилакса реуматоидне грознице
- Профилакса пнеумококних инфекција
Пеницилин V се сматра леком избора код некомпликованих стрептококних инфекција ждрела, мада није извесно да ли је антибиотска терапија у таквим случајевима уопште прикладна. У случају примене, терапија мора трајати 10 дана.[22]
Резистентност[уреди | уреди извор]
Први случајеви резистенције на пеницилине забележени су 1940. и 1944.[15] Димензије ове појаве у почетку нису биле предмет забринутости, али је временом проблем резистентних сојева постао веома значајан, а учесталост њихове појаве све већа. Примера ради, по увођењу у терапију, бензилпеницилин је готово универзално био ефикасан против бактерије Staphylococcus aureus, док данас чак 95% изолованих сојева показује резистенцију на овај антибиотик.
Механизми развитка резистенције су бројни, али је најучесталији узрок стечена способност бактерија да луче ензиме — бета-лактамазе. Изолован је велики број ових ензима са различитим афинитетом за различите бета-лактамске антибиотике, па се по овом критеријуму бета-лактамазе са високим афинитетом према пеницилинима називају и пеницилазе. Бета-лактамазе структурно су сличе мембранским транспептидазама; то су протеазе са серинском резидуом која реагује као нуклеофил, отвара бета-лактамски прстен пеницилина али уз способност ослобађања насталих пеницилоинских киселина (које не показују антимикробну активност). Ово значи да само једна молекула ензима може да инактивира велики број молекула пеницилина, и то брзином и до 1000 молекула у секунди, код веома резистентних сојева. Резистентне Грам-позитивне бактерије константно синтетишу овај ензим и ослобађају га у спољну средину, кроз коју он дифундује, разарајући пеницилине са којима дође у контакт. За разлику од овог механизма, који условљава релативно мале концентрације ензима у околини бактерије, код Грам-негативних бактерија бета-лактамазе се ослобађају у периплазматски простор, између цитоплазме и ћелијског зида бактерије, у којем се задржавају у великој концентрацији јер је спољашња мембрана за њих непропустљива. И један и други механизам представљају препреку за пеницилине да у интактном облику стигну до места дејства — транспептидаза на спољашњој страни плазма мембране.[16] Овај вид резистенције је најчешће екстрахромозомског порекла, и везује се за присуство R плазмида. Ово за последицу има и лако ширење резистенције кроз бактеријску популацију процесима трансдукције и конјугације. Продукција бета-лактамаза је углавном индуцибилна, док мали број бактерија, превасходно анаероба, базично продукује бета-лактамазе.[21]
Резистенција се може јавити и као последица модификације структуре пеницилин-везујућих протеина. Структурне промене ПВП су углавном последица спонтаних мутација на хромозомским локусима који детерминишу њихову грађу. Овакве промене узрокују смањен афинитет пеницилина за дати ПВП што за последицу може имати, уколико се ради о ПВП који је повезан са леталним ефектима, значајно смањену ефикасност антибиотика. Тако се код метицилин-резистентних сојева S. aureus (МРСА) јављају промене у структури ПВП које условљавају резистентност на метицилин, а који није осетљив на бета-лактамазе. Међутим, док бета-лактамазе могу узроковати резистентност на читав спектар антибиотика, промене у грађи ПВП углавном не утичу на ефикасност великог броја структура.[16]
Додатно, промене у пермеабилности ћелијског зида могу такође бити узрок резистенције јер не дозвољавају продор пеницилина до ћелијске мембране. Смањена количина пеницилина доступног за инхибицију транспептидаза може бити и последица присуства посебних механизама који активно транспортују пеницилин кроз ћелијски зид у спољашњу средину. Комбинација наведених фактора може дати бактерију која је потпуно отпорна на дејство свих пеницилина.
Даљи развој пеницилина[уреди | уреди извор]
Иако сензација у почетку, неке од реалних мана првобитног пеницилина убрзо су постале очигледне. Релативно узак спектар дејства, као и слаба активност оралног облика пеницилина — феноксиметилпеницилина — усмерили су истраживаче ка проширењу спектра као и оралне биорасположивости пеницилина.
Рад на развитку полусинтетских пеницилина омогућен је открићем структуре пеницилинског језгра, као и различитим студијама које су се бавиле оптимизацијом услова у ферментационим смешама у циљу повећања приноса жељеног пеницилина. Убрзо се дошло до закључка да је варирањем бочног остатка могуће добити пеницилине са повољнијим особинама од природних. Први полусинтетски пеницилин који је ушао у терапијску примену био је фенетицилин, близак структурни сродник феноксиметилпеницилина, који је убрзо праћен пропицилином. Међутим, ова два пеницилина нису показивали значајно супериорније особине од пеницилина V, па њихов клинички значај никада није био велики.
Први значајан напредак одиграо се синтезом и препознавањем потенцијала аминопеницилина. Ампицилин је синтетисан 1961. и први је ушао у употребу. Стабилан је при пероралној примени, а спектар дејства му је проширен према појединим Грам-негативним бактеријама. Амоксицилин је уведен у терапију готово деценију касније; структурно је веома сличан ампицилину, са додатком фенолне групе, али је по особинама значајно повољнији. Има исти спектар дејства, али не изазива нежељене ефекте по гастроинтестинални тракт, има за око 30-35% бољу биорасположивост (и до 90% дозе бива апсорбовано) и нешто дуже време елиминације. Ово су и данас терапијски значајни пеницилини.
Паралелно са синтезом аминопеницилина, текла је и синтеза пеницилина за које је показано да су резистентни на дејство бета-лактамаза. Метицилин је синтетисан 1960. године, а први изоксазол пеницилини (оксацилин и клоксацилин) 1962, док су диклоксацилин и флуклоксацилин синтетисани неколико година касније. Метицилин се примењивао парентерално код инфекција сојевима који луче бета-лактамазу, али су га накнадно заменили флуклоксацилин и диклоксацилин који се, поред отпорности на β-лактамазу, могу примењивати и перорално. Пеницилини из ове групе користе осетљивост бета-лактамаза на бочне стерне сметње и тако спречавају приступ ензиму, онемогућавајући инактивацију лека.[7]
Карбеницилин био је први пеницилин ефикасан против бактерије Pseudomonas aeruginosa, мада су његови резултати у борби против овог патогена били варијабилни и често недовољни. Уведен је употребу 1967. године. Каснијом синтезом уреидопеницилина (азлоцилин, мезлоцилин), пиперацилина и тикарцилина (као наследника карбеницилина), знатно је проширен број пеницилина ефикасних против Грам-негативних изазивача инфекција. Ови терапеутици имају поларне бочне резидуе које условљавају проширен спектар, и примењују се искључиво парентерално.[7]
Синтезом тикарцилина и пиперацилина, рад на даљем развитку пеницилина изгубио је на интензитету. Побољшање терапеутских могућности ових лекова исцрпљено је, а истраживање цефалоспорина и карбапенема добијало је на значају знатно већим темпом, добрим делом и захваљујући сазнањима стеченим у раду са пеницилинима.
Полусинтетски пеницилини[уреди | уреди извор]
Варијацијама у структури бочног ланца — ацил супституента пеницилинског језгра — могуће је постићи различите промене у особинама пеницилина — спектру њиховог дејства, фармакокинетичким параметрима и осетљивости на дејство бета-лактамаза. Добијен је низ полусинтетских пеницилина, али значајнију улогу у клиничком окружењу има око десетак представника. Доле је дат непотпун списак полусинтетских пеницилина, груписаних по извесним заједничким особинама[n 2].
Аминопеницилини[уреди | уреди извор]
Ово су пеницилини проширеног спектра, пригодни за per os примену, али осетљиви на дејство пеницилаза. Растворне соли могу се примењивати и парентерално, код тежих инфекција.
- Ампицилин
- Пролек форме ампицилина, развијене у циљу побољшања биорасположивости:
- Амоксицилин
- Епицилин
Пеницилини са инхибиторима бета-лактамазе[уреди | уреди извор]
Са појавом сојева који луче бета-лактамазе, терапијска вредност појединих пеницилина знатно је смањена јер више нису показивали добре резултате против интринсички подложних бактерија. Зато су развијене формулације које комбинују пеницилин са инхибитором бета-лактамазе — структуром која се која се компетитивно везује за овај ензим и значајно смањује удео пеницилина који бива инактивиран пре него што доспе до места деловања. Ове формулације су ефикасне у терапији јер дозвољавају испољавање свих позитивних особина пеницилина, премошћавајући стечену резистентност бактерије:
- Амоксицилин + клавуланска киселина
- Ампицилин + сулбактам
- Тикарцилин + клавуланска киселина
- Пиперацилин + тазобактам
Бета-лактамаза резистентни пеницилини уског спектра[уреди | уреди извор]
Ови пеницилини поседују специфичну структуру која стерно онемогућава приступ пеницилазама бета-лактамском прстену, тако штитећи лек од инактивације. Метицилин данас није од терапијског значаја, а и друге представнике ове групе полако замењују цефалоспорини.
- Метицилин (само парентерално)
- Изоксазол пеницилини — стабилнији су у киселој средини па се могу примењивати и перорално, обилно се везују за протеине плазме:
- Темоцилин (само против Грам-негативних бактерија)
Пеницилини ширег спектра[уреди | уреди извор]
Ово су парентерални пеницилини са проширеним спектром ка Грам-негативним бактеријама. Осетљиви су на дејство бета-лактамаза.
- Карбеницилин
- Кариндацилин (пролек карбеницилина)
- Тикарцилин
- Уреидопеницилини
Нежељени ефекти[уреди | уреди извор]
Пеницилини су, уопштено говорећи, супстанце веома ниске токсичности, и сматрају се, осим код преосетљивих појединаца, једним од безбеднијих доступних антибиотика.[22]
Ипак, њиховом применом, као и применом било ког другог лека, могућа је појава нежељених ефеката. Орално примењени пеницилини проширеног спектра могу довести до благих поремећаја у нормалној флори црева, и последичне дијареје; могу се јавити и мучнина или повраћање али су сва ова стања самоограничавајућа и нестају убрзо након прекида терапије. Забележена је и појава колитиса као последица антибиотске терапије оралним пеницилинима, али је ово изузетно ретка компликација.[24] Примена аминопеницилина може довести и до поремећаја у флори ждрела или вагине, што у неким случајевима погодује развитку гљивичне суперинфекције, па се код мањег броја пацијената на терапији може јавити кандидијаза.[22]
Код примене јако великих доза пеницилина G, нарочито код пацијената са смањеном бубрежном функцијом, постоји ризик од појаве енцефалопатије. Овакав токсичан ефекат пеницилина веома је редак при стандардним терапијским дозама. Изоксазолпеницилини могу испољавати извесне хепатотоксичне и нефротоксичне ефекте.
Специфични пеницилини могу испољавати и додатне нежељене ефекте, али је генерално, поред наведеног, описана и појава (са малом учесталости) интерстицијалног нефритиса и хематолошких поремећаја (леукопеније, посебно код ампицилина и флуклоксацилина, хемолитичка анемија, тромбоцитопенија, поремећаји коагулације).[22][24]
Преосетљивост[уреди | уреди извор]
Преосетљивост на пеницилине јавља се код 1-10% пацијената.[24] Анафилактички шок, као најозбиљнија реакција преосетљивости, је далеко мање учестао и јавља се тек код 1-5 пацијената на 10.000 оних којима је терапија прописана (0,05%).[22][24] Анифалакса је потенцијално летална па се високе дозе парентерално примењиваног пеницилина морају давати само у амбулантним или клиничким условима, јер се пацијенту хитно морају применити адреналин и осигурати проходност дисајних путева у случају појаве анафилактичке реакције. Атопичари (појединци са историјом преосетљивости на друге агенсе — полен, храну...) имају већи ризик за развитка оваквих реакција. Предвиђање реакција преосетљивости на пеницилине је веома тешко, и историја ранијих реакција представља најпоузданији параметар, мада постоје реагенси за извођење кожних проба.
Реакције касне преосетљивости животно не угрожавају пацијента на терапији, али су индикативне и могу довести до додатне сензибилизације организма и интензивнијих реакција у будућности. Огледају се у појави еритема, повишене температуре, болова у зглобовима и осипа по различитим деловима тела. Осипи могу бити различитог карактера а учесталији су код примене полусинтетских пеницилина, нарочито ампицилина и амоксицилина.[24] Појава осипа више од 72 часа након примене пеницилина може да указује да осип није последица преосетљивости, па историја појаве оваквих осипа није нужно контраиндикација за будућу примену пеницилина, али је додатан обзир неопходан.
Сами пеницилини су мали молекули и нису имуногени, односно представљају хаптене. Међутим, у реакцији са нуклеофилним групама протеина домаћина, пеницилин и дати протеин граде антиген који може изазвати реакцију имунског система. Алтернативно, у самој ферментационој смеши може доћи до реакције пеницилина и присутних протеина, а могуће је и повезивање самих пеницилина уз грађење полимерних нечистоћа велике молекулске масе које такође представљају алергене. По првом излагању долази до сензибилизације организма, док поновљена излагања доводе до интензивних реакција имунског система посредованих IgE антителима. Присуство полимерних нечистоћа чешће је у концентрованим препаратима, па се формулације за парентералну примену морају чувати на хладном, а реконституисани прашкови се морају примењивати без одлагања и не смеју чувати за накнадну примену.[15]
Код 90% пацијената који болују од инфективне мононуклеозе јавља се појава осипа као реакција на примену полусинтетских пеницилина, нарочито амоксицилина. Слично се дешава и код инфекција цитомегаловирусима. Механизам појаве ових реакција није познат.[22]
Сматра се, на основу низа студија, да је 5-10% појединаца алергичних на пеницилине унакрсно преосетљиво и на цефалоспорине[25], али постоје студије које тврде да је учесталост алергијских реакција на цефалоспорине код пацијената са историјом преосетљивости на пеницилине тек незнатно већа у односу на целокупну популацију.[26] Сматра се да су овакве унакрсне реакције последица сличности у језгру структуре свих бета-лактама. Због озбиљности потенцијалних нежељених реакција, код пацијената са историјом реакција преосетљивости на пеницилине за које се сумња да су посредоване IgE антителима, као и код пацијената код којих је кожним пробама утврђена преосетљивост на неки пеницилински реагенс, примена цефалоспорина се не саветује.[27] Међутим, велики део пацијената са алергијом на пеницилине није алергично и на друге бета-лактаме, па уколико су доступни специфични реагенси за кожне пробе, нпр. цефалоспорински, а резултати тестирања негативни, примена других бета-лактама потпуно је оправдана јер је код таквих пацијената ризик од развитка тешких реакција преосетљивости минималан.[28] Новија истраживања појединих аутора, пак, тврде да тај ризик готово и не постоји приликом примене цефалоспорина друге или каснијих генерација, чак ни код оних алергичних на пеницилине.[29][30] Наиме, резултати новијих испитивања показују да је унакрсна реактивност пре последица сличности у структурама бочних ланаца пеницилина и цефалоспорина прве генерације, него у структури бета-лактамског језгра ових антибиотика.[31] Несигурности доприноси чињеница да антигенске детерминанте цефалоспорина нису утврђене.
Види још[уреди | уреди извор]
Напомене[уреди | уреди извор]
- ^ Све до касних 30-их година 20. века, једини познати системски хемотерапеутик био је арсфенамин.
- ^ Дата подела не одговара ATC класификацији
Референце[уреди | уреди извор]
- ^ Mandel GL, Bannett JE, Dolin R, ур. (2000). Principles and Practise of Infectious Diseases (5 изд.). Philadelphia, PA: Churchill Livingstone. doi:10.1016/S1473-3099(10)70089-X. ISBN 044307593X.
- ^ „Douglas Allchin: Penicillin and Chance; SHiPS Resource Center”. Архивирано из оригинала 28. 05. 2009. г. Приступљено 20. 07. 2008.
- ^ а б в Brown, Kevin. Penicillin Man — Alexander Fleming and the Antibiotic Revolution. Sutton Publishing Ltd. ISBN 978-0-7509-3152-6.
- ^ François Devars: Ernest Duchesne, un chercheur longtemps oublié; SFHAD, 2003. Архивирано на сајту Wayback Machine (19. март 2006), Приступљено 23. 4. 2013.
- ^ а б в г Hare, Ronald (1982). „New light on the history of penicillin”. Medical History. 26 (1): 1—24. PMC 1139110
 . Приступљено 30. 7. 2008.
. Приступљено 30. 7. 2008.
- ^ Fleming, A. (1929). „On the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzæ”. British Journal of Experimental Pathology. 10 (31): 226—236.
- ^ а б в г д Rolinson, George N. (1998). „Forty years of beta-lactam research”. Journal of Antimicrobial Chemotherapy. 41 (6): 589—603. PMID 9687097. Приступљено 30. 7. 2008.
- ^ Wainwright, Milton; Swan, Harold T. (1986). „C.G. Paine and the earliest surviving clinical records of penicillin therapy”. Medical History. 30 (1): 42—56. PMC 1139580
 . Приступљено 30. 7. 2008.
. Приступљено 30. 7. 2008.
- ^ Chain, E., Florey, H. W., Gardener, A. D., Heatley, N. G., Jennings, M. A., Orr-Ewing, J. et al. (1940). „Penicillin as a chemotherapeutic agent”. Lancet ii: 226—228.
- ^ Saxon, W. (9. јун 1999). „Anne Miller, 90, first patient who was saved by penicillin”. The New York Times. Архивирано из оригинала 29. 05. 2012. г. Приступљено 30. 07. 2008.
- ^ Krauss K, editor (1999). „Yale-New Haven Hospital Annual Report” (PDF). New Haven: Yale-New Haven Hospital. Архивирано из оригинала (PDF) 20. 02. 2006. г. Приступљено 30. 07. 2008.
- ^ Mailer, John S., Jr.; Mason, Barbara. „Penicillin: Medicine's Wartime Wonder Drug and Its Production at Peoria, Illinois”. lib.niu.edu. Архивирано из оригинала 03. 04. 2007. г. Приступљено 6. 8. 2008.
- ^ Silverthorn, DU. (2004). Human physiology: an integrated approach. (3rd ed. изд.). Upper Saddle River (NJ): Pearson Education. ISBN 978-0-8053-5957-2.
- ^ „The Nobel Prize in Physiology or Medicine 1945”. The Nobel Foundation. Приступљено 7. 8. 2008.
- ^ а б в г д ђ е ж з и Thomas L. Lemke; David A. Williams, ур. (2007). „38. Antibiotics and Antimicrobial Agents”. Foye's Principles of Medicinal Chemistry (6. изд.). Baltimore: Lippincott Willams & Wilkins. ISBN 0781768799.
- ^ а б в г д ђ е Patrick, Graham L.. An Introduction to Medicinal Chemistry (third edition изд.). Oxford University Press. ISBN 978-0-19-927500-7.
- ^ Tindula, RJ, Ambrose, PJ, Harralson, AF (1983). „Aminoglycoside inactivation by penicillins and cephalosporins and its impact on drug-level monitoring”. Drug Intelligence & Clinical Pharmacy. 17 (12): 906—908. PMID 6653408.
- ^ Uber, WE, Brundage, RC, White, RL, Brundage, DM, Bromley, HR (1991). „In vivo inactivation of tobramycin by piperacillin”. Drug Intelligence & Clinical Pharmacy: the Annals of Pharmacotherapy. 25 (4): 357—9. PMID 1926903.
- ^ Pickering, LK, Rutherford, I (1981). „Effect of concentration and time upon inactivation of tobramycin, gentamicin, netilmicin and amikacin by azlocillin, carbenicillin, mecillinam, mezlocillin and piperacillin.”. The Journal of Pharmacology and Experimental Therapeutics. 217 (2): 345—9. PMID 6453219.
- ^ Dowell, JA, Korth-Bradley, J, Milisci, M, Tantillo, K, Amorusi, P, Tse, S (2001). „Evaluating possible pharmacokinetic interactions between tobramycin, piperacillin, and a combination of piperacillin and tazobactam in patients with various degrees of renal impairment.”. The Journal of Clinical Pharmacology. 41 (9): 979—86. PMID 11549103.
- ^ а б Група аутора, редактор Швабић-Влаховић, Милена. Медицинска бактериологија. Београд: Савремена администрација. ISBN 978-86-387-0746-1.
- ^ а б в г д ђ е ж з Greenwood, David et al.. Antimicrobial Chemotherapy (fifth edition изд.). Oxford University Press. ISBN 978-0-19-857016-5.
- ^ а б в Владимиров, Соте; Живанов-Стакић, Добрила. Фармацеутска хемија — II део. Београд: Фармацеутски факултет. ISBN 978-86-80263-40-3.
- ^ а б в г д ђ е Joint Formulary Committee. British National Formulary (54th edition изд.). London: British Medical Association and Royal Pharmaceutical Society of Great Britain. ISBN 978-0-85369-736-7.
- ^ Kelkar, Premod S.; Li, James T.-C. (2001). „Cephalosporin Allergy” (PDF). The New England Journal of Medicine. 345 (11): 804—809. PMID 11556301. Приступљено 30. 7. 2008.
- ^ Annè, S.; Reisman, RE. (1995). „Risk of administering cephalosporin antibiotics to patients with histories of penicillin allergy”. Ann Allergy Asthma Immunol.. 74 (2): 167—70. PMID 7697478.
- ^ Romano, A.; Guéant-Rodriguez, RM.; Viola, M.; Pettinato, R.; Guéant, JL. (2004). „Cross-Reactivity and Tolerability of Cephalosporins in Patients with Immediate Hypersensitivity to Penicillins”. Annals of Internal Medicine. 141 (1): 16—22. PMID 15238366. Приступљено 30. 7. 2008.
- ^ Gruchalla, RS.; Pirmohamed, M. (2006). „Clinical practice: Antibiotic allergy” (PDF). The New England Journal of Medicine. 354 (6): 601—9. PMID 16467547. Приступљено 30. 7. 2008.
- ^ Pichichero, ME. (2006). „Cephalosporins can be prescribed safely for penicillin-allergic patients” (PDF). The Journal of family practice. 55 (2): 106—12. PMID 16451776. Архивирано из оригинала (PDF) 24. 02. 2012. г. Приступљено 30. 7. 2008.
- ^ Pichichero, ME. (2007). „Use of selected cephalosporins in penicillin-allergic patients: a paradigm shift”. Diagn. Microbiol. Infect. Dis.. 57 (3 Suppl): 13S—18S. PMID 17349459.
- ^ Antunez, C.; Blanca-Lopez, N.; Torres, MJ. (2006). „Immediate allergic reactions to cephalosporins: evaluation of cross-reactivity with a panel of penicillins and cephalosporins”. J. Allergy Clin. Immunol.. 117 (2): 404—10. PMID 16461141.
Литература[уреди | уреди извор]
- Владимиров, Соте; Живанов-Стакић, Добрила. Фармацеутска хемија — II део. Београд: Фармацеутски факултет. ISBN 978-86-80263-40-3.
- Joint Formulary Committee. British National Formulary (54. изд.). London: British Medical Association and Royal Pharmaceutical Society of Great Britain. ISBN 978-0-85369-736-7.
- Greenwood, David. Antimicrobial Chemotherapy (5. изд.). Oxford University Press. ISBN 978-0-19-857016-5.
- Група аутора, редактор Швабић-Влаховић, Милена. Медицинска бактериологија. Београд: Савремена администрација. ISBN 978-86-387-0746-1.
- Patrick, Graham L. An Introduction to Medicinal Chemistry (3. изд.). Oxford University Press. ISBN 978-0-19-927500-7.
- Silverthorn, DU. (2004). Human physiology: an integrated approach. (3. изд.). Upper Saddle River (NJ): Pearson Education. ISBN 978-0-8053-5957-2.
- Brown, Kevin. Penicillin Man — Alexander Fleming and the Antibiotic Revolution. Sutton Publishing Ltd. ISBN 978-0-7509-3152-6.
Спољашње везе[уреди | уреди извор]
 | Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |
