Interferon-gama
 | |
| IUPAC ime | |
|---|---|
Ljudski interferon gama-1b | |
| Identifikatori | |
| CAS broj | 82115-62-6 98059-61-1 |
| ATC kod | L03AB03 (WHO) |
| DrugBank | BTD00017 |
| Hemijski podaci | |
| Formula | C761H1206N214O225S6 |
| Molarna masa | 17145.6 g/mol |
Interferon-gama (IFN-γ) je dimerizovani rastvorni citokin koji je jedini član tip II- klase interferona.[2][3] Ovaj interferon se originalno zvao aktivacioni faktor makrofaga, što je termin koji se u današnje vreme koristi za opisivanje veće familiju proteina kojoj IFN-γ pripada. Kod ljudi, IFN-γ protein je kodiran IFNG genom.[4][5]
Funkcija
[уреди | уреди извор]IFN-γ, ili tip II interferon, je citokin koji je kritičan za urođeni i adaptivni imunitet protiv viralnih i intracelularnih bakterijskih infekcija i za kontrolu tumora. Poremećena IFN-γ ekspresija je asocirana sa više autoinflamatornih i autoimunih bolesti. IFN-γ značaj u imunskom sistemu potiče delom od njegove sposobnosti da direktno inhibira viralnu replikaciju, ali, što je još važnije, od njegovih imunostimulatornih i imunomodulatornih efekata. IFN-γ se proizvodi predominantno od strane prirodni ubica (NK) i prirodni ubica T (NKT) ćelija kao deo urođenog imunog responsa, i od strane CD4 i CD8 citotoksičnih T limfocita (CTL) efektor T ćelije kad se jednom antigen-specifični imunitet razvije.[6][7][8]
Struktura
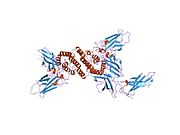
[уреди | уреди извор]The IFN-γ monomer se sastoji of osnove sa šest α-heliksa i proširene ne-savijene sekvence u C-terminalnom regionu.[9][1] To je pokazano da strukturnom modelu ispod. α-heliksi u osnovi strukture su numerisani sa 1 do 6.

Biološki aktivni dimer je formiran putem antiparalelnog inter-sprege dva monomera kao što je pokazano ispod. Na karikaturnom modelu, jedan monomer je pokazan u crvenoj, a drugi u plavoj boji.

Vezivanje za receptor
[уреди | уреди извор]
Ćelijski odgovori na IFN-γ su aktivirani putem njegove interakcije sa hetero-dimerskim receptorom koji se sastoji od interferon gama receptora 1 (IFNGR1) i interferon gama receptora 2 (IFNGR2). IFN-γ vezivanje za receptor aktivira JAK-STAT put. IFN-γ se takođe vezuje za glikosaminoglikan heparan sulfate (HS) na ćelijskoj površini. Međutim, u kontrastu sa mnogim drugim heparan sulfate vezujućim proteinima, gde vezivanje promoviše biološku aktivnost, IFN-γ vezivanje za HS inhibira njegovu biološku aktivnost.[10]
Strukturni modeli prikazani u slikama 1-3 za IFN-γ[1] su svi skraćeni na njegovom C-kraju za 17 aminokiselina. IFN-γ pune dužine ima 143 aminokiseline. Afinitet za heparan sulfate potiče isključivo od 17 izbrisanih ostataka.[11] Unutar tih 17 aminokiselina su dva klastera baznih aminokiselina imenovana D1 i D2, respektivno. Heparan sulfat ostvaruje interakcije sa ta dva klastera.[12] U odsustvu heparan sulfata prisustvo D1 sekvence povišava stopu s kojom se IFN-γ-receptor kompleksi formiraju.[10] Interakcije između D1 klastera i receptora su mogući prvi stepen formiranja kompleksa. Putem vezivanja za D1, HS je možda u kompeticiji sa receptorom i sprečava formiranje aktivnih receptorskih kompleksa.
Biološki značaj heparan sulfat interakcije sa IFN-γ nije jasan, međutim vezivanje D1 klastera za HS ga može zaštititi od proteolitičkog razlaganja.[12]
Biološka aktivnost
[уреди | уреди извор]U kontrastu sa interferonom α i interferonom β, koje izražavaju sve ćelije, IFN-γ izlučuju Th1 ćelije, Tc ćelije, dendritske ćelije i NK ćelije. IFN-γ je takođe poznat kao imuni interferon. On je jedini tip II interferon. On je serološki različit od tipa I interferona, jer je kiselinski-labilan, dok su tip I varijante kiselinski-stabilne.
IFN-γ poseduje antivirusne, imunoregulatorne, i antitumorne osobine.[13] On menja transkripciju u do 30 gena, proizvodeći mnoštvo fizioloških i celularnih responsa. Među tim efektima su:
- Povećana antigen prezentacija makrofaga.
- Aktivira i povećava lizozom aktivnost u makrofagama
- Umanjuje aktivnost Th2 ćelija.
- Uzrokuje da normalne ćelije povećaju izražavanje klase I MHC molekula
- Promoviše adheziju i vezivanje neophodno za leukocit migraciju
- Promoviše aktivnost NK ćelija
- Aktivira APC ćelije, i promoviše Th1 diferencijaciju
- Aktivira inducibilnu NO sintetazu iNOS
IFN-γ je obeležavajući citokin Th1 ćelija (dok Th2 ćelije proizvode IL-4 i Th17 ćelije proizvode IL-17). NK ćelije i CD8+ citotoksične T ćelije takođe proizvode IFN-γ. IFN-γ potiskuje osteoklast formiranje putem brze degradacije RANK adapter proteina TRAF6 u RANK-RANKL signalnom putu, koji inače stimuliše NF-κB produkciju.
Terapeutska upotreba
[уреди | уреди извор]Interferon gama 1b se koristi u tretmanu hronične granulomatozne bolesti[14] i osteopetroze.[15] Njega proizvodi InterMune kao Actimune® i košta oko $300 američkih dolara po boci.
Interakcije
[уреди | уреди извор]Za interferon-gama je bilo pokazano da ostvaruje interakcije sa interferon gama receptorom 1.[16][17]
Regulacija
[уреди | уреди извор]Postoji evidencija da je interferon-gama ekspresija regulisana putem interferon gama 5' UTR regulatornog elementa.[18] Takođe postoji evidencija da je interferon-gama regulisan bilo direktno ili indirektno putem sledećih mikro RNK molekula: miR-221, miR-155, miR-145 i miR-198.[19][20][21]
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ а б в г д ђ PDB: 1FG9; Thiel DJ, le Du MH, Walter RL, D'Arcy A, Chène C, Fountoulakis M, Garotta G, Winkler FK, Ealick SE (2000). „Observation of an unexpected third receptor molecule in the crystal structure of human interferon-gamma receptor complex”. Structure. 8 (9): 927—36. PMID 10986460. doi:10.1016/S0969-2126(00)00184-2.
- ^ Gray PW, Goeddel DV (1982). „Structure of the human immune interferon gene”. Nature. 298 (5877): 859—63. PMID 6180322. doi:10.1038/298859a0.
- ^ Donald Voet; Judith G. Voet (2005). Biochemistry (3 изд.). Wiley. стр. 1343—4. ISBN 9780471193500.
- ^ Naylor SL, Sakaguchi AY, Shows TB, Law ML, Goeddel DV, Gray PW (1983). „Human immune interferon gene is located on chromosome 12”. J. Exp. Med. 157 (3): 1020—7. PMC 2186972
 . PMID 6403645. doi:10.1084/jem.157.3.1020.
. PMID 6403645. doi:10.1084/jem.157.3.1020.
- ^ „Entrez Gene: IFNGR2”.
- ^ „Entrez Gene: INFG”.
- ^ Schoenborn JR, Wilson CB (2007). „Regulation of interferon-gamma during innate and adaptive immune responses”. Adv. Immunol. 96: 41—101. PMID 17981204. doi:10.1016/S0065-2776(07)96002-2.
- ^ Mire-Sluis, Anthony R.; Thorpe, Robin, ур. (1998). Cytokines (Handbook of Immunopharmacology). Boston: Academic Press. ISBN 0-12-498340-5.
- ^ Ealick, S. E.; WJ, Cook; Vijay-Kumar S; et al. (1991). „Three-dimensional structure of recombinant human interferon-gamma”. Science (journal). 252 (5006): 698—702. PMID 1902591. doi:10.1126/science.1902591.
- ^ а б Sadir R, Forest E, Lortat-Jacob H (1998). „The heparan sulfate binding sequence of interferon-gamma increased the on rate of the interferon-gamma-interferon-gamma receptor complex formation”. J. Biol. Chem. 273 (18): 10919—10925. PMID 9556569. doi:10.1074/jbc.273.18.10919.
- ^ Vanhaverbeke, C.; Simorre JP; et al. (2004). „NMR characterization of the interaction between the C-terminal domain of interferon-gamma and heparin-derived oligosaccharides”. Biochem. J. 384 (Pt 1): 93—9. PMC 1134092
 . PMID 15270718. doi:10.1042/BJ20040757.
. PMID 15270718. doi:10.1042/BJ20040757.
- ^ а б Lortat-Jacob H, Grimaud JA (1991). „Interferon-gamma binds to heparan sulfate by a cluster of amino acids located in the C-terminal part of the molecule”. FEBS Lett. 280 (1): 152—154. PMID 1901275. doi:10.1016/0014-5793(91)80225-R.
- ^ Schroder K, Hertzog PJ, Ravasi T, Hume DA (2004). „Interferon-gamma: an overview of signals, mechanisms and functions”. J. Leukoc. Biol. 75 (2): 163—89. PMID 14525967. doi:10.1189/jlb.0603252.
- ^ Todd PA, Goa KL (1992). „Interferon gamma-1b. A review of its pharmacology and therapeutic potential in chronic granulomatous disease”. Drugs. 43 (1): 111—22. PMID 1372855.
- ^ Key LL, Ries WL, Rodriguiz RM, Hatcher HC (1992). „Recombinant human interferon gamma therapy for osteopetrosis”. J. Pediatr. 121 (1): 119—24. PMID 1320672. doi:10.1016/S0022-3476(05)82557-0.
- ^ Thiel, D J.; le Du M H; et al. (2000). „Observation of an unexpected third receptor molecule in the crystal structure of human interferon-gamma receptor complex”. Structure. ENGLAND. 8 (9): 927—36. ISSN 0969-2126. PMID 10986460. doi:10.1016/S0969-2126(00)00184-2.
- ^ Kotenko, S V.; Izotova, S. L; et al. (1995). „Interaction between the components of the interferon gamma receptor complex”. J. Biol. Chem. UNITED STATES. 270 (36): 20915—21. ISSN 0021-9258. PMID 7673114. doi:10.1074/jbc.270.36.20915.
- ^ Ben-Asouli, Y; Banai, Y.; et al. (2002). „Human interferon-gamma mRNA autoregulates its translation through a pseudoknot that activates the interferon-inducible protein kinase PKR”. Cell. 108 (2): 221—232. PMID 11832212. doi:10.1016/S0092-8674(02)00616-5.
- ^ Hu G, Gong AY, Liu J, Zhou R, Deng C, Chen XM (2010). „miR-221 suppresses ICAM-1 translation and regulates interferon-gamma-induced ICAM-1 expression in human cholangiocytes.”. Am J Physiol Gastrointest Liver Physiol. 298 (4): G542—50. PMC 2853302
 . PMID 20110463. doi:10.1152/ajpgi.00490.2009.
. PMID 20110463. doi:10.1152/ajpgi.00490.2009.
- ^ Banerjee A, Schambach F, DeJong CS, Hammond SM, Reiner SL (2010). „Micro-RNA-155 inhibits IFN-gamma signaling in CD4+ T cells.”. Eur J Immunol. 40 (1): 225—31. PMC 2807623
 . PMID 19877012. doi:10.1002/eji.200939381.
. PMID 19877012. doi:10.1002/eji.200939381.
- ^ Asirvatham AJ, Gregorie CJ, Hu Z, Magner WJ, Tomasi TB (2008). „MicroRNA targets in immune genes and the Dicer/Argonaute and ARE machinery components.”. Mol Immunol. 45 (7): 1995—2006. PMC 2678893
 . PMID 18061676. doi:10.1016/j.molimm.2007.10.035.
. PMID 18061676. doi:10.1016/j.molimm.2007.10.035.
Literatura
[уреди | уреди извор]- Hall, Stephen K. (1997). A commotion in the blood: life, death, and the immune system. New York: Henry Holt.
- Ikeda H, Old LJ, Schreiber RD (2002). „The roles of IFN gamma in protection against tumor development and cancer immunoediting.”. Cytokine Growth Factor Rev. 13 (2): 95—109. PMID 11900986. doi:10.1016/S1359-6101(01)00038-7.
- Chesler DA, Reiss CS (2003). „The role of IFN-gamma in immune responses to viral infections of the central nervous system.”. Cytokine Growth Factor Rev. 13 (6): 441—54. PMID 12401479. doi:10.1016/S1359-6101(02)00044-8.
- Dessein, A.; B, Kouriba; Eboumbou, C.; et al. (2005). „Interleukin-13 in the skin and interferon-gamma in the liver are key players in immune protection in human schistosomiasis.”. Immunol. Rev. 201: 180—90. PMID 15361241. doi:10.1111/j.0105-2896.2004.00195.x.
- Joseph AM, Kumar M, Mitra D (2005). „Nef: "necessary and enforcing factor" in HIV infection.”. Curr. HIV Res. 3 (1): 87—94. PMID 15638726. doi:10.2174/1570162052773013.
- Copeland, K. F. (2006). „Modulation of HIV-1 transcription by cytokines and chemokines.”. Mini reviews in medicinal chemistry. 5 (12): 1093—101. PMID 16375755. doi:10.2174/138955705774933383.
- Chiba H, Kojima T, Osanai M, Sawada N (2006). „The significance of interferon-gamma-triggered internalization of tight-junction proteins in inflammatory bowel disease.”. Sci. STKE. 2006 (316): pe1. PMID 16391178. doi:10.1126/stke.3162006pe1.
- Tellides G, Pober JS (2007). „Interferon-gamma axis in graft arteriosclerosis.”. Circ. Res. 100 (5): 622—32. PMID 17363708. doi:10.1161/01.RES.0000258861.72279.29.
Spoljašnje veze
[уреди | уреди извор]- Interferon-gamma на US National Library of Medicine Medical Subject Headings (MeSH)
![]() Mediji vezani za članak Interferon-gama na Vikimedijinoj ostavi
Mediji vezani za članak Interferon-gama na Vikimedijinoj ostavi
 | Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |