Кетон
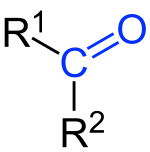
Кетони су органска једињења са кисеоником која садрже карболнилну, кето-групу.[1] За угљеников атом карбонилне групе везане су две акил-групе. Кетони настају оксидацијом секударних алкохола. Општа кетона формула је: R1(CO)R2.[2] Најједноставнији кетон је ацетон (R = R' = метил), са формулом CH3C(O)CH3. Многи кетони су од велике важности у индустрији и биологији. Примери укључују многе шећере (кетозе), многе стероиде (нпр. тестостерон) и растварач ацетон.[3]
Номенклатура и етимологија
[уреди | уреди извор]Реч кетон је изведена из Aketon, старе немачке речи за ацетон.[4][5][6]
По IUPAC номенклатури, кетони се имењују променом суфикса -ан на почетном алкану у -анон. Положај карбонилне групе обично се означава бројем. За важније кетоне се користе традиционална несистематска имена, на пример ацетон и бензофенон. Та несистематска имена се сматрају задржаним IUPAC именима,[7] мада поједини уџбеници користе имена попут 2-пропанон или пропан-2-он уместо ацетона, најједноставнијег кетона (-C H3-CO-CH3}-). Позиција карбонилне групе се обично означава бројем.
Изведена имена кетона добијају се одвојеним писањем имена две алкилне групе повезане са карбонилном групом, а затим као посебна реч следи „кетон“. Имена алкилних група се пишу по редоследу све веће сложености: на пример, метил етил кетон. Према правилима IUPAC номенклатуре, алкилне групе се пишу по абецеди, тј. етил метил кетон. Када су две алкилне групе исте, префикс „ди-“ се додаје испред имена алкилне групе. Положаји осталих група означени су грчким словима, α-угљеник је атом уз карбонилну групу.
Иако се ретко користи, оксо је део IUPAC номенклатура за оксо групу (=О) и користи се као префикс када кетон нема највећи приоритет. Међутим, користе се и други префикси. За неке уобичајене хемикалије (углавном у биохемији), кето се односи на кетонску функционалну групу.
Структура и својства
[уреди | уреди извор]
Кетонски угљеник се често описује као „sp2 хибридизован“, што је опис који укључује и њихову електронску и молекуларну структуру. Кетони су тригонално планарни око кетонског угљеника, са угловима везе C−C−O и C−C−C од приближно 120°. Кетони се разликују од алдехида по томе што је карбонилна група (CO) везана за два угљеника унутар угљеничног скелета. У алдехидима, карбонил је везан за један угљеник и један водоник, и налази се на крајевима угљеничних ланаца. Кетони се такође разликују од осталих функционалних група које садрже карбонил, попут карбоксилних киселина, естара и амида.[8]
Карбонилна група је поларна, јер је електронегативност кисеоника већа од оне за угљеник. Дакле, кетони су нуклеофилни на кисеоник и електрофилни на угљенику. Будући да карбонилна група формира интеракције са водом путем водоничног везивања, кетони су типично растворљивији у води од сродних метиленских једињења. Кетони су акцептори водоничне везе. Кетони обично нису донатори водоничне везе и не могу се водоничном везом везати за себе. Због немогућности да служе као донатори и акцептори водоничних веза, кетони немају тенденцију „самоповезивања“ и испарљивији су од алкохола и карбоксилних киселина сличне молекулске тежине. Ови фактори доприносе свеприсутности кетона у парфимерији и као растварача.
Класе кетона
[уреди | уреди извор]Кетони се класификују на основу њихових супституената. Једна широка класификација дели кетоне на симетричне и несиметричне деривате, у зависности од еквиваленције два органска супституента везана за карбонилни центар. Ацетон и бензофенон (C6H5C(O)C6H5) су симетрични кетони. Ацетофенон (C6H5C(O)CH3) је асиметрични кетон.
Дикетони
[уреди | уреди извор]Познате су многе врсте дикетона, неке од којих имају необична својства. Најједноставнији је диацетил (CH3C(O)C(O)CH3), некада кориштен као арома путера у кокицама. Ацетилацетон (пентан-2,4-дион) је практично погрешан назив (неодговарајући назив), јер ова материја постоји углавном као моноенол CH3C(O)CH=C(OH)CH3. Његов енолат је уобичајени лиганд у координационој хемији.
Незасићени кетони
[уреди | уреди извор]Кетони који садрже алкенске и алкинске јединице често се називају незасићени кетони. Најчешћи члан ове класе једињења је метил винил кетон, CH3C(O)CH=CH2, који је користан у Робинсоновој анулационој реакцији. Да не би дошло до забуне, сам кетон је место незасићења; односно може се хидрогенизовати.
Циклични кетони
[уреди | уреди извор]Многи кетони су циклични. Најједноставнија класа има формулу (CH2)nCO, где n варира од 2 за циклопропанон до виших аналога. Постоји мноштво већих деривата. Циклохексанон, симетрични циклични кетон, важан је међупродукт у производњи најлона. Изофорон, изведен из ацетона, је незасићени, асиметрични кетон који је прекурзор другим полимерима. Мускон, 3-метилпентадеканоне, је животињски феромон. Још један циклични кетон је циклобутанон, који има формулу C4H6O.
Кето-енолни таутомеризам
[уреди | уреди извор]
Кетони који имају најмање један алфа-водоник, подвргавају се кето-енолној таутомеризацији; таутомер је енол. Таутомеризацију катализују киселине и базе. Обично је кето облик стабилнији од енола. Ова равнотежа омогућава припрему кетона хидрацијом алкина.
Кисело/базна својства кетона
[уреди | уреди извор]C-H везе суседне карбонилу у кетонима су киселије (pKa ≈ 20) од веза C-H у алкану (pKa ≈ 50). Ова разлика одражава резонантну стабилизацију енолатног јона који настаје депротоновањем. Релативна киселост α-водоника је важна у реакцијама енолизације кетона и других карбонилних једињења. Киселост α-водоника такође омогућава кетонима и другим карбонилним једињењима да реагују као нуклеофили на том положају, са било стехиометријском или каталитичком базом. Користећи врло јаке базе попут литијум-диизопропиламида (ЛДА, pKa конјуговане киселине ~36) у неуравнотеженим условима (–788 °C, 1,1 еквивалента ЛДА у ТХФ, кетон додат у базу), мање супституисани кинетички енолат се генерише селективно, док услови који омогућавају равнотежу (виша температура, база додата кетону, употребом слабих или нерастворљивих база, нпр. NaOEt у EtOH, или NaH) дају супституисанији термодинамички енолат.
Кетони су такође слаба база, која подлеже протонацији на карбонилном кисеонику у присуству Бренстедових киселина. Кетонијумови јони (тј. протоновани кетони) јаке су киселине, чија се pKa вредност процењује на између –5 и –7.[9][10] Иако су киселине које се срећу у органској хемији ретко довољно јаке да у потпуности протонирају кетоне, формирање равнотежних концентрација протонованих кетона је ипак важан корак у механизмима многих уобичајених органских реакција, попут стварања ацетала, на пример. Веома слабе киселине, као што је пиридинијум катијон (какав се налази у пиридинијум тосилату) са pKa 5,2 могу да послуже као катализатори у овом контексту, упркос врло неповољној константи равнотеже за протонацију (Keq < 10−10).
Карактеристике
[уреди | уреди извор]Алдехид се разликује од кетона по томе што има атом водоника везан за своју карбонилну групу, чинећи алдехиде лакшим за оксидацију. Кетони немају атом водоника везан за карбонилну групу и зато су отпорнији на оксидацију. Они се оксидују само снажним оксидационим средствима која имају способност цепања веза угљеник-угљеник.
Спектроскопија
[уреди | уреди извор]Кетони и алдехиди снажно апсорбују у инфрацрвеном спектру близу 1700 cm−1. Тачан положај пика зависи од супституената.
Док 1H NMR спектроскопија генерално није корисна за утврђивање присуства кетона, 13C NMR спектри показују сигнале нешто ниже од 200 ppm, у зависности од структуре. Такви сигнали су обично слаби због одсуства нуклеарних Оверхаузерових ефеката. Пошто алдехиди резонирају при сличним хемијским помацима, примењују се експерименти вишеструке резонанце да би се дефинитивно разликовали алдехиди и кетони.
Квалитативни органски тестови
[уреди | уреди извор]Кетони дају позитивне резултате у Брејдијевом тесту, реакцијом са 2,4-динитрофенилхидразином дајући одговарајући хидразон. Кетони се могу разликовати од алдехида давањем негативног резултата са Толенсовим реагенсом или са Фелинговим раствором. Метил кетони дају позитивне резултате на јодоформном тесту.[11] Кетони такође дају позитивне резултате када се третирају са m-динитробензеном у присуству разблаженог натријум хидроксида дајући љубичасту боју.
Синтеза
[уреди | уреди извор]Постоје многи методи за припрему кетона у индустријским размерама и академским лабораторијама. Кетоне такође на разне начине производе организми; погледајте одељак о биохемији у наставку.
У индустрији најважнија метода вероватно укључује оксидацију угљоводоника, често ваздухом. На пример, милијарда килограма циклохексанона произведе се годишње аеробном оксидацијом циклохексана. Ацетон се припрема ваздушном оксидацијом кумена.
За специјализоване или мале органске синтетске примене, кетони се често припремају оксидацијом секундарних алкохола:
- R2CH(OH) + O → R2C=O + H2O
Типични јаки оксиданси (извор „О“ у горњој реакцији) укључују калијум перманганат или Cr(VI) једињење. У блажим условима користе се Дес–Мартинов перјодинан или Мофат–Сверн методе.
Развијене су многе друге методе, примери укључују:[12]
- Хидролизом геминалних халида.[13]
- Хидратацијом алкина.[14] Такви процеси се дешавају преко енола и захтевају присуство киселине и HgSO4. Каснија енол-кето таутомеризација даје кетон. Ова реакција увек производи кетон, чак и са терминалним алкином, једини изузетак је хидратација ацетилена, који производи ацеталдехид.
- Од Вајнребових амида користећи стехиометријске органометалне реагенсе.
- Ароматични кетони се могу добити Фридел-Крафтсовом ацилацијом,[15] сродном Хоубен-Хешовом реакцијом,[16] и Фрисовим преуређивањем.[14]
- Озонолиза и сродне секвенце дихидроксилације/оксидације цепају алкене дајући алдехиде или кетоне, у зависности од начина супституције алкена.[17]
- Од пероксида (преуређење Корнблум–ДеЛаМара).
- Циклизација дикарбоксилних киселина (Ружичкина циклизација)
- Хидролиза соли секундарних нитро једињења (Нефова реакција[18])
- Алкилација тиоестра са органоцинковим једињењима (Фукујамино упаривање).
- Алкилација киселог хлорида органокадмијум једињењима или органобакарним једињењима.
- Дакин–Вестова реакција обезбеђује ефикасан метод за припрему одређених метил кетона из карбоксилних киселина.[19]
- Кетони се могу добити реакцијом Григнардових реагенаса са нитрилима, након чега следи хидролиза.[20]
- Декарбоксилацијом карбоксилног анхидрида.
- Кетони се могу припремити од халокетона у редуктивној дехалогенацији хало кетона.
- У кетонској декарбоксилацији симетрични кетони се припремају из карбоксилних киселина.[14][21]
- Хидролиза незасићених секундарних амида,[22] естара β-кето киселина,[14] или β-дикетона (синтеза ацетосирћетног естра).
- Преуређење 1,2-диола каталисано киселином,[14] или Кригијева оксидација истих.
Реакције
[уреди | уреди извор]Кето-енол таутомеризација
[уреди | уреди извор]
Кетони који имају најмање један алфа-водоник, пролазе кроз кето-енол таутомеризацију; таутомер је енол. Таутомеризацију катализују и киселине и базе. Обично је кето облик стабилнији од енола. Ова равнотежа омогућава да се кетони припреме хидратацијом алкина.
Кисела/базна својства кетона
[уреди | уреди извор]C−H везе суседне карбонилу у кетонима су киселије pKa ≈ 20) него C−H везе у алкану (pKa ≈ 50). Ова разлика одражава резонантну стабилизацију енолатног јона који се формира депротонацијом. Релативна киселост α-водоника је важна у реакцијама енолизације кетона и других карбонилних једињења. Киселост α-водоника такође омогућава кетонима и другим карбонилним једињењима да реагују као нуклеофили на тој позицији, било са стехиометријском или каталитичком базом. Коришћењем веома јаких база као што је литијум диизопропиламид (LDA, pKa коњуговане киселине ~36) у неравнотежним условима (–78 °C, 1,1 еквив LDA у THF, кетон додат бази), мање супституисани кинетички енолат се генерише селективно, док услови који омогућавају еквилибрацију (виша температура, база додата кетону, коришћење слабих или нерастворљивих база, нпр. CH
3CH
2ONa у CH
3CH
2OH, или NaH) обезбеђује више супституисан термодинамички енолат.
Кетони су такође слабе базе, пролазећи кроз протонацију на карбонилном кисеонику у присуству Бренстедових киселина. Кетонијум јони (тј. протонирани кетони) су јаке киселине, са pKa вредностима процењеним на негде између –5 и –7.[23][24] Иако су киселине које се сусрећу у органској хемији ретко довољно јаке да у потпуности протонирају кетоне, формирање равнотежних концентрација протонираних кетона је ипак важан корак у механизмима многих уобичајених органских реакција, као што је формирање ацетала, на пример. Киселине које су слабе попут пиридинијум катјона (као што је пронађено у пиридинијум тозилату) са pKa од 5,2 могу да служе као катализатори у овом контексту, упркос веома неповољној константи равнотеже за протонацију (Keq < 10−10).
Нуклеофилне адиције
[уреди | уреди извор]Важан скуп реакција следи из осетљивости карбонилног угљеника на нуклеофилну адицију и тенденције да се енолати додају електрофилима. Нуклеофилни додаци укључују приближан редослед њихове уопштености:[12]
- Са водом (хидратација) даје геминалне диоле, који се обично не формирају у значајним (или видљивим) количинама
- Са ацетилидом да би се добио α-хидроксиалкин
- Са амонијаком или примарним амином даје имин
- Са секундарним амином даје енамин
- Са Григнардовим и органолитијумским реагенсима за давање, након обраде у води, терцијарног алкохола
- Са алкохолима или алкоксидима дају хемикетал или његову коњуговану базу. Са диолом до кетала. Ова реакција се користи за заштиту кетона.
- Са натријум амидом који доводи до цепања C–C везе са формирањем амида RCONH2 и алкана или арена R'H, реакција која се назива Халер-Бауерова реакција.[25]
Оксидација
[уреди | уреди извор]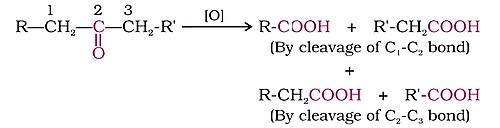
Кетони се цепају јаким оксидационим агенсима и на повишеним температурама. Њихова оксидација укључује цепање везе угљеник-угљеник да би се добила смеша карбоксилних киселина које имају мањи број атома угљеника од матичног кетона.
Друге реакције
[уреди | уреди извор]- Електрофилна адиција, реакција са електрофилом даје катјон стабилизован резонанцом
- Са фосфонијум илидима у Витиговој реакцији дају алкене
- Са тиолима да дају тиоацетал
- Са хидразином или 1-дисупституисаним дериватима хидразина да би се добили хидразони.
- Са металним хидридом настаје метална алкоксидна со, чија хидролиза даје алкохол, пример редукције кетона
- Са халогенима се формира α-халокетон, реакција која се одвија преко енола (погледајте Халоформну реакцију)
- Са тешком водом да се добије α-деутерисани кетон
- Фрагментација у фотохемијској Норисовој реакцији
- Реакција 1,4-аминодикетона на оксазолима дехидратацијом у Робинсон–Габријеловој синтези
- У случају арил-алкил кетона, са сумпором и амином дају амиде у Вилгеродтовој реакцији
- Са хидроксиламином за производњу оксима
- Са редукционим агенсима за формирање секундарних алкохола
- Са перокси киселинама за формирање естара у Бајер-Вилигеровој оксидацији
Биохемија
[уреди | уреди извор]Кетони се не појављују у стандардним аминокиселинама, нуклеинским киселинама или липидима. Формирање органских једињења у фотосинтези одвија се преко кетона рибулоза-1,5-бисфосфата. Многи шећери су кетони, познати под заједничким именом кетозе. Најпознатија кетоза је фруктоза; углавном постоји као циклични хемикетал, који маскира функционалну групу кетона. Синтеза масних киселина се одвија преко кетона. Ацетоацетат је интермедијер у Кребсовом циклусу који ослобађа енергију из шећера и угљених хидрата.[26]
У медицини, ацетон, ацетоацетат и бета-хидроксибутират се заједнички називају кетонска тела, настала од угљених хидрата, масних киселина и аминокиселина код већине кичмењака, укључујући људе. Кетонска тела су повишена у крви (кетоза) након поста, укључујући ноћ сна; у крви и урину у гладовању; код хипогликемије, због других узрока осим хиперинсулинизма; код разних |урођених поремећаја метаболизма, и намерно изазваних кетогеном исхраном, и код кетоацидозе (обично због дијабетес мелитуса). Иако је кетоацидоза карактеристична за декомпензовани или нелечени дијабетес типа 1, кетоза или чак кетоацидоза може се јавити и код дијабетеса типа 2 у неким околностима.
Апликације
[уреди | уреди извор]Кетони се производе у великим количинама у индустрији као растварачи, полимерни прекурсори и фармацеутски производи. Што се тиче размера, најважнији кетони су ацетон, метилетил кетон и циклохексанон.[27] Они су такође уобичајени у биохемији, али мање него у органској хемији уопште. Сагоревање угљоводоника је неконтролисани процес оксидације који даје кетоне као и многе друге врсте једињења.
Токсичност
[уреди | уреди извор]Иако је тешко генерализовати токсичност тако широке класе једињења, једноставни кетони, генерално, нису високо токсични. Ова карактеристика је један од разлога њихове популарности као растварача. Изузеци од овог правила су незасићени кетони као што је метил винил кетон са LD50 од 7 mg/kg (орално).[27]
Референце
[уреди | уреди извор]- ^ IUPAC. „ketones”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Online Etymology Dictionary
- ^ Harper, Douglas. „ketone”. Online Etymology Dictionary.
- ^ The word "ketone" was coined in 1848 by the German chemist Leopold Gmelin. See: Leopold Gmelin, ed., Handbuch der organischen Chemie: Organische Chemie im Allgemeinen … (Handbook of organic chemistry: Organic chemistry in general … ), 4th ed., (Heidelberg, (Germany): Karl Winter, 1848), volume 1, p. 40. From page 40: "Zu diesen Syndesmiden scheinen auch diejenigen Verbindungen zu gehören, die als Acetone im Allegemeinen (Ketone?) bezeichnet werden." (To these syndesmides*, those compounds also seem to belong, which are designated as acetones in general (ketones?).") [*Note: In 1844, the French chemist Auguste Laurent suggested a new nomenclature for organic compounds. One of his new classes of compounds was "syndesmides", which were compounds formed by the combination of two or more simpler organic molecules (from the Greek σύνδεσμος (syndesmos, union) + -ide (indicating a group of related compounds)). For example, acetone could be formed by the dry distillation of metal acetates, so acetone was the syndesmide of two acetate ions. See: Laurent, Auguste (1844) "Classification chimique," Comptes rendus, 19 : 1089–1100 ; see especially p. 1097.
- ^ List of retained IUPAC names retained IUPAC names Link
- ^ McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd изд.). Belmont: Wadsworth. ISBN 0-534-16218-5.
- ^ Evans, David A. (4. 11. 2005). „Evans pKa table” (PDF). Evans group website. Архивирано из оригинала (PDF) 19. 06. 2018. г. Приступљено 14. 6. 2018.
- ^ Smith, Michael B. (2013). March's Advanced Organic Chemistry (7th изд.). Hoboken, N.J.: Wiley. стр. 314—315. ISBN 978-0-470-46259-1.
- ^ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M.J.K.; Denney, R. C.; Thomas, M. J. K. (2000). Vogel's Quantitative Chemical Analysis (6th изд.). New York: Prentice Hall. ISBN 0-582-22628-7.
- ^ а б Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Marvel, C. S.; Sperry, W. M. (1928). „Benzophenone”. Organic Syntheses. 8: 26. doi:10.15227/orgsyn.008.0026.
- ^ а б в г д Furniss, Brian; Hannaford, Antony; Smith, Peter; Tatchell, Austin (1996). Vogel's Textbook of Practical Organic Chemistry (5th изд.). London: Longman Science & Technical. стр. 612—623, 976—977, 982—983. ISBN 9780582462366.
- ^ Allen, C. F. H.; Barker, W. E. (1932). „Desoxybenzoin”. Organic Syntheses. 12: 16. doi:10.15227/orgsyn.012.0016.
- ^ Gulati, K. C.; Seth, S.R.; Venkataraman, K. (1935). „Phloroacetophenone”. Organic Syntheses. 15: 70. doi:10.15227/orgsyn.015.0070.
- ^ Tietze, Lutz F.; Bratz, Matthias (1993). „Dialkyl Mesoxalates by Ozonolysis of Dialkyl Benzalmalonates: Dimethyl Mesoxalate”. Organic Syntheses. 71: 214. doi:10.15227/orgsyn.071.0214.
- ^ Heinzelman, R. V. (1955). „o-Methoxyphenylacetone”. Organic Syntheses. 35: 74. doi:10.15227/orgsyn.035.0074.
- ^ Wiley, Richard H.; Borum, O. H. (1953). „3-Acetamido-2-butanone”. Organic Syntheses. 33: 1. doi:10.15227/orgsyn.033.0001.
- ^ Moffett, R. B.; Shriner, R. L. (1941). „ω-Methoxyacetophenone”. Organic Syntheses. 21: 79. doi:10.15227/orgsyn.021.0079.
- ^ Thorpe, J. F.; Kon, G. A. R. (1925). „Cyclopentanone”. Organic Syntheses. 5: 37. doi:10.15227/orgsyn.005.0037.
- ^ Herbst, R. M.; Shemin, D. (1939). „Phenylpyruvic acid”. Organic Syntheses. 19: 77. doi:10.15227/orgsyn.019.0077.
- ^ Evans, David A. (4. 11. 2005). „Evans pKa table” (PDF). Evans group website. Архивирано из оригинала (PDF) 19. 6. 2018. г. Приступљено 14. 6. 2018.
- ^ Smith, Michael B. (2013). March's Advanced Organic Chemistry (7th изд.). Hoboken, N.J.: Wiley. стр. 314—315. ISBN 978-0-470-46259-1.
- ^ Haller–Bauer Reaction. homeip.net
- ^ Nelson, D. L.; Cox, M. M. (2000) Lehninger, Principles of Biochemistry. 3rd Ed. Worth Publishing: New York. ISBN 1-57259-153-6.
- ^ а б Siegel, Hardo; Eggersdorfer, Manfred (2000). „Ketones”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 9783527306732. doi:10.1002/14356007.a15077.
Литература
[уреди | уреди извор]- Cahill, George F.; Veech, Richard L. (2003). „Ketoacids? Good medicine?”. Transactions of the American Clinical and Climatological Association. 114: 149—61; discussion 162—63. ISSN 0065-7778. PMC 2194504
 . PMID 12813917.
. PMID 12813917. - Stryer, Lubert (1995). Biochemistry. (Fourth изд.). New York: W.H. Freeman and Company. стр. 510–15, 581–613, 775–78. ISBN 0-7167-2009-4.
- Silva, B., Mantha, O. L., Schor, J., Pascual, A., Plaçais, P. Y., Pavlowsky, A., & Preat, T. (2022). Glia fuel neurons with locally synthesized ketone bodies to sustain memory under starvation. Nature Metabolism, 4(2), 213–224. https://doi.org/10.1038/s42255-022-00528-6 Архивирано 2024-03-06 на сајту Wayback Machine
- Mary K. Campbell; Shawn O. Farrell (2006). Biochemistry
 (5th изд.). Cengage Learning. стр. 579. ISBN 0-534-40521-5.
(5th изд.). Cengage Learning. стр. 579. ISBN 0-534-40521-5. - Koeslag, J.H.; Noakes, T.D.; Sloan, A.W. (1980). „Post-exercise ketosis”. Journal of Physiology. 301: 79—90. PMC 1279383
 . PMID 6997456. doi:10.1113/jphysiol.1980.sp013190.
. PMID 6997456. doi:10.1113/jphysiol.1980.sp013190. - Berg, Jeremy (2019). Biochemistry (9 изд.). MacMillan. стр. 724. ISBN 9781319402853.
- Silva, Bryon; Mantha, Olivier L.; Schor, Johann; Pascual, Alberto; Plaçais, Pierre-Yves; Pavlowsky, Alice; Preat, Thomas (17. 2. 2022). „Glia fuel neurons with locally synthesized ketone bodies to sustain memory under starvation”. Nature Metabolism. 4 (2): 213—24. PMC 8885408
 . PMID 35177854. doi:10.1038/s42255-022-00528-6.
. PMID 35177854. doi:10.1038/s42255-022-00528-6. - „Oxidation of fatty acids”. 11. 10. 2013. Архивирано из оригинала 2018-01-08. г. Приступљено 2015-12-17.
- „American Diabetes Association-Ketoacidosis”. Архивирано из оригинала 2010-04-29. г. Приступљено 2010-03-02.
- „Archived copy” (PDF). Архивирано из оригинала (PDF) 2015-09-24. г. Приступљено 2013-09-18.
- Kodde IF, van der Stok J, Smolenski RT, de Jong JW (јануар 2007). „Metabolic and genetic regulation of cardiac energy substrate preference”. Comp. Biochem. Physiol. A. 146 (1): 26—39. PMID 17081788. doi:10.1016/j.cbpa.2006.09.014.
- Clarke, DD; Sokoloff, L (1999). „Substrates of Cerebral Metabolism”. Ур.: Siegel, GJ; Agranoff, BW; Albers, RW. Basic Neurochemistry: Molecular, Cellular and Medical Aspects (6th изд.). Philadelphia: Lippincott-Raven. Архивирано из оригинала 2019-03-23. г. Приступљено 2017-09-02.
- Hasselbalch, SG; Knudsen, GM; Jakobsen, J; Hageman, LP; Holm, S; Paulson, OB (1994). „Brain metabolism during short-term starvation in humans.”. Journal of Cerebral Blood Flow and Metabolism. 14 (1): 125—31. PMID 8263048. doi:10.1038/jcbfm.1994.17
 .
. - Freemantle, E.; Vandal, M. N.; Tremblay-Mercier, J.; Tremblay, S. B.; Blachère, J. C.; Bégin, M. E.; Thomas Brenna, J.; Windust, A.; Cunnane, S. C. (2006). „Omega-3 fatty acids, energy substrates, and brain function during aging”. Prostaglandins, Leukotrienes and Essential Fatty Acids. 75 (3): 213—20. PMID 16829066. doi:10.1016/j.plefa.2006.05.011.
- Jebb, David; Hiller, Michael (16. 10. 2018). „Recurrent loss of HMGCS2 shows that ketogenesis is not essential for the evolution of large mammalian brains”. eLife. 7: e38906. PMC 6191284
 . PMID 30322448. doi:10.7554/eLife.38906
. PMID 30322448. doi:10.7554/eLife.38906  .
. - Comstock, John P.; Garber, Alan J. (1990). Walker, H. Kenneth; Hall, W. Dallas; Hurst, J. Willis, ур. Clinical Methods: The History, Physical, and Laboratory Examinations (3rd изд.). Boston: Butterworths. ISBN 040990077X. PMID 21250091. Архивирано из оригинала 2017-09-10. г. Приступљено 2017-12-19.
- Koeslag, J.H.; Saunders, P.T.; Terblanche, E. (2003). „Topical Review: A reappraisal of blood glucose homeostat which comprehensively explains the type 2 diabetes mellitus/syndrome X complex”. Journal of Physiology. 549 (Pt 2): 333—46. PMC 2342944
 . PMID 12717005. doi:10.1113/jphysiol.2002.037895.
. PMID 12717005. doi:10.1113/jphysiol.2002.037895. - Jensen, NJ; Wodschow, HZ; Nilsson, M; Rungby, J (20. 11. 2020). „Effects of Ketone Bodies on Brain Metabolism and Function in Neurodegenerative Diseases”. International Journal of Molecular Sciences. 21 (22): 8767. PMC 7699472
 . PMID 33233502. doi:10.3390/ijms21228767
. PMID 33233502. doi:10.3390/ijms21228767  .
. - „Evaluation of the Safety and Tolerability of a Nutritional Formulation in Angelman Syndrome”. 18. 8. 2020. Архивирано из оригинала 9. 2. 2022. г. Приступљено 9. 2. 2022.
- McGuire, L. C; Cruickshank, A. M; Munro, P. T (2006). „Alcoholic ketoacidosis”. Emergency Medicine Journal. 23 (6): 417—20. PMC 2564331
 . PMID 16714496. doi:10.1136/emj.2004.017590.
. PMID 16714496. doi:10.1136/emj.2004.017590.
Спољашње везе
[уреди | уреди извор] Медији везани за чланак Кетон на Викимедијиној остави
Медији везани за чланак Кетон на Викимедијиној остави