Natrijum azid — разлика између измена
м normativna kontrola |
Značajno proširenje članka |
||
| Ред 1: | Ред 1: | ||
{{Chembox-lat |
{{Chembox-lat |
||
| |
| Verifiedfields = changed |
||
| |
| Watchedfields = changed |
||
| verifiedrevid = 464399913 |
|||
| Name = Natrijum azid |
| Name = Natrijum azid |
||
| ImageFile = Sodium azide.svg |
| ImageFile = Sodium azide.svg |
||
| Ред 95: | Ред 96: | ||
}} |
}} |
||
| Section2 = {{Chembox Properties-lat |
| Section2 = {{Chembox Properties-lat |
||
|Formula = {{chem2|NaN3}} |
|||
|N=3 |Na=1 |
|||
| |
|MolarMass = 65.0099 g/mol |
||
| |
|Appearance = Bezbojna do bela čvrsta supstanca |
||
|Odor = Bez mirisa |
|||
| Density = |
|||
|Density = 1.846 g/cm<sup>3</sup> ({{convert|20|C|F K}}) |
|||
| MeltingPt = |
|||
|Solubility = 38.9 g/100{{nnbsp}}mL ({{convert|0|C|F K}}) <br>40.8 g/100{{nnbsp}}mL ({{convert|20|C|F K}}) <br>55.3 g/100{{nnbsp}}mL ({{convert|100|C|F K}}) |
|||
| Melting_notes = |
|||
|Solvent1 = metanol |
|||
| BoilingPt = |
|||
|Solubility1 = 2.48 g/100{{nnbsp}}mL ({{convert|25|C|F K}}) |
|||
| Boiling_notes = |
|||
| |
|Solvent2 = etanol |
||
|Solubility2 = 0.22 g/100{{nnbsp}}mL ({{convert|0|C|F K}}) |
|||
| VaporPressure = |
|||
|SolubleOther = Veoma rastvorljiv u [[amonijak]]u <br> Slabo rastvorljiv u [[benzen]]u <br> Nerastvorljiv u [[Dietil etar|dietil etru]], [[aceton]]u, [[heksan]]u, [[hloroform]]u. |
|||
| HenryConstant = |
|||
|MeltingPtC = 275 |
|||
| AtmosphericOHRateConstant = |
|||
|MeltingPt_notes = burno razlaganje |
|||
| pKa = |
|||
| |
|pKa = 4.8 |
||
| Solubility = |
|||
| SolubleOther = |
|||
| Solvent = |
|||
| Sheet Resistance = |
|||
| Methacrylate Equiv Wt = |
|||
| Bulk Conductivity = |
|||
}} |
}} |
||
| Section3 = {{Chembox Structure-lat |
| Section3 = {{Chembox Structure-lat |
||
|CrystalStruct = [[Hexagonal crystal system|Hexagonal]], [[Pearson symbol|hR12]]<ref name=stevens>{{cite journal |author1=Stevens E. D. |author2=Hope H. | title = A Study of the Electron-Density Distribution in Sodium Azide, {{chem|NaN|3}} | journal = Acta Crystallographica A | year = 1977 | volume = 33 | issue = 5 |pages = 723–729 | doi = 10.1107/S0567739477001855 | doi-access = free }}</ref> |
|||
| CrystalStruct = |
|||
|SpaceGroup = R-3m, No. 166 |
|||
| Coordination = |
|||
| MolShape = |
|||
}} |
}} |
||
| Section4 = {{Chembox Thermochemistry-lat |
| Section4 = {{Chembox Thermochemistry-lat |
||
|DeltaHf = 21.3 kJ/mol |
|||
| DeltaHc = |
|||
|DeltaGf = 99.4 kJ/mol |
|||
| DeltaHf = |
|||
| |
|Entropy = 70.5 J/mol·K |
||
| |
|HeatCapacity = 76.6 J/mol·K |
||
}} |
|||
| Section5 = {{Chembox Pharmacology-lat |
|||
| AdminRoutes = |
|||
| Bioavail = |
|||
| Metabolism = |
|||
| HalfLife = |
|||
| ProteinBound = |
|||
| Excretion = |
|||
| Legal_status = |
|||
| Legal_US = |
|||
| Legal_UK = |
|||
| Legal_AU = |
|||
| Legal_CA = |
|||
| PregCat = |
|||
| PregCat_AU = |
|||
| PregCat_US = |
|||
}} |
|||
| Section6 = {{Chembox Explosive-lat |
|||
| ShockSens = |
|||
| FrictionSens = |
|||
| ExplosiveV = |
|||
| REFactor = |
|||
}} |
}} |
||
| Section7 = {{Chembox Hazards-lat |
| Section7 = {{Chembox Hazards-lat |
||
|ExternalSDS = [http://www.inchem.org/documents/icsc/icsc/eics0950.htm ICSC 0950] |
|||
| ExternalMSDS = |
|||
|GHSPictograms = {{GHS01}} {{GHS skull and crossbones}} {{GHS health hazard}} {{GHS environment}} |
|||
| EUClass = |
|||
|GHSSignalWord = '''Opasnost''' |
|||
| EUIndex = |
|||
|HPhrases = {{H-phrases|300|310|410}} |
|||
| MainHazards = |
|||
|PPhrases = {{P-phrases|260|280|301+310|501}} <ref>{{Cite web | url=https://molekula.com/catalog/26628-22-8/31803515-Sodium%20azide | title=Sodium azide}}</ref> |
|||
| NFPA-H = |
|||
| |
|NFPA-H = 4 |
||
| |
|NFPA-F = 1 |
||
| |
|NFPA-R = 3 |
||
| |
|FlashPtC = 300 |
||
|LD50 = 27 mg/kg (oral, rats/mice)<ref name=stevens/> |
|||
| SPhrases = |
|||
|PEL = None<ref name=PGCH>{{PGCH|0560}}</ref> |
|||
| RSPhrases = |
|||
|IDLH = N.D.<ref name=PGCH/> |
|||
| FlashPt = |
|||
|REL = C 0.1 ppm (as {{chem2|HN3}}) [skin] <br/>C 0.3 mg/m<sup>3</sup> (as {{chem2|NaN3}}) [skin]<ref name=PGCH/> |
|||
| Autoignition = |
|||
| ExploLimits = |
|||
| LD50 = |
|||
| PEL = |
|||
}} |
}} |
||
| Section8 = {{Chembox Related-lat |
| Section8 = {{Chembox Related-lat |
||
| |
|OtherAnions = [[Natrijum cijanid]] |
||
| |
|OtherCations = [[Kalijum azid]]<br>[[Amonijum azid]] |
||
}}<ref>{{cite web |title=Material Safety Data Sheet |url=http://www.lamission.edu/lifesciences/MSDS/MSDS/SodiumAzide.pdf |date=November 6, 2008 |access-date=October 26, 2015 |publisher=Sciencelab.com |archive-date=March 4, 2016 |archive-url=https://web.archive.org/web/20160304031149/http://www.lamission.edu/lifesciences/MSDS/MSDS/SodiumAzide.pdf |url-status=dead}}</ref> |
|||
| OtherFunctn = |
|||
| Function = |
|||
| OtherCpds = |
|||
}} |
|||
}} |
}} |
||
'''Natrijum azid''' je [[hemijsko jedinjenje]], koje ima [[Молекулска маса|molekulsku masu]] od 65,010 [[Јединица атомске масе|-{''Da''}-]]. |
|||
'''Natrijum azid''' je neorgansko [[hemijsko jedinjenje]], sa formulom {{chem2|NaN3}}, koje ima [[Молекулска маса|molekulsku masu]] od 65,010 [[Јединица атомске масе|-{''Da''}-]]. Ova bezbojna so je komponenta koja stvara gas u nekim sistemima vazdušnih jastuka u automobilu. Koristi se za pripremu drugih azidnih jedinjenja. To je jonska supstanca, veoma je rastvorljiva u vodi i veoma je otrovna. <ref name=Ull>{{Cite encyclopedia |encyclopedia=Ullmann's Encyclopedia of Industrial Chemistry |publisher = Wiley-VCH |year = 2000 |isbn = 9783527306732 |doi = 10.1002/14356007.a13_193 |first1 = Horst H. |last1 = Jobelius |first2 = Hans-Dieter |last2 = Scharff |chapter = Hydrazoic Acid and Azides}}</ref> |
|||
== Struktura == |
|||
Natrijum- azid je jonska čvrsta supstanca. Poznata su dva kristalna oblika, romboedarski i heksagonalni. <ref name=stevens/> Obe forme usvajaju slojevite strukture. Azidni anjon je veoma sličan u svakom obliku, jer je centrosimetričan sa N-N rastojanjima od 1,18 A. Jon Na+ ima oktaedačku geometriju. Svaki azid je vezan za šest Na+ centara, sa tri Na–N veze za svaki terminalni centar azota. <ref>{{Cite journal|title = The crystal structures of lithium, sodium and strontium azides|journal = Acta Crystallographica Section B|date = 1968-02-15|pages = 262–269|volume = 24|issue = 2|doi = 10.1107/s0567740868002062|first1 = G. E.|last1 = Pringle|first2 = D. E.|last2 = Noakes|doi-access = }}</ref> |
|||
== Priprema == |
|||
Uobičajena metoda sinteze je „[[Džons Vislicenus|Vislicenusov]] proces“, koji se odvija u dva koraka u tečnom [[amonijak]]u. U prvom koraku, [[amonijak]] se pretvara u [[natrijum amid]] [[Metam natrijum|metalnim natrijumom]]: |
|||
: {{chem2|2 Na + 2 NH3 → 2 NaNH2 + H2}} |
|||
To je redoks reakcija u kojoj [[Metam natrijum|metalni natrijum]] daje elektron protonu [[amonijak]]a koji se redukuje u vodonik gas. [[Natrijum]] se lako rastvara u tečnom [[amonijak]]u da bi proizveo hidratizovane elektrone odgovorne za plavu boju nastale tečnosti. {{chem2|Na+}} i {{chem2|NH2–}} [[jon]]i se proizvode ovom reakcijom. |
|||
[[Natrijum amid]] se zatim kombinuje sa [[azot-oksid]]om: |
|||
: {{chem2|2 NaNH2 + N2O → NaN3 + NaOH + NH3}} |
|||
Ove reakcije su osnova industrijskog puta, koji je proizveo oko 250 tona godišnje u 2004. godine, pri čemu je proizvodnja povećana zbog povećane upotrebe vazdušnih jastuka. <ref name=Ull/> |
|||
=== Laboratorijske metode === |
|||
Curtius i Thiele su razvili još jedan proizvodni proces, gde se nitritni estar pretvara u '''natrijum azid''' korišćenjem [[hidrazin]]a. Ova metoda je pogodna za laboratorijsku pripremu '''natrijum azida''': |
|||
: {{chem2|2 NaNO2 + 2 C2H5OH + H2SO4 → 2 C2H5ONO + Na2SO4 + 2 H2O}} |
|||
: {{chem2|C2H5ONO + N2H4*H2O + NaOH → NaN3 + C2H5OH + 3 H2O}} |
|||
Alternativno, so se može dobiti reakcijom [[natrijum nitrat]]a sa [[natrijum amid]]om. <ref>{{Holleman&Wiberg}}.</ref> |
|||
== Hemijske reakcije == |
|||
=== Kiselinska formacija azotne kiseline === |
|||
Tretiranje [[natrijum azid]]a jakim [[kiselina]]ma daje gasovitu [[Hidrazoinska kiselina|hidrazoinsku kiselinu]] (vodonik azid; HN<sub>3</sub>), koja je takođe izuzetno [[Токсичност|toksična]]: |
|||
: {{chem2|H+ + N3- → HN3}} |
|||
=== Ravnoteža hidrazoične kiseline === |
|||
Vodeni rastvori sadrže male količine [[Hidrazoinska kiselina|hidrazoinske kiseline]], čije se formiranje opisuje sledećom ravnotežom: |
|||
: {{chem2|N3- + H2O ⇌ HN3 + OH-}}, ''K'' = 10<sup>−4.6</sup> |
|||
=== Uništenje === |
|||
'''Natrijum-azid''' se može uništiti tretmanom sa pripremljenom [[Азотна киселина|azotnom kiselinom]] (HNO<sub>2</sub>; a ne HNO<sub>2</sub>). <ref name="PruPrac1995">{{ cite book | author = Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council | chapter = Disposal of Waste | title = Prudent Practices in the Laboratory: Handling and Disposal of Chemicals | year = 1995 | page = 165 | publisher = National Academy Press | location = Washington, DC | isbn = 978-0-309-05229-0 | chapter-url = http://books.nap.edu/openbook.php?record_id=4911&page=165}}</ref><ref name="Turnbull2008">{{citation | last1=Turnbull | first1=Kenneth | last2=Narsaiah | first2=B. | last3=Yadav | first3=J. S. | last4=Yakaiah | first4=T. | last5=Lingaiah | first5=B. P. V. | title=Encyclopedia of Reagents for Organic Synthesis | chapter=Sodium Azide | publisher=John Wiley & Sons, Ltd | publication-place=Chichester, UK | date=2008-03-14 | doi=10.1002/047084289x.rs045.pub2 | page=| isbn=978-0471936237}}</ref> Priprema je neophodna pošto je HNO<sub>2</sub> nestabilan i brzo se razlaže u vodenim rastvorima. Ovo uništavanje mora biti obavljeno sa velikim oprezom i unutar hemijske haube jer je formirani gasoviti [[azotni oksid]] (NO) takođe [[Токсичност|toksičan]], a netačan redosled dodavanja kiseline za formiranje HNO<sub>2</sub> će umesto toga proizvesti gasovitu visoko toksičnu [[Hidrazoinska kiselina|hidrazoinsku kiselinu]] (HN<sub>3</sub>). <ref name="PruPrac1995"></ref> |
|||
: {{chem2|2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH}} |
|||
== Osobine == |
== Osobine == |
||
| Ред 195: | Ред 208: | ||
| [[Polarna površina molekula|Polarna površina]]<ref>{{cite pmid|11020286|noedit}}</ref> (-{''PSA''}-, [[Ангстрем (јединица)|''Å''<sup>2</sup>]]) || 121,7 |
| [[Polarna površina molekula|Polarna površina]]<ref>{{cite pmid|11020286|noedit}}</ref> (-{''PSA''}-, [[Ангстрем (јединица)|''Å''<sup>2</sup>]]) || 121,7 |
||
|} |
|} |
||
== Aplikacije == |
|||
=== Automobilski vazdušni jastuci i klizači za evakuaciju iz aviona === |
|||
Starije formulacije vazdušnih jastuka sadržavale su mešavine oksidatora i [[natrijum azid]]a i drugih agenasa uključujući palioce i ubrzivače. Elektronski kontroler detonira ovu mešavinu tokom saobraćajne nesreće: |
|||
: {{chem2|2 NaN3 → 2 Na + 3 N2}} |
|||
Ista reakcija se dešava pri zagrevanju soli do približno {{convert|300|C|F K}}. [[Natrijum]] koji se formira je sam po sebi potencijalna opasnost i u automobilskim vazdušnim jastucima se pretvara reakcijom sa drugim sastojcima, kao što su [[kalijum nitrat]] i [[silicijum dioksid]]. U poslednjem slučaju nastaju bezopasni [[natrijum silikat]]i. <ref>{{cite journal | author = Betterton, E. A. | title = Environmental Fate of Sodium Azide Derived from Automobile Airbags | journal = Critical Reviews in Environmental Science and Technology | year = 2003 | volume = 33 | issue = 4 | pages = 423–458 | doi = 10.1080/10643380390245002 | bibcode = 2003CREST..33..423B | s2cid = 96404307 }}</ref> Dok se '''natrijum azid''' još uvek koristi u kliznim toboganima za evakuaciju modernih [[avion]]a, novija generacija automobilskih vazdušnih jastuka sadrži manje osetljive [[eksploziv]]e kao što su [[nitrogvanidin]]a ili [[gvanidin nitrat]]a. <ref>{{cite journal |last1=Halford |first1=Bethany |title=What chemicals make airbags inflate, and how have they changed over time? |journal=[[Chemical & Engineering News]] |date=November 15, 2022 |volume=100 |issue=41 |url=https://cen.acs.org/safety/chemicals-make-airbags-inflate-changed/100/i41 |access-date=4 June 2023 |quote=The chemical reaction used to deploy airbags has evolved, but one iteration resulted in massive recalls}} {{open access}}</ref> |
|||
=== Organska i neorganska sinteza === |
|||
Zbog opasnosti od [[Експлозија|eksplozije]], '''natrijum azid''' ima samo ograničenu vrednost u industrijskoj organskoj hemiji. U laboratoriji se koristi u organskoj sintezi za uvođenje azidne funkcionalne grupe izmeštanjem halogenida. Azidna funkcionalna grupa se zatim može pretvoriti u amin redukcijom ili sa [[Калај(II) хлорид|{{chem2|SnCl2}}]] u [[etanol]]u ili litijum-aluminijum hidridom ili tercijarnim [[fosfin]]om, kao što je [[trifenilfosfin]] u Staudingerovoj reakciji, sa Renijevim niklom ili sa [[vodonik-sulfid]]om u [[piridin]]u. [[Oseltamivir]], [[antivirusni lek]], trenutno se proizvodi komercijalnom metodom koja koristi '''natrijum-azid'''. <ref>{{cite journal |author1=Rohloff John C. |author2=Kent Kenneth M. |author3=Postich Michael J. |author4=Becker Mark W. |author5=Chapman Harlan H. |author6=Kelly Daphne E. |author7=Lew Willard |author8=Louie Michael S. |author9=McGee Lawrence R. | year = 1998 | title = Practical Total Synthesis of the Anti-Influenza Drug GS-4104 | journal = [[J. Org. Chem.]] | volume = 63 | issue = 13| pages = 4545–4550 | doi = 10.1021/jo980330q |display-authors=etal}}</ref> |
|||
'''Natrijum-azid''' je svestrani prekursor drugih neorganskih azidnih jedinjenja, na primer, [[Olovo(II) azid|olovnog azida]] i [[Srebro azid|srebrnog azida]], koji se koriste u [[detonator]]ima kao [[primarni eksploziv]]. Ovi [[azid]]i su znatno osetljiviji na prevremenu [[Detonacija|detonaciju]] od '''natrijum azida''' i stoga imaju ograničenu primenu. Olovni i srebrni azid se mogu dobiti reakcijom zamene sa '''natrijum azidom''' i njihovim odgovarajućim nitratom (najčešće) ili acetatnim solima. '''Natrijum-azid''' takođe može da reaguje sa hloridnim solima određenih alkalno zemaljskih metala u vodenom rastvoru, kao što su [[barijum hlorid]] ili [[stroncijum hlorid]] da bi proizveo [[barijum azid]] i [[stroncijum azid]], koji su takođe relativno osetljivi [[Примарни експлозив|primarni eksplozivni materijali]]. Ovi [[azid]]i se mogu dobiti iz rastvora pažljivim isušivanjem. |
|||
=== Biohemija i biomedicinska upotreba === |
|||
'''Natrijum-azid''' je koristan probni reagens sonde i antibakterijski konzervans za biohemijske rastvore. U prošlosti su takođe korišćeni mertiolat i hlorobutanol kao alternativa [[azid]]u za očuvanje biohemijskih rastvora. <ref name="Scopes 1994 p. ">{{cite book | last=Scopes | first=Robert K. | title=Protein Purification | publisher=Springer New York | publication-place=New York, NY | year=1994 | isbn=978-1-4419-2833-7 | doi=10.1007/978-1-4757-2333-5 | page=204}}</ref> |
|||
'''Natrijum-azid''' je trenutni inhibitor [[Laktoperoksidaza|laktoperoksidaze,]] koji može biti koristan za zaustavljanje [[Експеримент|eksperimenata]] radioaktivnog obeležavanja [[protein]]a [[Jod-125|<sup>Jod-125</sup>I]] katalizovanih laktroperoksidazom. <ref name="Deutscher 1990">{{cite book | last=Deutscher | first=M.P. | title=Guide to Protein Purification | publisher=Academic Press | series=Methods in enzymology | year=1990 | isbn=978-0-12-182083-1 | url=https://books.google.com/books?id=zTiRJHpKIQoC&pg=PR11 | access-date=2023-04-10 | page=729}}</ref> |
|||
U [[bolnica]]ma i [[laboratorija]]ma, to je [[biocid]]; posebno je važan u rasutim reagensima i osnovnim rastvorima koji inače mogu da podrže rast [[bakterija]] gde '''natrijum-azid''' deluje kao [[bakteriostatik]] inhibirajući citohrom oksidazu u gram-negativnim bakterijama; međutim, neke gram-pozitivne bakterije ([[streptokoke]], [[pneumokoke]], [[laktobacili]]) su suštinski otporne. <ref>{{cite journal |author1=Lichstein, H. C. |author2=Soule, M. H. | title = Studies of the Effect of Sodium Azide on Microbic Growth and Respiration: I. The Action of Sodium Azide on Microbic Growth | journal = Journal of Bacteriology | volume = 47 | issue = 3 | pages = 221–230 | year = 1943 |doi=10.1128/JB.47.3.221-230.1944 | pmid = 16560767 | pmc = 373901}}</ref> |
|||
=== Poljoprivredna upotreba === |
|||
Koristi se u [[Пољопривреда|poljoprivredi]] za kontrolu štetočina [[patogen]]a koji žive u zemljištu, kao što su [[Meloidogine incognita]] ili [[Helicotilenchus dihistera]]. <ref>Applications of sodium azide for control of soilborne pathogens in potatoes. Rodriguez-Kabana, R., Backman, P. A. and King, P.S., Plant Disease Reporter, 1975, Vol. 59, No. 6, pp. 528-532 ([http://www.cabdirect.org/abstracts/19750821668.html link])</ref> |
|||
Takođe se koristi kao [[mutagen]] za selekciju useva biljaka kao što su [[pirinač]], <ref>{{Cite journal|title = Mutagenic Effects of Sodium Azide in Rice1|journal = Crop Science|date = 2000-01-01|volume = 20|issue = 5|doi = 10.2135/cropsci1980.0011183x002000050030x|first1 = M. Afsar|last1 = Awan|first2 = C. F.|last2 = Konzak|first3 = J. N.|last3 = Rutger|first4 = R. A.|last4 = Nilan|pages = 663–668}}</ref> [[ječam]] <ref>{{Cite journal|title = Biological and genetic effects of combined treatments of sodium azide, gamma rays and EMS in barley|journal = Environmental and Experimental Botany|pages = 281–288|volume = 28|issue = 4|doi = 10.1016/0098-8472(88)90051-2|first1 = Xiongying|last1 = Cheng|first2 = Mingwei|last2 = Gao|year = 1988}}</ref> ili [[ovas]]. <ref>{{Cite journal|title = Sodium azide mutagenesis in diploid and hexaploid oats and comparison with ethyl methanesulfonate treatments|journal = Environmental and Experimental Botany|date = 1985-02-01|pages = 7–16|volume = 25|issue = 1|doi = 10.1016/0098-8472(85)90043-7|first = H. W.|last = Rines|url = https://zenodo.org/record/1258305}}</ref> |
|||
== Bezbednosna pitanja == |
|||
'''Natrijum-azid''' može biti smrtonosno [[Токсичност|toksičan]], <ref>{{Cite journal|title = Human Health Effects of Sodium Azide Exposure: A Literature Review and Analysis|journal = International Journal of Toxicology|date = 2003-05-01|issn = 1091-5818|pmid = 12851150|pages = 175–186|volume = 22|issue = 3|doi = 10.1080/10915810305109|first1 = Soju|last1 = Chang|first2 = Steven H.|last2 = Lamm|s2cid = 38664824}}</ref> pa čak i male količine mogu izazvati simptome. [[Toksičnost]] ovog jedinjenja je uporediva sa toksičnošću rastvorljivih [[alkalni cijanid|alkalnih cijanida]], <ref>{{cite web | url = http://hazard.com/msds/mf/baker/baker/files/s2906.htm | title = MSDS: sodium azide | id = MSDS S2906 | publisher = Mallinckrodt Baker | date = 2008-11-21 }}</ref> iako nije prijavljena toksičnost od iskorišćenih (istrošenih) vazdušnih jastuka. <ref name="OlsonAnderson2006">{{cite book|first1=Kent |last1=Olson|first2=Ilene B. |last2=Anderson|title=Poisoning & Drug Overdose, 5th Edition|url={{google books |plainurl=y |id=25avFCpfQAcC|page=123}}|date=18 September 2006|publisher=McGraw-Hill Companies,Incorporated|isbn=978-0-07-144333-3|pages=123}}</ref> |
|||
Proizvodi ekstrapiramidalne simptome sa nekrozom moždane kore, malog mozga i bazalnih ganglija. [[Toksičnost]] takođe može uključivati [[Хипотензија|hipotenziju]], <ref>{{Cite journal|title = Kidney International - Abstract of article: Epidemic hypotension in a dialysis center caused by sodium azide|journal = Kidney Int|date = 1990-01-01|issn = 0085-2538|pages = 110–115|volume = 37|issue = 1|doi = 10.1038/ki.1990.15|pmid = 2299796|last1 = Gordon|first1 = Steven M.|last2 = Drachman|first2 = Jonathan|last3 = Bland|first3 = Lee A.|last4 = Reid|first4 = Marie H.|last5 = Favero|first5 = Martin|last6 = Jarvis|first6 = William R.|doi-access = free}}</ref> slepilo i nekrozu jetre. '''Natrijum azid''' povećava ciklične GMP nivoe u mozgu i jetri aktivacijom [[Guanilatna ciklaza|gvanilat ciklaze]]. <ref>{{Cite journal|title = Increases in cyclic GMP levels in brain and liver with sodium azide an activator of guanylate cyclase|journal = Nature|date = 1975-10-23|pages = 700–702|volume = 257|issue = 5528|doi = 10.1038/257700a0|pmid = 241939|first1 = Hiroshi|last1 = Kimura|first2 = Chandra K.|last2 = Mittal|first3 = Ferid|last3 = Murad|bibcode = 1975Natur.257..700K|s2cid = 115294}}</ref> |
|||
Rastvori '''natrijum azida''' reaguju sa metalnim [[jon]]ima i talože metalne [[azid]]e, koji mogu biti osetljivi na [[Osetljivost na udar|udar]] i [[eksploziv]]. Ovo treba uzeti u obzir pri izboru nemetalnog transportnog kontejnera za rastvore '''natrijum azida''' u [[Лабораторија|laboratoriji]]. Ovo takođe može stvoriti potencijalno opasne situacije ako se rastvori [[azid]]a direktno odlažu u odvod u sanitarni kanalizacioni sistem. Metal u vodovodnom sistemu bi mogao da reaguje, formirajući visoko osetljive kristale metalnog azida koji se mogu akumulirati tokom godina. Adekvatne mere predostrožnosti su neophodne za bezbedno i ekološki odgovorno odlaganje ostataka rastvora [[azid]]a. <ref>{{Cite web|url=https://www.northeastern.edu/ehs/ehs-programs/hazardous-waste-management/fact-sheets/sodium-azide/|title = Sodium Azide | Environmental Health & Safety | Northeastern University}}</ref> |
|||
== Reference == |
== Reference == |
||
| Ред 200: | Ред 251: | ||
== Literatura == |
== Literatura == |
||
{{refbegin}} |
{{refbegin}} |
||
* {{Holleman&Wiberg1st}} |
* {{Holleman&Wiberg1st}} |
||
* {{Housecroft3rd}} |
* {{Housecroft3rd}} |
||
{{refend}} |
{{refend}} |
||
== Spoljašnje veze == |
== Spoljašnje veze == |
||
{{Portal-lat|Hemija}} |
{{Portal-lat|Hemija}} |
||
{{Commonscat-lat|Sodium azide}} |
{{Commonscat-lat|Sodium azide}} |
||
* {{PubChemInCheKey|PXIPVTKHYLBLMZ-UHFFFAOYSA-N|Sodium azide}} |
* {{PubChemInCheKey|PXIPVTKHYLBLMZ-UHFFFAOYSA-N|Sodium azide}} |
||
* [http://www.ilo.org/public/english/protection/safework/cis/products/icsc/dtasht/_icsc09/icsc0950.htm International Chemical Safety Card 0950]. |
|||
*[http://www.cdc.gov/niosh/npg/npgd0560.html NIOSH Pocket Guide to Chemical Hazards]. |
|||
* [http://ecb.jrc.it/ European Chemicals Bureau] {{Webarchive|url=https://web.archive.org/web/20110722200125/http://ecb.jrc.it/ |date = ngày 22 tháng 7 năm 2011}}. |
|||
*[http://www.straightdope.com/columns/061117.html ''Straight Dope'' on Sodium Azide] {{Webarchive|url=https://web.archive.org/web/20080821161923/http://www.straightdope.com/columns/061117.html |date=2008-08-21 }} |
|||
{{normativna kontrola}} |
{{normativna kontrola}} |
||
Верзија на датум 15. јануар 2024. у 02:50
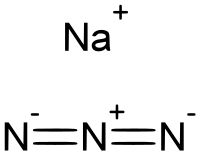
| |
 Natrijum azid
| |
| Identifikacija | |
|---|---|
3D model (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.043.487 |
| |
| Svojstva | |
| NaN 3 | |
| Molarna masa | 65,0099 g/mol |
| Agregatno stanje | Bezbojna do bela čvrsta supstanca |
| Miris | Bez mirisa |
| Gustina | 1,846 g/cm3 (20 °C (68 °F; 293 K)) |
| Tačka topljenja | 275 °C (527 °F; 548 K) burno razlaganje |
| 38.9 g/100 mL (0 °C (32 °F; 273 K)) 40.8 g/100 mL (20 °C (68 °F; 293 K)) 55.3 g/100 mL (100 °C (212 °F; 373 K)) | |
| Rastvorljivost | Veoma rastvorljiv u amonijaku Slabo rastvorljiv u benzenu Nerastvorljiv u dietil etru, acetonu, heksanu, hloroformu. |
| Rastvorljivost u metanol | 2.48 g/100 mL (25 °C (77 °F; 298 K)) |
| Rastvorljivost u etanol | 0.22 g/100 mL (0 °C (32 °F; 273 K)) |
| Kiselost (pKa) | 4.8 |
| Struktura | |
| Kristalna rešetka/struktura | Hexagonal, hR12[3] |
| Kristalografska grupa | R-3m, No. 166 |
| Termohemija | |
| Specifični toplotni kapacitet, C | 76.6 J/mol·K |
| Standardna molarna entropija S |
70.5 J/mol·K |
Std entalpija
formiranja (ΔfH⦵298) |
21.3 kJ/mol |
Gibsova slobodna energija (ΔfG˚)
|
99.4 kJ/mol |
| Opasnosti | |
| Bezbednost prilikom rukovanja | ICSC 0950 |
| GHS grafikoni |    
|
| GHS signalna reč | Opasnost |
| H300, H310, H410 | |
| P260, P280, P301+310, P501 [4] | |
| NFPA 704 | |
| Tačka paljenja | 300 °C (572 °F; 573 K) |
| Letalna doza ili koncentracija (LD, LC): | |
LD50 (LD50)
|
27 mg/kg (oral, rats/mice)[3] |
| SAD zdravstvene granice izlaganja (NIOSH): | |
PEL (dozvoljivo)
|
None[5] |
REL (preporučeno)
|
C 0.1 ppm (as HN 3) [skin] C 0.3 mg/m3 (as NaN 3) [skin][5] |
IDLH (neposredna opasnost)
|
N.D.[5] |
| Srodna jedinjenja | |
Drugi anjoni
|
Natrijum cijanid |
Drugi katjoni
|
Kalijum azid Amonijum azid |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Natrijum azid je neorgansko hemijsko jedinjenje, sa formulom NaN
3, koje ima molekulsku masu od 65,010 Da. Ova bezbojna so je komponenta koja stvara gas u nekim sistemima vazdušnih jastuka u automobilu. Koristi se za pripremu drugih azidnih jedinjenja. To je jonska supstanca, veoma je rastvorljiva u vodi i veoma je otrovna. [7]
Struktura
Natrijum- azid je jonska čvrsta supstanca. Poznata su dva kristalna oblika, romboedarski i heksagonalni. [3] Obe forme usvajaju slojevite strukture. Azidni anjon je veoma sličan u svakom obliku, jer je centrosimetričan sa N-N rastojanjima od 1,18 A. Jon Na+ ima oktaedačku geometriju. Svaki azid je vezan za šest Na+ centara, sa tri Na–N veze za svaki terminalni centar azota. [8]
Priprema
Uobičajena metoda sinteze je „Vislicenusov proces“, koji se odvija u dva koraka u tečnom amonijaku. U prvom koraku, amonijak se pretvara u natrijum amid metalnim natrijumom:
- 2 Na + 2 NH
3 → 2 NaNH
2 + H
2
To je redoks reakcija u kojoj metalni natrijum daje elektron protonu amonijaka koji se redukuje u vodonik gas. Natrijum se lako rastvara u tečnom amonijaku da bi proizveo hidratizovane elektrone odgovorne za plavu boju nastale tečnosti. Na+
i NH−
2 joni se proizvode ovom reakcijom.
Natrijum amid se zatim kombinuje sa azot-oksidom:
- 2 NaNH
2 + N
2O → NaN
3 + NaOH + NH
3
Ove reakcije su osnova industrijskog puta, koji je proizveo oko 250 tona godišnje u 2004. godine, pri čemu je proizvodnja povećana zbog povećane upotrebe vazdušnih jastuka. [7]
Laboratorijske metode
Curtius i Thiele su razvili još jedan proizvodni proces, gde se nitritni estar pretvara u natrijum azid korišćenjem hidrazina. Ova metoda je pogodna za laboratorijsku pripremu natrijum azida:
- 2 NaNO
2 + 2 C
2H
5OH + H
2SO
4 → 2 C
2H
5ONO + Na
2SO
4 + 2 H
2O - C
2H
5ONO + N
2H
4·H2O + NaOH → NaN
3 + C
2H
5OH + 3 H
2O
Alternativno, so se može dobiti reakcijom natrijum nitrata sa natrijum amidom. [9]
Hemijske reakcije
Kiselinska formacija azotne kiseline
Tretiranje natrijum azida jakim kiselinama daje gasovitu hidrazoinsku kiselinu (vodonik azid; HN3), koja je takođe izuzetno toksična:
- H+
+ N−
3 → HN
3
Ravnoteža hidrazoične kiseline
Vodeni rastvori sadrže male količine hidrazoinske kiseline, čije se formiranje opisuje sledećom ravnotežom:
- N−
3 + H
2O ⇌ HN
3 + OH−
, K = 10−4.6
Uništenje
Natrijum-azid se može uništiti tretmanom sa pripremljenom azotnom kiselinom (HNO2; a ne HNO2). [10][11] Priprema je neophodna pošto je HNO2 nestabilan i brzo se razlaže u vodenim rastvorima. Ovo uništavanje mora biti obavljeno sa velikim oprezom i unutar hemijske haube jer je formirani gasoviti azotni oksid (NO) takođe toksičan, a netačan redosled dodavanja kiseline za formiranje HNO2 će umesto toga proizvesti gasovitu visoko toksičnu hidrazoinsku kiselinu (HN3). [10]
- 2 NaN
3 + 2 HNO
2 → 3 N
2 + 2 NO + 2 NaOH
Osobine
| Osobina | Vrednost |
|---|---|
| Broj akceptora vodonika | 2 |
| Broj donora vodonika | 0 |
| Broj rotacionih veza | 0 |
| Particioni koeficijent[12] (ALogP) | 0,3 |
| Rastvorljivost[13] (logS, log(mol/L)) | 1,4 |
| Polarna površina[14] (PSA, Å2) | 121,7 |
Aplikacije
Automobilski vazdušni jastuci i klizači za evakuaciju iz aviona
Starije formulacije vazdušnih jastuka sadržavale su mešavine oksidatora i natrijum azida i drugih agenasa uključujući palioce i ubrzivače. Elektronski kontroler detonira ovu mešavinu tokom saobraćajne nesreće:
- 2 NaN
3 → 2 Na + 3 N
2
Ista reakcija se dešava pri zagrevanju soli do približno 300 °C (572 °F; 573 K). Natrijum koji se formira je sam po sebi potencijalna opasnost i u automobilskim vazdušnim jastucima se pretvara reakcijom sa drugim sastojcima, kao što su kalijum nitrat i silicijum dioksid. U poslednjem slučaju nastaju bezopasni natrijum silikati. [15] Dok se natrijum azid još uvek koristi u kliznim toboganima za evakuaciju modernih aviona, novija generacija automobilskih vazdušnih jastuka sadrži manje osetljive eksplozive kao što su nitrogvanidina ili gvanidin nitrata. [16]
Organska i neorganska sinteza
Zbog opasnosti od eksplozije, natrijum azid ima samo ograničenu vrednost u industrijskoj organskoj hemiji. U laboratoriji se koristi u organskoj sintezi za uvođenje azidne funkcionalne grupe izmeštanjem halogenida. Azidna funkcionalna grupa se zatim može pretvoriti u amin redukcijom ili sa SnCl
2 u etanolu ili litijum-aluminijum hidridom ili tercijarnim fosfinom, kao što je trifenilfosfin u Staudingerovoj reakciji, sa Renijevim niklom ili sa vodonik-sulfidom u piridinu. Oseltamivir, antivirusni lek, trenutno se proizvodi komercijalnom metodom koja koristi natrijum-azid. [17]
Natrijum-azid je svestrani prekursor drugih neorganskih azidnih jedinjenja, na primer, olovnog azida i srebrnog azida, koji se koriste u detonatorima kao primarni eksploziv. Ovi azidi su znatno osetljiviji na prevremenu detonaciju od natrijum azida i stoga imaju ograničenu primenu. Olovni i srebrni azid se mogu dobiti reakcijom zamene sa natrijum azidom i njihovim odgovarajućim nitratom (najčešće) ili acetatnim solima. Natrijum-azid takođe može da reaguje sa hloridnim solima određenih alkalno zemaljskih metala u vodenom rastvoru, kao što su barijum hlorid ili stroncijum hlorid da bi proizveo barijum azid i stroncijum azid, koji su takođe relativno osetljivi primarni eksplozivni materijali. Ovi azidi se mogu dobiti iz rastvora pažljivim isušivanjem.
Biohemija i biomedicinska upotreba
Natrijum-azid je koristan probni reagens sonde i antibakterijski konzervans za biohemijske rastvore. U prošlosti su takođe korišćeni mertiolat i hlorobutanol kao alternativa azidu za očuvanje biohemijskih rastvora. [18]
Natrijum-azid je trenutni inhibitor laktoperoksidaze, koji može biti koristan za zaustavljanje eksperimenata radioaktivnog obeležavanja proteina Jod-125I katalizovanih laktroperoksidazom. [19]
U bolnicama i laboratorijama, to je biocid; posebno je važan u rasutim reagensima i osnovnim rastvorima koji inače mogu da podrže rast bakterija gde natrijum-azid deluje kao bakteriostatik inhibirajući citohrom oksidazu u gram-negativnim bakterijama; međutim, neke gram-pozitivne bakterije (streptokoke, pneumokoke, laktobacili) su suštinski otporne. [20]
Poljoprivredna upotreba
Koristi se u poljoprivredi za kontrolu štetočina patogena koji žive u zemljištu, kao što su Meloidogine incognita ili Helicotilenchus dihistera. [21]
Takođe se koristi kao mutagen za selekciju useva biljaka kao što su pirinač, [22] ječam [23] ili ovas. [24]
Bezbednosna pitanja
Natrijum-azid može biti smrtonosno toksičan, [25] pa čak i male količine mogu izazvati simptome. Toksičnost ovog jedinjenja je uporediva sa toksičnošću rastvorljivih alkalnih cijanida, [26] iako nije prijavljena toksičnost od iskorišćenih (istrošenih) vazdušnih jastuka. [27]
Proizvodi ekstrapiramidalne simptome sa nekrozom moždane kore, malog mozga i bazalnih ganglija. Toksičnost takođe može uključivati hipotenziju, [28] slepilo i nekrozu jetre. Natrijum azid povećava ciklične GMP nivoe u mozgu i jetri aktivacijom gvanilat ciklaze. [29]
Rastvori natrijum azida reaguju sa metalnim jonima i talože metalne azide, koji mogu biti osetljivi na udar i eksploziv. Ovo treba uzeti u obzir pri izboru nemetalnog transportnog kontejnera za rastvore natrijum azida u laboratoriji. Ovo takođe može stvoriti potencijalno opasne situacije ako se rastvori azida direktno odlažu u odvod u sanitarni kanalizacioni sistem. Metal u vodovodnom sistemu bi mogao da reaguje, formirajući visoko osetljive kristale metalnog azida koji se mogu akumulirati tokom godina. Adekvatne mere predostrožnosti su neophodne za bezbedno i ekološki odgovorno odlaganje ostataka rastvora azida. [30]
Reference
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в Stevens E. D.; Hope H. (1977). „A Study of the Electron-Density Distribution in Sodium Azide, NaN
3”. Acta Crystallographica A. 33 (5): 723—729. doi:10.1107/S0567739477001855 .
.
- ^ „Sodium azide”.
- ^ а б в NIOSH Џепни водич хемијских хазарда. „#0560”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ „Material Safety Data Sheet” (PDF). Sciencelab.com. 6. 11. 2008. Архивирано из оригинала (PDF) 4. 3. 2016. г. Приступљено 26. 10. 2015.
- ^ а б Jobelius, Horst H.; Scharff, Hans-Dieter (2000). „Hydrazoic Acid and Azides”. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. ISBN 9783527306732. doi:10.1002/14356007.a13_193.
- ^ Pringle, G. E.; Noakes, D. E. (1968-02-15). „The crystal structures of lithium, sodium and strontium azides”. Acta Crystallographica Section B. 24 (2): 262—269. doi:10.1107/s0567740868002062.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5..
- ^ а б Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council (1995). „Disposal of Waste”. Prudent Practices in the Laboratory: Handling and Disposal of Chemicals. Washington, DC: National Academy Press. стр. 165. ISBN 978-0-309-05229-0.
- ^ Turnbull, Kenneth; Narsaiah, B.; Yadav, J. S.; Yakaiah, T.; Lingaiah, B. P. V. (2008-03-14), „Sodium Azide”, Encyclopedia of Reagents for Organic Synthesis, Chichester, UK: John Wiley & Sons, Ltd, ISBN 978-0471936237, doi:10.1002/047084289x.rs045.pub2
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Betterton, E. A. (2003). „Environmental Fate of Sodium Azide Derived from Automobile Airbags”. Critical Reviews in Environmental Science and Technology. 33 (4): 423—458. Bibcode:2003CREST..33..423B. S2CID 96404307. doi:10.1080/10643380390245002.
- ^ Halford, Bethany (15. 11. 2022). „What chemicals make airbags inflate, and how have they changed over time?”. Chemical & Engineering News. 100 (41). Приступљено 4. 6. 2023. „The chemical reaction used to deploy airbags has evolved, but one iteration resulted in massive recalls”

- ^ Rohloff John C.; Kent Kenneth M.; Postich Michael J.; Becker Mark W.; Chapman Harlan H.; Kelly Daphne E.; Lew Willard; Louie Michael S.; McGee Lawrence R.; et al. (1998). „Practical Total Synthesis of the Anti-Influenza Drug GS-4104”. J. Org. Chem. 63 (13): 4545—4550. doi:10.1021/jo980330q.
- ^ Scopes, Robert K. (1994). Protein Purification. New York, NY: Springer New York. стр. 204. ISBN 978-1-4419-2833-7. doi:10.1007/978-1-4757-2333-5.
- ^ Deutscher, M.P. (1990). Guide to Protein Purification. Methods in enzymology. Academic Press. стр. 729. ISBN 978-0-12-182083-1. Приступљено 2023-04-10.
- ^ Lichstein, H. C.; Soule, M. H. (1943). „Studies of the Effect of Sodium Azide on Microbic Growth and Respiration: I. The Action of Sodium Azide on Microbic Growth”. Journal of Bacteriology. 47 (3): 221—230. PMC 373901
 . PMID 16560767. doi:10.1128/JB.47.3.221-230.1944.
. PMID 16560767. doi:10.1128/JB.47.3.221-230.1944.
- ^ Applications of sodium azide for control of soilborne pathogens in potatoes. Rodriguez-Kabana, R., Backman, P. A. and King, P.S., Plant Disease Reporter, 1975, Vol. 59, No. 6, pp. 528-532 (link)
- ^ Awan, M. Afsar; Konzak, C. F.; Rutger, J. N.; Nilan, R. A. (2000-01-01). „Mutagenic Effects of Sodium Azide in Rice1”. Crop Science. 20 (5): 663—668. doi:10.2135/cropsci1980.0011183x002000050030x.
- ^ Cheng, Xiongying; Gao, Mingwei (1988). „Biological and genetic effects of combined treatments of sodium azide, gamma rays and EMS in barley”. Environmental and Experimental Botany. 28 (4): 281—288. doi:10.1016/0098-8472(88)90051-2.
- ^ Rines, H. W. (1985-02-01). „Sodium azide mutagenesis in diploid and hexaploid oats and comparison with ethyl methanesulfonate treatments”. Environmental and Experimental Botany. 25 (1): 7—16. doi:10.1016/0098-8472(85)90043-7.
- ^ Chang, Soju; Lamm, Steven H. (2003-05-01). „Human Health Effects of Sodium Azide Exposure: A Literature Review and Analysis”. International Journal of Toxicology. 22 (3): 175—186. ISSN 1091-5818. PMID 12851150. S2CID 38664824. doi:10.1080/10915810305109.
- ^ „MSDS: sodium azide”. Mallinckrodt Baker. 2008-11-21. MSDS S2906.
- ^ Olson, Kent; Anderson, Ilene B. (18. 9. 2006). Poisoning & Drug Overdose, 5th Edition. McGraw-Hill Companies,Incorporated. стр. 123. ISBN 978-0-07-144333-3.
- ^ Gordon, Steven M.; Drachman, Jonathan; Bland, Lee A.; Reid, Marie H.; Favero, Martin; Jarvis, William R. (1990-01-01). „Kidney International - Abstract of article: Epidemic hypotension in a dialysis center caused by sodium azide”. Kidney Int. 37 (1): 110—115. ISSN 0085-2538. PMID 2299796. doi:10.1038/ki.1990.15
 .
.
- ^ Kimura, Hiroshi; Mittal, Chandra K.; Murad, Ferid (1975-10-23). „Increases in cyclic GMP levels in brain and liver with sodium azide an activator of guanylate cyclase”. Nature. 257 (5528): 700—702. Bibcode:1975Natur.257..700K. PMID 241939. S2CID 115294. doi:10.1038/257700a0.
- ^ „Sodium Azide | Environmental Health & Safety | Northeastern University”.
Literatura
- Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
Spoljašnje veze
- International Chemical Safety Card 0950.
- NIOSH Pocket Guide to Chemical Hazards.
- European Chemicals Bureau Архивирано 2011-07-22 на сајту Wayback Machine.
- Straight Dope on Sodium Azide Архивирано 2008-08-21 на сајту Wayback Machine

