Натријум азид
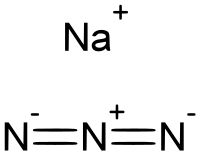
| |
 Натријум азид
| |
| Идентификација | |
|---|---|
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.043.487 |
| |
| Својства | |
| NaN 3 | |
| Моларна маса | 65,0099 g/mol |
| Агрегатно стање | Безбојна до бела чврста супстанца |
| Мирис | Без мириса |
| Густина | 1,846 g/cm3 (20 °C (68 °F; 293 K)) |
| Тачка топљења | 275 °C (527 °F; 548 K) burno razlaganje |
| 38.9 г/100 мЛ (0 °Ц (32 °Ф; 273 К)) 40.8 г/100 мЛ (20 °Ц (68 °Ф; 293 К)) 55.3 г/100 мЛ (100 °Ц (212 °Ф; 373 К)) | |
| Растворљивост | Веома растворљив у амонијаку Слабо растворљив у бензену Нерастворљив у диетил етру, ацетону, хексану, хлороформу. |
| Растворљивост у метанол | 2.48 г/100 мЛ (25 °Ц (77 °Ф; 298 К)) |
| Растворљивост у етанол | 0.22 г/100 мЛ (0 °Ц (32 °Ф; 273 К)) |
| Киселост (пКа) | 4.8 |
| Структура | |
| Кристална решетка/структура | Хеxагонал, хР12[3] |
| Кристалографска група | R-3m, No. 166 |
| Термохемија | |
| Специфични топлотни капацитет, C | 76.6 J/mol·K |
| Стандардна моларна ентропија S |
70.5 Ј/мол·К |
Стд енталпија
формирања (ΔfH⦵298) |
21.3 кЈ/мол |
Гибсова слободна енергија (ΔфГ˚)
|
99.4 кЈ/мол |
| Опасности | |
| Безбедност приликом руковања | ИЦСЦ 0950 |
| ГХС графикони |    
|
| ГХС сигнална реч | Опасност |
| Х300, Х310, Х410 | |
| П260, П280, П301+310, П501[4] | |
| НФПА 704 | |
| Тачка паљења | 300 °Ц (572 °Ф; 573 К) |
| Летална доза или концентрација (ЛД, ЛЦ): | |
ЛД50 (ЛД50)
|
27 мг/кг (орал, ратс/мице)[3] |
| САД здравствене границе излагања (НИОСХ): | |
ПЕЛ (дозвољиво)
|
Ноне[5] |
РЕЛ (препоручено)
|
C 0.1 ппм (ас ХН 3) [скин] C 0.3 мг/м3 (ас НаН 3) [скин][5] |
ИДЛХ (непосредна опасност)
|
Н.D.[5] |
| Сродна једињења | |
Други ањони
|
Натријум цијанид |
Други катјони
|
Калијум азид Амонијум азид |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Натријум азид је неорганско хемијско једињење, са формулом НаН
3, које има молекулску масу од 65,010 Da. Ова безбојна со је компонента која ствара гас у неким системима ваздушних јастука у аутомобилу. Користи се за припрему других азидних једињења. То је јонска супстанца, веома је растворљива у води и веома је отровна.[7]
Структура
[уреди | уреди извор]Натријум- азид је јонска чврста супстанца. Позната су два кристална облика, ромбоедарски и хексагонални.[3] Обе форме усвајају слојевите структуре. Азидни ањон је веома сличан у сваком облику, јер је центросиметричан са Н-Н растојањима од 1,18 А. Јон На+ има октаедачку геометрију. Сваки азид је везан за шест На+ центара, са три На–Н везе за сваки терминални центар азота.[8]
Припрема
[уреди | уреди извор]Уобичајена метода синтезе је „Вислиценусов процес“, који се одвија у два корака у течном амонијаку. У првом кораку, амонијак се претвара у натријум амид металним натријумом:
- 2 На + 2 НХ
3 → 2 НаНХ
2 + Х
2
То је редокс реакција у којој метални натријум даје електрон протону амонијака који се редукује у водоник гас. Натријум се лако раствара у течном амонијаку да би произвео хидратизоване електроне одговорне за плаву боју настале течности. На+
и НХ−
2 јони се производе овом реакцијом.
Натријум амид се затим комбинује са азот-оксидом:
- 2 НаНХ
2 + Н
2О → НаН
3 + НаОХ + НХ
3
Ове реакције су основа индустријског пута, који је произвео око 250 тона годишње у 2004. године, при чему је производња повећана због повећане употребе ваздушних јастука.[7]
Лабораторијске методе
[уреди | уреди извор]Цуртиус и Тхиеле су развили још један производни процес, где се нитритни естар претвара у натријум азид коришћењем хидразина. Ова метода је погодна за лабораторијску припрему натријум азида:
- 2 НаНО
2 + 2 C
2Х
5ОХ + Х
2СО
4 → 2 C
2Х
5ОНО + На
2СО
4 + 2 Х
2О - C
2Х
5ОНО + Н
2Х
4·Х2О + НаОХ → НаН
3 + C
2Х
5ОХ + 3 Х
2О
Алтернативно, со се може добити реакцијом натријум нитрата са натријум амидом.[9]
Хемијске реакције
[уреди | уреди извор]Киселинска формација азотне киселине
[уреди | уреди извор]Третирање натријум азида јаким киселинама даје гасовиту хидразоинску киселину (водоник азид; ХН3), која је такође изузетно токсична:
- Х+
+ Н−
3 → ХН
3
Равнотежа хидразоичне киселине
[уреди | уреди извор]Водени раствори садрже мале количине хидразоинске киселине, чије се формирање описује следећом равнотежом:
- Н−
3 + Х
2О ⇌ ХН
3 + ОХ−
, К = 10−4.6
Уништење
[уреди | уреди извор]Натријум-азид се може уништити третманом са припремљеном азотном киселином (ХНО2; а не ХНО2).[10][11] Припрема је неопходна пошто је ХНО2 нестабилан и брзо се разлаже у воденим растворима. Ово уништавање мора бити обављено са великим опрезом и унутар хемијске хаубе јер је формирани гасовити азотни оксид (НО) такође токсичан, а нетачан редослед додавања киселине за формирање ХНО2 ће уместо тога произвести гасовиту високо токсичну хидразоинску киселину (ХН3).[10]
- 2 НаН
3 + 2 ХНО
2 → 3 Н
2 + 2 НО + 2 НаОХ
Особине
[уреди | уреди извор]| Особина | Вредност |
|---|---|
| Број акцептора водоника | 2 |
| Број донора водоника | 0 |
| Број ротационих веза | 0 |
| Партициони коефицијент[12] (ALogP) | 0,3 |
| Растворљивост[13] (logS, log(mol/L)) | 1,4 |
| Поларна површина[14] (PSA, Å2) | 121,7 |
Апликације
[уреди | уреди извор]Аутомобилски ваздушни јастуци и клизачи за евакуацију из авиона
[уреди | уреди извор]Старије формулације ваздушних јастука садржавале су мешавине оксидатора и натријум азида и других агенаса укључујући палиоце и убрзиваче. Електронски контролер детонира ову мешавину током саобраћајне несреће:
- 2 НаН
3 → 2 На + 3 Н
2
Иста реакција се дешава при загревању соли до приближно 300 °Ц (572 °Ф; 573 К). Натријум који се формира је сам по себи потенцијална опасност и у аутомобилским ваздушним јастуцима се претвара реакцијом са другим састојцима, као што су калијум нитрат и силицијум диоксид. У последњем случају настају безопасни натријум силикати.[15] Док се натријум азид још увек користи у клизним тобоганима за евакуацију модерних авиона, новија генерација аутомобилских ваздушних јастука садржи мање осетљиве експлозиве као што су нитрогванидина или гванидин нитрата.[16]
Органска и неорганска синтеза
[уреди | уреди извор]Због опасности од експлозије, натријум азид има само ограничену вредност у индустријској органској хемији. У лабораторији се користи у органској синтези за увођење азидне функционалне групе измештањем халогенида. Азидна функционална група се затим може претворити у амин редукцијом или са СнЦл
2 у етанолу или литијум-алуминијум хидридом или терцијарним фосфином, као што је трифенилфосфин у Стаудингеровој реакцији, са Ренијевим никлом или са водоник-сулфидом у пиридину. Оселтамивир, антивирусни лек, тренутно се производи комерцијалном методом која користи натријум-азид.[17]
Натријум-азид је свестрани прекурзор других неорганских азидних једињења, на пример, оловног азида и сребрног азида, који се користе у детонаторима као примарни експлозив. Ови азиди су знатно осетљивији на превремену детонацију од натријум азида и стога имају ограничену примену. Оловни и сребрни азид се могу добити реакцијом замене са натријум азидом и њиховим одговарајућим нитратом (најчешће) или ацетатним солима. Натријум-азид такође може да реагује са хлоридним солима одређених алкално земаљских метала у воденом раствору, као што су баријум хлорид или стронцијум хлорид да би произвео баријум азид и стронцијум азид, који су такође релативно осетљиви примарни експлозивни материјали. Ови азиди се могу добити из раствора пажљивим исушивањем.
Биохемија и биомедицинска употреба
[уреди | уреди извор]Натријум-азид је користан пробни реагенс сонде и антибактеријски конзерванс за биохемијске растворе. У прошлости су такође коришћени мертиолат и хлоробутанол као алтернатива азиду за очување биохемијских раствора.[18]
Натријум-азид је тренутни инхибитор лактопероксидазе, који може бити користан за заустављање експеримената радиоактивног обележавања протеина Јод-125I катализованих лактропероксидазом.[19]
У болницама и лабораторијама, то је биоцид; посебно је важан у расутим реагенсима и основним растворима који иначе могу да подрже раст бактерија где натријум-азид делује као бактериостатик инхибирајући цитохром оксидазу у грам-негативним бактеријама; међутим, неке грам-позитивне бактерије (стрептококе, пнеумококе, лактобацили) су суштински отпорне.[20]
Пољопривредна употреба
[уреди | уреди извор]Користи се у пољопривреди за контролу штеточина патогена који живе у земљишту, као што су Мелоидогине инцогнита или Хелицотиленцхус дихистера.[21]
Такође се користи као мутаген за селекцију усева биљака као што су пиринач,[22] јечам[23] или овас.[24]
Безбедносна питања
[уреди | уреди извор]Натријум-азид може бити смртоносно токсичан,[25] па чак и мале количине могу изазвати симптоме. Токсичност овог једињења је упоредива са токсичношћу растворљивих алкалних цијанида,[26] иако није пријављена токсичност од искоришћених (истрошених) ваздушних јастука.[27]
Производи екстрапирамидалне симптоме са некрозом мождане коре, малог мозга и базалних ганглија. Токсичност такође може укључивати хипотензију,[28] слепило и некрозу јетре. Натријум азид повећава цикличне ГМП нивое у мозгу и јетри активацијом гванилат циклазе.[29]
Раствори натријум азида реагују са металним јонима и таложе металне азиде, који могу бити осетљиви на удар и експлозив. Ово треба узети у обзир при избору неметалног транспортног контејнера за растворе натријум азида у лабораторији. Ово такође може створити потенцијално опасне ситуације ако се раствори азида директно одлажу у одвод у санитарни канализациони систем. Метал у водоводном систему би могао да реагује, формирајући високо осетљиве кристале металног азида који се могу акумулирати током година. Адекватне мере предострожности су неопходне за безбедно и еколошки одговорно одлагање остатака раствора азида.[30]
Референце
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в Stevens E. D.; Hope H. (1977). „A Study of the Electron-Density Distribution in Sodium Azide, NaN
3”. Acta Crystallographica A. 33 (5): 723—729. doi:10.1107/S0567739477001855 .
.
- ^ „Sodium azide”.
- ^ а б в NIOSH Џепни водич хемијских хазарда. „#0560”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ „Material Safety Data Sheet” (PDF). Sciencelab.com. 6. 11. 2008. Архивирано из оригинала (PDF) 4. 3. 2016. г. Приступљено 26. 10. 2015.
- ^ а б Jobelius, Horst H.; Scharff, Hans-Dieter (2000). „Hydrazoic Acid and Azides”. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. ISBN 9783527306732. doi:10.1002/14356007.a13_193.
- ^ Pringle, G. E.; Noakes, D. E. (1968-02-15). „The crystal structures of lithium, sodium and strontium azides”. Acta Crystallographica Section B. 24 (2): 262—269. doi:10.1107/s0567740868002062.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5..
- ^ а б Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council (1995). „Disposal of Waste”. Prudent Practices in the Laboratory: Handling and Disposal of Chemicals. Washington, DC: National Academy Press. стр. 165. ISBN 978-0-309-05229-0.
- ^ Turnbull, Kenneth; Narsaiah, B.; Yadav, J. S.; Yakaiah, T.; Lingaiah, B. P. V. (2008-03-14), „Sodium Azide”, Encyclopedia of Reagents for Organic Synthesis, Chichester, UK: John Wiley & Sons, Ltd, ISBN 978-0471936237, doi:10.1002/047084289x.rs045.pub2
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Betterton, E. A. (2003). „Environmental Fate of Sodium Azide Derived from Automobile Airbags”. Critical Reviews in Environmental Science and Technology. 33 (4): 423—458. Bibcode:2003CREST..33..423B. S2CID 96404307. doi:10.1080/10643380390245002.
- ^ Halford, Bethany (15. 11. 2022). „What chemicals make airbags inflate, and how have they changed over time?”. Chemical & Engineering News. 100 (41). Приступљено 4. 6. 2023. „The chemical reaction used to deploy airbags has evolved, but one iteration resulted in massive recalls”

- ^ Rohloff John C.; Kent Kenneth M.; Postich Michael J.; Becker Mark W.; Chapman Harlan H.; Kelly Daphne E.; Lew Willard; Louie Michael S.; McGee Lawrence R.; et al. (1998). „Працтицал Тотал Сyнтхесис оф тхе Анти-Инфлуенза Друг ГС-4104”. Ј. Орг. Цхем. 63 (13): 4545—4550. дои:10.1021/јо980330q.
- ^ Сцопес, Роберт К. (1994). Протеин Пурифицатион. Неw Yорк, НY: Спрингер Неw Yорк. стр. 204. ИСБН 978-1-4419-2833-7. дои:10.1007/978-1-4757-2333-5.
- ^ Деутсцхер, M.П. (1990). Гуиде то Протеин Пурифицатион. Метходс ин ензyмологy. Ацадемиц Пресс. стр. 729. ИСБН 978-0-12-182083-1. Приступљено 2023-04-10.
- ^ Лицхстеин, Х. C.; Соуле, M. Х. (1943). „Студиес оф тхе Еффецт оф Содиум Азиде он Мицробиц Гроwтх анд Респиратион: I. Тхе Ацтион оф Содиум Азиде он Мицробиц Гроwтх”. Јоурнал оф Бацтериологy. 47 (3): 221—230. ПМЦ 373901
 . ПМИД 16560767. дои:10.1128/ЈБ.47.3.221-230.1944.
. ПМИД 16560767. дои:10.1128/ЈБ.47.3.221-230.1944.
- ^ Апплицатионс оф содиум азиде фор цонтрол оф соилборне патхогенс ин потатоес. Родригуез-Кабана, Р., Бацкман, П. А. анд Кинг, П.С., Плант Дисеасе Репортер, 1975, Вол. 59, Но. 6, пп. 528-532 (линк)
- ^ Аwан, M. Афсар; Конзак, C. Ф.; Рутгер, Ј. Н.; Нилан, Р. А. (2000-01-01). „Мутагениц Еффецтс оф Содиум Азиде ин Рице1”. Цроп Сциенце. 20 (5): 663—668. дои:10.2135/цропсци1980.0011183x002000050030x.
- ^ Цхенг, Xионгyинг; Гао, Мингwеи (1988). „Биологицал анд генетиц еффецтс оф цомбинед треатментс оф содиум азиде, гамма раyс анд ЕМС ин барлеy”. Енвиронментал анд Еxпериментал Ботанy. 28 (4): 281—288. дои:10.1016/0098-8472(88)90051-2.
- ^ Ринес, Х. W. (1985-02-01). „Содиум азиде мутагенесис ин диплоид анд хеxаплоид оатс анд цомпарисон wитх етхyл метханесулфонате треатментс”. Енвиронментал анд Еxпериментал Ботанy. 25 (1): 7—16. дои:10.1016/0098-8472(85)90043-7.
- ^ Цханг, Соју; Ламм, Стевен Х. (2003-05-01). „Хуман Хеалтх Еффецтс оф Содиум Азиде Еxпосуре: А Литературе Ревиеw анд Аналyсис”. Интернатионал Јоурнал оф Тоxицологy. 22 (3): 175—186. ИССН 1091-5818. ПМИД 12851150. С2ЦИД 38664824. дои:10.1080/10915810305109.
- ^ „МСДС: содиум азиде”. Маллинцкродт Бакер. 2008-11-21. МСДС С2906.
- ^ Олсон, Кент; Андерсон, Илене Б. (18. 9. 2006). Поисонинг & Друг Овердосе, 5тх Едитион. МцГраw-Хилл Цомпаниес,Инцорпоратед. стр. 123. ИСБН 978-0-07-144333-3.
- ^ Гордон, Стевен M.; Драцхман, Јонатхан; Бланд, Лее А.; Реид, Марие Х.; Фаверо, Мартин; Јарвис, Wиллиам Р. (1990-01-01). „Киднеy Интернатионал - Абстрацт оф артицле: Епидемиц хyпотенсион ин а диалyсис центер цаусед бy содиум азиде”. Киднеy Инт. 37 (1): 110—115. ИССН 0085-2538. ПМИД 2299796. дои:10.1038/ки.1990.15
 .
.
- ^ Кимура, Хиросхи; Миттал, Цхандра К.; Мурад, Ферид (1975-10-23). „Инцреасес ин цyцлиц ГМП левелс ин браин анд ливер wитх содиум азиде ан ацтиватор оф гуанyлате цyцласе”. Натуре. 257 (5528): 700—702. Бибцоде:1975Натур.257..700К. ПМИД 241939. С2ЦИД 115294. дои:10.1038/257700а0.
- ^ „Содиум Азиде | Енвиронментал Хеалтх & Сафетy | Нортхеастерн Университy”.
Литература
[уреди | уреди извор]- Холлеман А. Ф.; Wиберг Е. (2001). Инорганиц Цхемистрy (1ст изд.). Сан Диего: Ацадемиц Пресс. ИСБН 0-12-352651-5.
- Хоусецрофт, C. Е.; Схарпе, А. Г. (2008). Инорганиц Цхемистрy (3. изд.). Прентице Халл. ИСБН 978-0-13-175553-6.
Спољашње везе
[уреди | уреди извор]- Sodium azide
- Интернатионал Цхемицал Сафетy Цард 0950.
- НИОСХ Поцкет Гуиде то Цхемицал Хазардс.
- Еуропеан Цхемицалс Буреау Архивирано 2011-07-22 на сајту Wayback Machine.
- Страигхт Допе он Содиум Азиде Архивирано 2008-08-21 на сајту Wayback Machine

