Ugljen-dioksid

| |||
| |||
| Nazivi | |||
|---|---|---|---|
Drugi nazivi
| |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| 3DMet | B01131 | ||
| Bajlštajn | 1900390 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.004.271 | ||
| EC broj | 204-696-9 | ||
| E-brojevi | E290 (konzervansi) | ||
| Gmelin Referenca | 989 | ||
| KEGG[1] | |||
| MeSH | Carbon+dioxide | ||
| RTECS | FF6400000 | ||
| UNII | |||
| UN broj | 1013 (gas), 1845 (čvrst) | ||
| |||
| |||
| Svojstva | |||
| CO2 | |||
| Molarna masa | 44,01 g·mol−1 | ||
| Agregatno stanje | Bezbojni gas | ||
| Miris |
| ||
| Gustina |
| ||
| Tačka topljenja | −56,6 °C; −69,8 °F; 216,6 K (Trojna tačka na 5,1 atm) | ||
| Kritična tačka (T, P) | 31,1 °C (304,2 K), 7,38 MPa (73,8 bar) | ||
| −78,5 °C; −109,2 °F; 194,7 K (1 atm) | |||
| 1,45 g/L na 25 °C (77 °F), 100 kPa | |||
| Napon pare | 5,73 MPa (20 °C) | ||
| Kiselost (pKa) | 6,35, 10,33 | ||
| Magnetna susceptibilnost | −20,5·10−6 cm³/mol | ||
| Indeks refrakcije (nD) | 1,00045 | ||
| Viskoznost | 0,07 cP na −78,5 °C | ||
| Dipolni moment | 0 D | ||
| Struktura | |||
| Kristalna rešetka/struktura | trigonalna | ||
| Oblik molekula (orbitale i hibridizacija) | linearan | ||
| Termohemija | |||
| Specifični toplotni kapacitet, C | 37,135 J/K mol | ||
Standardna molarna
entropija (S |
214 J·mol−1·K−1 | ||
Standardna entalpija
stvaranja (ΔfH |
−393,5 kJ·mol−1 | ||
| Farmakologija | |||
| V03AN02 (WHO) | |||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | Sigma-Aldrič | ||
| NFPA 704 | |||
| Smrtonosna doza ili koncentracija (LD, LC): | |||
LCLo (najniža objavljena)
|
90,000 ppm (čovek, 5 min)[6] | ||
| Granice izloženosti zdravlja u SAD (NIOSH): | |||
PEL (dozvoljeno)
|
TWA 5000 ppm (9000 mg/m³)[5] | ||
REL (preporučeno)
|
TWA 5000 ppm (9000 mg/m³) ST 30,000 ppm (54,000 mg/m³)[5] | ||
IDLH (trenutna opasnost)
|
40,000 ppm[5] | ||
| Srodna jedinjenja | |||
Drugi anjoni
|
|||
Drugi katjoni
|
|||
Srodna ugljenični oksidi
|
|||
Srodna jedinjenja
|
|||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |||
| Reference infokutije | |||
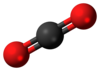
Ugljen-dioksid ili ugljenik(IV)-oksid je atmosferski prirodni gas koji se sastoji od jednog atoma ugljenika i dva atoma kiseonika spojenih kovalentnim vezama. Hemijska formula ovog gasa je CO2. U standardnim uslovima temperature i pritiska je u gasovitom stanju. U Zemljinoj atmosferi se nalazi u količini od oko 0,041% (po zapremini)[9] Deo je ugljenikovog ciklusa, a biljke, alge i cijanobakterije ga koriste u procesu fotosinteze (u prisustvu vode delovanjem sunčeve svetlosti) za proizvodnju ugljenih hidrata, čime se kao nusproizvod otpušta kiseonik.[10] Međutim, pošto se fotosinteza ne može odvijati u mraku, deo ugljen-dioksida biljke proizvode noću u procesu disanja.[11]
Ugljen-dioksid u prirodi nastaje sagorevanjem uglja ili ugljovodonika, fermentacijom šećera u alkoholna pićima, kao i disanjem svih živih organizama. Ljudi i kopnene životinje ga izbacuju iz disajnih organa. Emituju ga vulkani, gejziri i vreli izvori vode te druga mesta gde je Zemljina kora tanka. Oslobađa se i iz karbonatnih stena putem rastvaranja. CO2 se može naći u jezerima na dubinama ispod nivoa mora, te izmešan sa naftom i prirodnim gasom.[12]
Uticaji ugljen-dioksida na okolinu su od značajnog interesa. Ugljen-dioksid je važan staklenički gas, koji zagreva površinu Zemlje tako što smanjuje i onemogućava radijaciju toplote u svemir. Atmosferski ugljen-dioksid je osnovni izvor ugljenika za život na Zemlji, a njegova koncentracija u Zemljinoj atmosferi pre industrijske revolucije još od kasnog pretkambrijuma bila je regulisana fotosintetičkim organizmima. Međutim, od industrijske revolucije do danas brzo je porasla koncentracija CO2 u atmosferi zbog sagorevanja karbonskih (fosilnih) goriva (uglja, nafte i prirodnog gasa). Posledica povećanja koncentracije CO2 u atmosferi je globalno zagrevanje te antropogene klimatske promene. Ugljen-dioksid je najveći izvor zakiseljavanja okeana pošto on pri rastvaranju u vodi proizvodi ugljenu kiselinu[13] koja je slaba kiselina te je njena jonizacija u vodi nekompletna (CO2 + H2O ⇔ H2CO3).
Osobine[uredi | uredi izvor]
Pod normalnim uslovima ugljen-dioksid je u gasovitom agregatnom stanju. Bez mirisa je, zagušljiv, nezapaljiv, teži od vazduha. Adijabatskom ekspanzijom (širenjem sa visokog na atmosferski pritisak) delimično prelazi u čvrsto stanje (suvi led).
Fizičke[uredi | uredi izvor]


To je gas bez boje. U manjim koncentracijama je bez mirisa i ukusa. U većim koncentracijama, gas ima oštar kiseli miris. Pri standardnim uslovima temperature i pritiska, gustina mu je oko 1,98 kg/m3 što je oko 1,5 puta više od vazduha te se u zatvorenim prostorima često nalazi na dnu prostorije. Ugljen-dioksid ne može biti u tečnom stanju pri pritisku ispod 5,1 atm. Pri pritisku od 1 atm (približno „normalnom” pritisku na nivou mora), gas se pretvara direktno u čvrsto stanje na temperaturi ispod -78,5 °C a iznad te temperature CO2 u čvrstom stanju sublimira direktno u gas. U svom čvrstom stanju, ugljen-dioksid se često naziva i suvi led.
Tečni ugljen-dioksid se formira samo pri pritisku iznad 5,1 atm. Trojna tačka ugljen-dioksida je na oko 518 kPa i −56,6 °C. Kritična tačka je na 7,38 MPa i 31,1 °C.[14] Proučavan je i drugačiji oblik ugljen-dioksida u čvrstom stanju pri visokom pritisku u amorfnom obliku sličnom staklu.[15] Taj oblik stakla nazvan karbonija se proizvodi od superohlađenog CO2 pri izuzetno visokom pritisku (40—48 GPa ili 400 hiljada atm) u dijamantskoj komori. Ovo otkriće je potvrdilo teoriju da bi ugljen-dioksid mogao da postoji u obliku sličnom staklu, poput drugih članova iste elementarne porodice jedinjenja kao što su silikon, silikatno staklo i germanijum-dioksid. Za razliku od silike i germanijskog stakla, karbonija staklo nije stabilno na normalnom pritisku i vraća se u gasno stanje kada se smanji pritisak.
Hemijske[uredi | uredi izvor]
Struktura i veze[uredi | uredi izvor]
Molekul ugljen-dioksida je pravolinijski i centralno simetričan. Dve C-O veze su jednake i kratke (116,3 pm), a sastoje se iz dvostruke veze.[16] Pošto je centralno simetričan, molekul nema električni dipol. U skladu sa ovom činjenicom, moguće je uočiti samo dve vibracijske linije u IC spektru i to: antisimetrično proširenje na 2349 cm−1 i savijanje u blizini 666 cm−1. Postoji i simetrično proširenje na 1388 cm−1 koje se može uočiti samo putem Ramanove spektroskopije.
U vodenom rastvoru[uredi | uredi izvor]
Ugljen-dioksid je dosta topljiv u vodi. Vodeni rastvor reaguje kiselo (pH oko 4), zbog stvaranja ugljenične kiseline:
- CO2 + H2O ⇔ H2CO3
Ova ravnoteža pomaknuta je jako ulevo, jer je više od 99% CO2 rastvoreno kao molekul, a samo mali deo reaguje s vodom, dajući kiselinu. Henrijeva konstanta ugljene kiseline je (na 25 °C). Zbog toga, veći deo ugljen-dioksida nije prešao u ugljenu kiselinu već je ostao kao molekul CO2 bez uticaja na pH vrednost. Relativna koncentracija CO2 i H2CO3 te deprotonizovanih formi HCO3− (bikarbonat) i CO32− (karbonat) zavise od pH. U neutralnim i blago alkalnim vodama (pH > 6,5) dominira bikarbonatna forma (>50%) i pretežna je (>95%) pri pH vrednosti morske vode. U veoma alkalnim vodama (pH > 10,4), dominira karbonatna forma (>50%). Okeani, koji su blago alkalni sa tipičnim vrednostima pH od 8,2 do 8,5 sadrže oko 120 mg bikarbonata po litru.
Pošto je ugljena kiselina diprotična, ima dve konstante kisele disocijacije, prva je za disocijaciju u bikarbonatni jon (hidrogen karbonat) (HCO3−):
- H2CO3 ⇔ HCO3− + H+
- Ka1 = 2,5x10-4 mol/l; pKa1 = 3,6 na 25 °C.[16]
Ovo je prava prva konstanta kiselinske disocijacije, definisana kao , gde denominator uključuje samo kovalentnu vezu H2CO3, a ne uključuje hidratizovani CO2(aq). Mnogo manja i mnogo češće spominjana vrednost oko 4,16x10−7 je vidljiva vrednost izračunata na bazi (netačne) pretpostavke da je sav rastvoreni CO2 prisutan kao ugljena kiselina, tako da je . Pošto većina rastvorenog ugljen-dioksida ostaje kao molekul, Ka1(vidljiva) ima daleko veći denominator i mnogo manju vrijednost od stvarne Ka1.[17]
Bikarbonatni jon je amfoterična vrsta koja može reagovati i kao kiselina i kao baza, u zavisnosti od pH vrednosti rastvora. Kod viših pH vrednosti, on se u velikoj meri disocira na karbonatni jon (CO32−):
- HCO3− ⇔ CO32− + H+
- Ka2 = 4,69x10-11 mol/l; pKa2 = 10,329
U organizmima, proizvodnja ugljene kiseline se katalizuje putem enzima karbonatne anhidraze.
Reakcije[uredi | uredi izvor]
CO2 je slabi elektrofil. Njegova reakcija sa vodom ilustruje ovu osobinu, pri čemu je hidroksid nukleofil. S njim reaguju i drugi nukleofili. Na primer, karbanjon koji se dobija iz Grignardovog reagensa i organolitijumskih jedinjenja reaguje sa ugljen-dioksidom te daje karboksilate:
U metalnim-ugljik-dioksid kompleksima CO2 služi kao ligand, a može poslužiti pri konverziji CO2 u druge hemikalije[18]
Redukcija CO2 u ugljen-monoksid je obično „teška” i spora reakcija:
- CO2 + 2 e− + 2H+ → CO + H2O
Redoks potencijal za ovu reakciju pri pH vrednosti od približno 7 se kreće oko -0,53 V u odnosu na standardnu vodonikovu elektrodu. Enzim ugljen-monoksid dehidrogenaza koji sadrži nikal je katalizator u ovom procesu.[19]
Primena[uredi | uredi izvor]
- U proizvodnji pića i gaziranih napitaka, zaštitu i pretakanje;
- U hemijskoj industriji za dobijanje karbonata, bikarbonata, đubriva, sinteznih smesa, u neutralizaciji alkalnih rastvora, proizvodnji boja, itd.;
- U tehnici zavarivanja, u metalurgiji, livarstvu, u hlađenju i zaštiti proizvoda.
Primena u gašenju požara[uredi | uredi izvor]
Ugljen-dioksid je efikasno sredstvo koje na zapaljenu materiju deluje isključivo ugušujuće, tako što je izoluje od okolnog vazduha, pri čemu je rashlađujući efekat relativno mali. On je pogodno sredstvo za gašenje požara u zatvorenim prostorijama, jer istiskuje vazduh iz prostorija, kad u većini slučajeva dolazi do prestanka procesa gorenja. Upotrebljava se najbolje za gašenje požara na električnim uređajima i instalacijama pod naponom (klase E), manjih količina zapaljivih tečnosti i gasova, požara klase B i C, dok se za gašenje požara lakih metala ne preporučuje.[20]
Način proizvodnje i isporuke[uredi | uredi izvor]
- Dobija se prečišćavanjem sirovog ugljendioksida iz prirodnih izvora ili iz procesa hemijske industrije i utečnjavanjem u robni gas.
- U čeličnim sudovima - bocama, pod pritiskom od 70-150 bara u tečnom agregatnom stanju ili u tečnom agregatnom stanju specijalnim transportnim sudovima pod pritiskom do suda korisnika gasa.
Postupak i materijali[uredi | uredi izvor]
- Gas u suvom stanju nije korodivan. Za vlažan gas je neophodna primena legiranih čelika. Za tečnost se koriste legirani čelici za niske temperature. Dozvoljena je upotreba većine plastičnih materijala.
- U radu sa gasom ili tečnošću pod pritiskom treba se pridržavati propisanih uputstava i mera zaštite.
Suvi led[uredi | uredi izvor]
Suvi led je ugljendioksid u čvrstom agregatnom stanju na temperaturi od -79º C. Suvi led se proizvodi od tečnog ugljendioksida pri kontrolisanim uslovima u specijalno konstruisanoj mašini. Pri ovom procesu nastaje prvo suvi sneg, a kompresijom i suvi led, koji se zatim presuje kroz ekstrudersku ploču, i tako dobija proizvod različitih dimenzija.
- Suvi led se isporučuje u blokovima dimenzija 25 cm x 25 cm x 40 cm, prosečne težine oko 25 kg.
- Pakuje se i transportuje u izolovanim kontejnerima u koje staje oko 250 kg.
Upotreba[uredi | uredi izvor]
Upotrebe suvog leda su razne od hlađenja hrane i pića u keteringu, transporta krvi, krvne plazme i organa na niskim temperaturama, do čišćenja i odmašćivanja površina
Primena[uredi | uredi izvor]
Osnovna upotreba je za hlađenje u transportu.
Vidi još[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ „Carbon Dioxide” (PDF). Air Products. Arhivirano iz originala (PDF) 29. 07. 2020. g. Pristupljeno 27. 12. 2018.
- ^ a b v NIOSH Džepni vodič hemijskih hazarda. „#0103”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ „Carbon dioxide”. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ „Safety Data Sheet – Carbon Dioxide Gas – version 0.03 11/11” (PDF). AirGas.com. 12. 2. 2018. Pristupljeno 4. 8. 2018.
- ^ „Carbon dioxide, refrigerated liquid” (PDF). Praxair. str. 9. Arhivirano iz originala (PDF) 29. 7. 2018. g. Pristupljeno 26. 7. 2018.
- ^ ESRL Global Monitoring Division - Global Greenhouse Gas Reference Network
- ^ Kaufman & Franz 1996.
- ^ Food Factories. www.legacyproject.org. Pristupljeno 10. oktobar 2011.
- ^ „General Properties and Uses of Carbon Dioxide, Good Plant Design and Operation for Onshore Carbon Capture Installations and Onshore Pipelines”. Energy Institute. Arhivirano iz originala 26. 6. 2012. g. Pristupljeno 14. 3. 2012.
- ^ National Research Council. "Summary." Ocean Acidification: A National Strategy to Meet the Challenges of a Changing Ocean. . Washington, DC: The National Academies Press. 2010.. 1. Print.
- ^ National Institute of Standards and Technology. „Carbon dioxide”. Pristupljeno 21. 1. 2008. Pronađeni su suvišni parametri:
|naslov=i|title=(pomoć) - ^ Santoro, M. (2006). „Amorphous silica-like carbon dioxide”. Nature. 441 (7095): 857—860. Bibcode:2006Natur.441..857S. PMID 16778885. S2CID 4363092. doi:10.1038/nature04879.
- ^ a b Norman N. Greenwood; Alan Earnshaw (1997): Chemistry of the Elements (2. izd.). Butterworth–Heinemann. Greenwood, Norman Neill; Earnshaw, Alan (1984). Chemistry of the Elements. Elsevier Science & Technology. ISBN 978-0-08-022056-7.
- ^ Jolly, William L., Modern Inorganic Chemistry (McGraw-Hill 1984), pp. 196
- ^ M. Aresta (Ed.) "Carbon Dioxide as a Chemical Feedstock" 2010, Wiley-VCH: Weinheim. Aresta, Michele (8. 3. 2010). Carbon Dioxide as Chemical Feedstock. Wiley. ISBN 978-3-527-32475-0.
- ^ Colin Finn, Sorcha Schnittger, Lesley J. Yellowlees, Jason B. Love "Molecular approaches to the electrochemical reduction of carbon dioxide" Chemical Communications 2011, 0000.
- ^ Šimon Đarmati, Hemija opasnih materija, Viša politehnička škola, Beograd,2006.
Literatura[uredi | uredi izvor]
- Kaufman, Donald G.; Franz, Cecilia M. (1996). Biosphere 2000: protecting our global environment. Kendall/Hunt Pub. Co. ISBN 978-0-7872-0460-0. Pristupljeno 11. 10. 2011.
- Seppänen, O.A.; Fisk, W.J.; Mendell, M.J. (decembar 1999). „Association of Ventilation Rates and CO2 Concentrations with Health and Other Responses in Commercial and Institutional Buildings” (PDF). Indoor Air. 9 (4): 226—252. PMID 10649857. doi:10.1111/j.1600-0668.1999.00003.x. Arhivirano iz originala (PDF) 27. 12. 2016. g.
- Shendell, D.G.; Prill, R.; Fisk, W.J.; Apte, M.G.; Blake, D.; Faulkner, D. (oktobar 2004). „Associations between classroom CO2 concentrations and student attendance in Washington and Idaho” (PDF). Indoor Air. 14 (5): 333—341. PMID 15330793. doi:10.1111/j.1600-0668.2004.00251.x. Arhivirano iz originala (PDF) 27. 12. 2016. g.
- Soentgen, Jens (februar 2014). „Hot air: The science and politics of CO2”. Global Environment. 7 (1): 134—171. doi:10.3197/197337314X13927191904925.
- Good plant design and operation for onshore carbon capture installations and onshore pipelines: a recommended practice guidance document. Global CCS Institute. Energy Institute and Global Carbon Capture and Storage Institute. 1. 9. 2010. Arhivirano iz originala 7. 11. 2018. g. Pristupljeno 27. 12. 2018. „'This new title is an essential guide for engineers, managers, procurement specialists and designers working on global carbon capture and storage projects.'”
Spoljašnje veze[uredi | uredi izvor]
- Proizvođač u Beogradu
- Internacionalna karta hemijske bezbednosti 0021
- Carbon dioxide MSDS by Amerigas in the SDSdata.org database.
- CDC – NIOSH Pocket Guide to Chemical Hazards – Carbon Dioxide
- Carbon Dioxide Properties, Uses, Applications
- Dry Ice information Архивирано на сајту Wayback Machine (3. април 2004)
- Trends in Atmospheric Carbon Dioxide (NOAA)
- "A War Gas That Saves Lives". Popular Science, June 1942, pp. 53–57.
- http://googas.ov.ingv.it/ Архивирано на сајту Wayback Machine (13. фебруар 2021)
- Reactions, Thermochemistry, Uses, and Function of Carbon Dioxide Архивирано на сајту Wayback Machine (13. фебруар 2021)
- Carbon Dioxide – Part One
- Carbon Dioxide – Part Two



![{\displaystyle K_{\mathrm {h} }={\frac {\rm {[H_{2}CO_{3}]}}{\rm {[CO_{2}(aq)]}}}=1,70\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b0e19bb5e2309573a88792baa593a317e1a5829c)
![{\displaystyle K_{a1}={\frac {\rm {[HCO_{3}^{-}][H^{+}]}}{\rm {[H_{2}CO_{3}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81950791f8b36374241d6fa82828522bd875668a)
![{\displaystyle K_{\mathrm {a1} }{\rm {(vidlji)}}={\frac {\rm {[HCO_{3}^{-}][H^{+}]}}{\rm {[H_{2}CO_{3}]+[CO_{2}(aq)]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/439f0a7692b21a20486eb097796ec52eef30f04e)
