Циркуларни дихроизам
Циркуларни дихроизам (ЦД) заснива се на различитој апсорпцији десно и лево кружно поларизоване светлости која је последица структурне асиметрије.[1] Уређене структуре имају ЦД сигнале док неуређене немају. ЦД спектроскопија је метода која се користи за утврђивање оптичке изомерије молекула, а и за одређивање секундарне и терцијарне структуре протеина[2].
Порекло елиптицитета
[уреди | уреди извор]
Због асиметричне расподеле наелектрисања код оптички активних молекула, десно и лево кружно поларизовани таласи ће се кретати различитим брзинама (због различитих индекса преламања, nD ≠ nL). Као последица тога, фазни померај између лево и десно кружно поларизованог таласа после проласка кроз оптички активну средину ће бити различит од оног пре проласка кроз оптички активну средину, па ће раван поларизације линеарно поларизоване светлости после проласка кроз оптички активну средину бити закренута за одређени угао у односу на раван поларизације линеарно поларизованог упадног снопа.[3] Ако су за дату оптички активну супстанцу различити и моларни апсорпциони коефицијенти за десно и лево кружно поларизовану светлост (εD ≠ εL) излазни сноп ће бити елиптично поларизован[2].
За дату таласну дужину, разлика између апсорбанције лево кружно поларизоване и десно кружно поларизоване светлости (ова величина се обично мери):
Применом Беровог закона добијамо следећу зависност:
где су:
- εL и εD моларни апсорпциони коефицијенти за лево кружно поларизовану и десно кружно поларизовану светлост,
- C моларна концентрација
- l дужина пута у центиметрима (cm).
Тада је:
моларни циркуларни дихроизам. На ову величину се најчешће мисли под појмом циркуларни дихроизам супстанце. Иако се често мери ΔА, уобичајено је да се ексцентрицитет елиптично поларизоване светлости изрази величином која се зове елиптицитет (θ), θ = arctan (а/b). Да би било могуће поређење елиптицитета за узорке различитих концентрација потребно је изразити елиптицитет по јединици концентрације, или по броју резидуа. Зато се уводи нова величина - моларни елиптицитет [θ].[4]
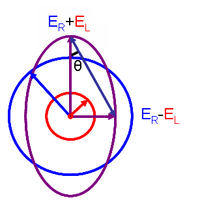
Моларни циркуларни дихроизам и моларни елиптицитет, [θ], повезани су следећом једначином:
Ова веза је изведена из дефинисања елиптицитета поларизације као:
где су ED and EL величине вектора електричног поља десно-кружно и лево-кружно поларизоване светлости.
Када је ED једнако EL (када нема разлике у апсорпцији десно и лево-кружно поларизоване светлости), θ = 0° и светлост је линеарно поларизована. Када је или ED или EL једнако нули, θ је 45° и светлост је кружно поларизована.
Како је ефекат циркуларног дихроизма мали, односно tan θ има малу вредност и може се апроксимирати са θ у радијанима. Интензитет светлости, I, пропорционалан је квадрату вектора електричног поља, тако да елиптицитет постаје:
Затим можемо изразити интензитете у претходној једначини коришћењем Беровог закона у облику природног логаритма:
Елиптицитет сада може бити написан као:
Када је ΔА<<1, овај израз може бити апроксимиран развијањем експоненцијалних чланова у Тејлоров ред до првог степена (можемо занемарити чланове виших степена) и затим занемаривањем ΔА у поређењу са јединицом, као и претварањем радијана у степене добијамо следећи израз:
Линеарна зависност концентрације раствора и дужине пута је уклоњена дефинисањем моларног елиптицитета као:
Онда комбиновањем последња два израза са Беровим законом, моларни елиптицитет постаје:
Моларни елиптицитет зависи од природе супстанце и таласне дужине упадног зрачења.
Графички представљена зависност моларног елиптицитета неке супстанције од таласне дужине упадног зрачења, [θ] = f(λ), зове се спектар циркуларног дихроизма или ЦД спектар дате супстанције[2].
Примена на биолошке молекуле
[уреди | уреди извор]Скоро сви биолошки молекули су оптички активни. Како се ЦД примењује на апсорпционе траке било ког оптички активног молекула, он ће бити примењен за биолошке молекуле, због десне ротације (нпр. неки шећери) и леве ротације (нпр. неке аминокиселине) коју они поседују. Такође можемо одредити секундарну структуру посматрањем ЦД за дати молекул. Дакле, алфа хеликс протеина и дупли (дволанчани) хеликс нуклеинских киселина имају карактеристичне ЦД спектре за своје структуре.
ЦД је уско повезан са техником оптичке ротационе дисперзије (ОРД), с тим што се ЦД сматра напреднијом техником. ЦД се мери близу апсорпционих трака од интереса, док се ОРД може мерити далеко од ових трака. Међутим, због дисперзионе природе ОРД, ЦД је осетљивија аналитичка метода. У принципу, ова два мерења могу бити повезана Кониг-Крамеровим трансформацијама, ако су све апсорпције обухваћене мерењем.
Ултраљубичасти ЦД спектар протеина може предвидети важне карактеристике њихове секундарне структуре. Предикција секундарне структуре заснива се на претпоставци да је ЦД спектар протеина, због изразите оптичке активности пептидне хромофоре, одраз његове секундарне структуре. За пептидну хромофору карактеристични су n -> π* прелаз на 220nm и π -> π* прелаз на 190 nm. Процену структуре протеина се врши помоћу ЦД спектара синтетичких полимера који имају структуру 100% α-хеликса, 100% β-равни, 100% насумичног клупка (случајна структура) итд. Ова фракционална именовања важна су јер упућују на могуће секундарне конформације у којима може бити протеин. На пример, поли-Л-лизин -Шаблон:(Lys)n- може усвојити 3 различите конформације само за различите вредности pH и температуре: насумично клупко на pH 7,0 ; α-хеликс на pH 10,8 ; β-облик на pH 11,1 после загревања до 52°C и хлађења.

ЦД спектар непознатог протеина = fαSα(λ) + fβSβ(λ) + fRCSRC(λ), где су Sα(λ), Sβ(λ), и SRC(λ) изведене из основног спектра поли-Л-лизина. Недостатак ове методе је то што иако је лако добити вредности за Sα(λ), Sβ(λ), и SRC(λ) из директних мерења, оне нису увек усаглашене од једне лабораторије до друге. Такође, мора се узети у обзир и дужина ланца и утицај агрегатног стања овог скупа база спектра. Међутим, овај метод је обично тачан до 10% за садржај α-хеликса.
На основу ЦД-а не може се тачно рећи на ком месту у молекулу се дати α-хеликси налазе, па чак ни предвидети колико их има. Упркос овоме, ЦД је драгоцен алат, нарочито за показивање конформацијских промена. На пример, може се користити за одређивање зависности секундарне структуре молекула од температуре или концентрације денатурисаних агенаса. На тај начин он може дати важну термодинамичку информацију о молекулу која не може иначе бити лако добивена. Било који покушај испитивања протеина ће довести до закључка да је ЦД значајан за проверавање да ли је дати протеин у својој нативној (савијеној) конформацији пре његовог подвргавања скупим и/или дугим експериментима.
За одређивање секундарне структуре, посматрају се спектри у далекој UV области (190-250 nm) и уколико је протеин у нативној (савијеној) конформацији – пептидна веза ће давати ЦД сигнал.
За одређивање терцијарне структуре, посматрају се ЦД спектри у блиској UV области (250-350 nm) и уколико је протеин у нативној конформацији, ЦД сигнали ће потицати од ароматичних аминокиселина и дисулфидних мостова. Сигнали у области од 250-270 nm потичу од фенилаланина, од 270-290 nm од тирозина и од 280-300 nm од триптофана. Дисулфидне везе дају широке, слабе сигнале у целој блиској UV области. Уколико не постоји никакав сигнал у области од 250-350 nm, значи да се протеин не налази у нативној конформацији.[2].
ЦД даје мање специфичну информацију о структури од нпр. рендгено-структурне анализе или НМР спектроскопије протеина, које дају податке о атомима. Међутим, ЦД спектроскопија је брза метода, која не захтева велике количине протеина, нити дугу обраду података. ЦД се може користити за испитивање услова растворљивости, промене температуре, pH, јонске јачине и присуства различитих фактора.
ЦД спектроскопија се обично користи за проучавање протеина у растворима, и као допунска метода за проучавање чврстог стања. Овде такође постоји ограничење, јер се многи протеини убачени у мембране налазе у свом нативном стању, па су раствори мембрана нехомогени због чега расејавају светлост. ЦД се понекад мери у танким филмовима.
Експериментална ограничења
[уреди | уреди извор]ЦД може да се користи и за проучавање угљених хидрата, али са ограниченим успехом због тешкоћа повезаних са снимањем ЦД спектра у вакуум ултраљубичастој (VUV) области спектра (100-200 nm), где одговарајуће ЦД траке несупституисаних угљених хидрата леже. Спектри супституисаних угљених хидрата са тракама изнад VUV области се успешно снимају .
Мерења ЦД-а такође су компликована због чињенице да водени јонски пуферски системи често апсорбују у области где структурне особине показују различиту апсорпцију кружно поларизоване светлости. При снимању ЦД спектара фосфатних, сулфатних, карбонатних и ацетатних јона морају се користити веома разблажени раствори. Борати и амонијум соли се често користе за одређивање одговарајуће pH области за ЦД пробе. За повећање јонске јачине, неки експериментатори замењују хлоридни јон флуоридним, јер флуоридни јон апсорбује мање у далекој UV области, а неки раде у чистој води. Други начин да се минимизира апсорпција растварача је примена ужих ћелија, чиме се смањује пут светлости кроз испитивани узорак (обично када се ради у далекој UV области користе се ћелије ширина до 0,1 mm ).
ЦД спектри протеина коришћени за процену секундарне структуре повезани су са π - π* прелазима, који су последица апсорпције амидне везе. Ове апсорпционе траке леже делимично у вакуумској ултраљубичастој области (таласне дужине мање од 200 nm). Област ове таласне дужине је неприступачна због снажне апсорпције кисеоника, тако да је снимање на инструментима ослобођеним од кисеоника (пуњеним чистим гасом азотом) неопходно.
Када је уклоњен кисеоник, други најважнији технички фактор у раду испод 200 nm је да остатак оптичког система има мање губитке у овој области. Зато треба користити алуминизирана огледала чији премази су оптимизирани за низак губитак у овој области спектра.
Такође је потребно да се достигне адекватан однос сигнал-шум (S/N је пропорционално квадратном корену дела времена за које се снима спектар). Зато је потребно 30-60 мин. да се сниме спектри за одређивање секундарне структуре (плус исти део времена за базну линију за сваки ЦД спектрометар).
Уобичајен извор светлости у овим инструментима је кратко-лучна ксенонска лампа под високим притиском. Обичне ксенонске лучне лампе су неприкладне за употребу у далекој UV области. Уместо специјално саграђених лампи са омотима направљеним од синтетике високе чистоће, растопљени силикати морају бити употребљени. Светлост са извора синхротрона има много већи флукс на краћим таласним дужинама и коришћена је за ЦД испод 160 nm.
На нивоу квантне механике, садржај информација ЦД-а и оптичке ротације је идентичан.
Извори
[уреди | уреди извор]- ^ Fasman, G.D. (1996). Circular dichroism and Conformational Analysis of Biomolecules. New York: Plenum press.
- ^ а б в г А. Поповић-Бијелић, М. Мојовић (2007). Практикум из биофизичке хемије. Београд: Универзитет у Београду- Факултет за физичку хемију.
- ^ Hecht, E. (1998). Optics (3rd изд.). Massachusetts. Непознати параметар
|publication=игнорисан (помоћ) - ^ „Circular dichroism spectroscopy”.[мртва веза]
- ^ „www.newark.rutgers.edu/chemistry/grad/chem585/lecture1.html”. Архивирано из оригинала 12. 09. 2006. г. Приступљено 04. 06. 2007.
Литература
[уреди | уреди извор]- Fasman, G.D. (1996). Circular dichroism and Conformational Analysis of Biomolecules. New York: Plenum press.
- А. Поповић-Бијелић, М. Мојовић (2007). Практикум из биофизичке хемије. Београд: Универзитет у Београду- Факултет за физичку хемију.
- Hecht, E. (1998). Optics (3rd изд.). Massachusetts. Непознати параметар
|publication=игнорисан (помоћ)
Спољашње везе
[уреди | уреди извор]- Circular Dichroism explained - A commercial supplier's site, but very good information with examples, etc.
- Circular Dichroism at UMDNJ - a good site for information on structure estimation software
- Electromagnetic waves - Animated electromagnetic waves




![{\displaystyle [\theta ]=3,298.2\Delta \epsilon \,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1617cb157bd170358ce43690a0574e8587a5948b)





![{\displaystyle [\theta ]={\frac {100\theta }{Cl}}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec21d26e0b12e81313ef0b42bbb5ec4f63369c3d)
![{\displaystyle [\theta ]=100\Delta \epsilon \left({\frac {ln10}{4}}\right)\left({\frac {180}{\pi }}\right)=3,298.2\Delta \epsilon \,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa973494c7b9c07fbb86f402a25a9de37e91bc03)