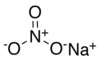
Натријум нитрат

| |||
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
Natrijum nitrat
| |||
| Други називи
Перуванска шалитра
Содни нитер кубиц нитер | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.028.686 | ||
| EC број | 231-554-3 | ||
| Е-бројеви | Е251 (конзерванси) | ||
| RTECS | WЦ5600000 | ||
| УНИИ | |||
| УН број | 1498 | ||
| |||
| Својства | |||
| NaNO3 | |||
| Моларна маса | 84,9947 g/mol | ||
| Агрегатно стање | Бели прах или безбојни кристали | ||
| Мирис | сладак | ||
| Густина | 2,257 g/cm3, čvrst | ||
| Тачка топљења | 308 °C (586 °F; 581 K) | ||
| Тачка кључања | 380 °C (716 °F; 653 K) razlaže se | ||
| 73 г/100 мЛ (0 °C) 92.1 г/100 мл (25 °C) 180 г/100мЛ (100 °C) | |||
| Растворљивост | веома растворан у амонијаку; растворан у алкохолу | ||
| −25,6·10−6 cm3/mol | |||
| Индекс рефракције (nD) | 1,587 (тригонални) 1,336 (ромобохедрални) | ||
| Вискозност | 2,85 cP (317 °C) | ||
| Структура | |||
| Кристална решетка/структура | тригонални и ромбохедрални | ||
| Термохемија | |||
| Специфични топлотни капацитет, C | 93,05 J/(mol K) | ||
| Стандардна моларна ентропија S |
116 J/(mol K)[3] | ||
Стд енталпија
формирања (ΔfH⦵298) |
−467 kJ/mol[3] | ||
Гибсова слободна енергија (ΔфГ˚)
|
−365,9 kJ/mol | ||
| Opasnosti | |||
| Opasnost u toku rada | Štetan (Xn) Oksidant (O) | ||
| Bezbednost prilikom rukovanja | ICSC 0185 | ||
| GHS grafikoni |  
| ||
| NFPA 704 | |||
| Tačka paljenja | Nezapaljiv | ||
| Letalna doza ili koncentracija (LD, LC): | |||
LD50 (LD50)
|
3236 mg/kg | ||
| Сродна једињења | |||
Други ањони
|
Натријум нитрит | ||
Други катјони
|
Литијум нитрат Калијум нитрат Рубидијум нитрат Цезијум нитрат | ||
Сродна једињења
|
Натријум сулфат Натријум хлорид | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||

Натријум нитрат NaNO3 је важан нитрат који се јавља у природи.[4] Ова со алкалног металног нитрата је исто тако позната као чилеанска шалитра (чији масивни депозити су историјски ископавани у Чилеу)[5][6] да би се разликовала од обичне шалитре, калијум нитрата. Његова минерална форма је исто тако позната као нитратин, нитратит или содни нитер. Мањих налазишта има у Египту, Малој Азији, Колумбији и Калифорнији, али од техничког значаја су само налазишта у Чилеу.
Натријум нитрат је бела чврста материја која је веома растворна у води. Он је лако доступан извор нитратног ањона (NO3−), који је користан у неколико реакција које се изводе на индустријским размерама за производњу ђубрива, пиротехнике и димних бомби, стаклених и керамичких емајла, конзерванаса хране (посебно меса), и као чврсто ракетно гориво. За те сврхе је екстензивно ископаван.
Историја[уреди | уреди извор]
Прва пошиљка перуанске слатине у Европи стигла је у Енглеску 1820. или 1825. године, непосредно након стицања независности те земље од Шпаније, али није пронашла купце и бачена је у море како би избегла царинска накнада.[7][8] Међутим, временом је рударство јужноамеричке слатине постало профитабилан посао (године 1859. сама Енглеска је потрошила 47.000 тона[8]). Чиле се борио у Пацифичком рату (1879-1884) против савезничких снага Перуа и Боливије и преузео је њихове најбогатије наслаге шалитре. Године 1919, Ралф Валтер Грејстон Викоф је одредио кристалну структуру натријум нитрата користећи рендгенску кристалографију.
Добијање[уреди | уреди извор]
Највеће акумулације природног натријум нитрата налазе се у Чилеу и Перуу, где су соли нитрата везане унутар минералних наслага званих калишна руда.[9] Нитрати се акумулирају на копну путем таложења морске магле и оксидације/десикације морског спреја, након чега следи гравитационо таложење NaNO3, KNO3, NaCl, Na2SO4, и I у врућој сувој пустињској атмосфери.[10] Екстремни циклуси Ел Нињо/Ла Ниња безводности/ бујичних киша фаворизују акумулацију нитрата кроз аридност и водено растварање/ремобилизацију/транспорт на падине и у сливове; покретањем капиларног раствора формирају се слојеви нитрата; чисти нитрат формира ретке вене. Током више од једног века, светско снабдевање овим једињењем је омогућавано скоро искључиво ископавањем из пустиње Атакама у северном Чилеу, док су, на почетку 20. века, немачки хемичари Фриц Хабер и Карл Бош развили процес за производњу амонијака из атмосфере у индустријским размерама (види Хаберов процес). Са почетком Првог светског рата, Немачка је почела да претвара амонијак из овог процеса у синтетичку чилеанску шалитру, која је била практична као природно једињење у производњи барута и друге муниције. До 1940-их, овај процес конверзије резултирао је драматичним падом потражње за натријум нитратом набављеним из природних извора.
Чиле и даље има највеће резерве каличе, са активним рудницима на местима као што су Педро де Валдивија, Марија Елена и Пампа Бланка, и тамо се она некада називала белим златом.[5][6] Натријум нитрат, калијум нитрат, натријум сулфат и јод се добијају обрадом каличе. Некадашње чилеанске шалитрене рударске заједнице Хумберстона и Санта Лаура проглашене су за Унесковим локацијама светске баштине 2005. године.
Сирова чилска шалитра већином није чиста, него се јавља са пијеском и глином, те разним другим солима (најчешће натријум хлоридом). Осим тога садржи примесе натријум-, магнезијум- и калцијум- сулфата и малим количинама калцијум јодата, те је сива или смеђа камена маса. Из овог материјала добија се натријум нитрат излуживањем врућом водом. Притом се настали раствор натријум нитрата филтрира да се одвоји глинени муљ и заостали нерастворени натријум хлорид, а затим се хлади при чему кристализира. Добивени натријум нитрат је 98% чист. Матични лугови садрже натријум јодат и служе за добијање јода.[11]
У Немачкој се натријум нитрат добија претежно из соде са азотном киселином:
- Na2CO3 + 2 HNO3 → 2 NaNO3 + H2O + CO2
- HNO3 + NaHCO3 → NaNO3 + H2O + CO2
и то тако да се нитрозни отпадни плинови од оксидације амонијака апсорбирају у раствору соде. Притом настали раствор нитрита и нитрата (Na2CO3 + 2 NO2 → NaNO2 + NaNO3 + CO2) се закисели азотном киселином и оксидира се у ваздуху у нитрат, који се содом неутралише и упари у вакуумским испаривачима.
Натријум нитрат се такође индустријски синтетише неутрализацијом азотне киселине натријум хидроксидом (међутим, ова реакција је веома егзотермна):
- HNO3 + NaOH → NaNO3 + H2O
или мешањем стехиометријских количина амонијум нитрата и натријум хидроксида, натријум бикарбоната или натријум карбоната:
- NH4NO3 + NaOH → NaNO3 + NH4OH
- NH4NO3 + NaHCO3 → NaNO3 + NH4HCO3
- 2NH4NO3 + Na2CO3 → 2NaNO3 + (NH4)2CO3
Особине[уреди | уреди извор]
Натријум нитрат кристализира из воденог раствора у облику безбојних, коцкастих ромбоедара (кубична шалитра), који имају тачку топљења на 307 °C, а код 380 °C почињу да се деградирају. У води се лако раствара и растворљивост му јако расте са порастом температуре.[12]
Употреба[уреди | уреди извор]
Већи део чилске шалитре раније се користио за производњу ђубрива, остали део се употребљавао за добијање азотне киселине и калијумове шалитре. Данас натријум-нитрат има значај само као вештачко ђубриво.
Натријум нитрат се може комбиновати са сумпорном киселином и азотна киселина се може издестилисати. При нижем притиску потребна је нижа температура, што доводи до мањег распадања. Теоретски 2 мола азотне киселине на 1 мол сумпорне киселине доводи до врло високе крајње температуре, великог распадања и чврстог неутралног сулфата који је тешко уклонити. Када је ова реакција била индустријски важна, уобичајена је пракса била да се ради са сумпорном киселином у вишку, и да се оконча са претежно бисулфатним продуктом који се растопљен изливао из реторте. Прерађивачи злата, који се тиме баве као хоби, користе натријум нитрат да би направили хибридну царску воду која раствара злато и друге метале.
Натријум нитрат је такође прехрамбени адитив који се користи као конзерванс и средство за фиксирање боје у сувом месу и живини. Он је наведен под бројем INS 251 или као Е број Е251. Одобрен је за употребу у ЕУ,[13] САД[14] и Аустралији и Новом Зеланду.[15] Натријум нитрат не треба поистовећивати са натријум нитритом, који је такође уобичајен прехрамбени адитив и конзерванс који се користи, на пример, у месним деликатесама.
Мање уобичајене примене су као оксиданс у ватромету, при чему замењује калијум нитрат, који се обично налази у црном праху, и као компонента у инстант хладним паковањима.[16]
Здравствени проблеми[уреди | уреди извор]
Студије су показале везу између повећаних нивоа нитрата и повећане смртности од одређених болести укључујући Алзхеимерову болест, дијабетес, рак желуца и Паркинсонову болест. Могући узроци су штетан утицај нитрозамина на ДНК, међутим, мало је урађено на контроли других могућих узрока у епидемиолошким резултатима.[17] Нитросамини, формирани у сувом месу које садрже натријум нитрат и нитрит, су били повезани са раком желуца и раком једњака.[18] Натријум нитрат и нитрит су повезани са повећаним ризиком од рака дебелог црева.[19]
Један од разлога што обрађено месо повећава ризик од рака дебелог црева је његов садржај нитрата. Мала количина нитрата који се додаје месу као конзерванс разлаже се у нитрит, поред било ког нитрита који се такође може додати. Нитрит затим реагује са храном богатом протеинима (као што је месо) чиме се формирају канцерогена нитрозо једињења. Ова једињења се могу формирати при преради меса или у телу док се месо вари.[20]
Референце[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Еван Е. Болтон; Yанли Wанг; Паул А. Тхиессен; Степхен Х. Брyант (2008). „Цхаптер 12 ПубЦхем: Интегратед Платформ оф Смалл Молецулес анд Биологицал Ацтивитиес”. Аннуал Репортс ин Цомпутатионал Цхемистрy. 4: 217—241. дои:10.1016/С1574-1400(08)00012-1.
- ^ а б Зумдахл, Стевен С. (2009). Цхемицал Принциплес 6тх Ед. Хоугхтон Миффлин Цомпанy. стр. А23. ИСБН 978-0-618-94690-7.
- ^ Хоусецрофт, C. Е.; Схарпе, А. Г. (2008). Инорганиц Цхемистрy (3. изд.). Прентице Халл. ИСБН 978-0-13-175553-6.
- ^ а б „Тхе Нитрате Тоwнс оф Цхиле”. Атлас Обсцура (на језику: енглески). Приступљено 27. 5. 2019.
- ^ а б Мутиц, Ања (26. 10. 2012). „Тхе гхост тоwнс оф нортхерн Цхиле”. Wасхингтон Пост (на језику: енглески). Приступљено 27. 5. 2019.
- ^ С. Х. Баекеланд "Нåгра сидор аф ден кемиска индустриен" (1914) Свенск Кемиск Тидскрифт, п. 140.
- ^ а б Фриедрицх Георг Wиецк, Уппфиннингарнас бок (1873, Сwедисх транслатион оф Буцх дер Ерфиндунген), вол. 4, п. 473.
- ^ Степхен Р. Боwн, А Мост Дамнабле Инвентион: Дyнамите, Нитратес, анд тхе Макинг оф тхе Модерн Wорлд, Мацмиллан. 2005. ISBN 0-312-32913-X. стр. 157..
- ^ Ариас, Јаиме (24. 7. 2003). Он тхе Оригин оф Салтпетер, Нортхерн Цхиле Цоаст. Интернатионал Унион фор Qуатернарy Ресеарцх. Архивирано из оригинала 04. 03. 2016. г. Приступљено 19. 8. 2018.
- ^ Паркес, Г.D. & Пхил, D. (1973). Мелорова модерна неорганска хемија. Београд: Научна књига.
- ^ Лиде Давид Р., ур. (2006). ЦРЦ Хандбоок оф Цхемистрy анд Пхyсицс (87тх изд.). Боца Ратон, ФЛ: ЦРЦ Пресс. ISBN 978-0-8493-0487-3.
- ^ UK Food Standards Agency: „Current EU approved additives and their E Numbers”. Приступљено 27. 10. 2011.
- ^ US Food and Drug Administration: „Listing of Food Additives Status Part II”. Приступљено 27. 10. 2011.
- ^ Australia New Zealand Food Standards Code„Standard 1.2.4 - Labelling of ingredients”. Приступљено 27. 10. 2011.
- ^ Albert A. Robbins "Chemical freezing package" U.S. Patent 2.898.744, Issue date: August 1959.
- ^ De La Monte, SM; Neusner, A; Chu, J; Lawton, M (2009). „Epidemilogical trends strongly suggest exposures as etiologic agents in the pathogenesis of sporadic Alzheimer's disease, diabetes mellitus, and non-alcoholic steatohepatitis”. Journal of Alzheimer's Disease. 17 (3): 519—29. PMC 4551511
 . PMID 19363256. doi:10.3233/JAD-2009-1070.
. PMID 19363256. doi:10.3233/JAD-2009-1070.
- ^ Jakszyn, Paula; Gonzalez, Carlos-Alberto (21. 7. 2006). „Nitrosamine and related food intake and gastric and oesophageal cancer risk: a systematic review of the epidemiological evidence”. World Journal of Gastroenterology. 12 (27): 4296—4303. PMC 4087738
 . PMID 16865769. doi:10.3748/wjg.v12.i27.4296. Архивирано из оригинала 14. 10. 2018. г. Приступљено 18. 06. 2019.
. PMID 16865769. doi:10.3748/wjg.v12.i27.4296. Архивирано из оригинала 14. 10. 2018. г. Приступљено 18. 06. 2019.
- ^ Cross, AJ; Ferrucci, LM; Risch, A; Graubard, BI; Ward, MH; Park, Y; Hollenbeck, AR; Schatzkin, A; Sinha, R (2010). „A large prospective study of meat consumption and colorectal cancer risk: An investigation of potential mechanisms underlying this association”. Cancer Research. 70 (6): 2406—14. PMC 2840051
 . PMID 20215514. doi:10.1158/0008-5472.CAN-09-3929.
. PMID 20215514. doi:10.1158/0008-5472.CAN-09-3929.
- ^ „The Associations between Food, Nutrition and Physical Activity and the Risk of Colorectal Cancer” (PDF). World Cancer Research Fund. 2010. Архивирано из оригинала (PDF) 26. 07. 2019. г. Приступљено 18. 06. 2019.
Literatura[уреди | уреди извор]
- Barnum, Dennis (2003). „Some History of Nitrates”. Journal of Chemical Education. 80 (12): 1393—. Bibcode:2003JChEd..80.1393B. doi:10.1021/ed080p1393.
Spoljašnje veze[уреди | уреди извор]
- ATSDR – Case Studies in Environmental Medicine – Nitrate/Nitrite Toxicity U.S. Department of Health and Human Services (public domain)
- FAO/WHO report
- Calculators: surface tensions, and densities, molarities and molalities of aqueous sodium nitrate