Ribonukleinska kiselina

| Биохемија |
|---|
 |
| Кључне компоненте |
| Историја и теме |
| Портали: Биологија, Хемија, MCB |
Ribonukleinska kiselina (RNK) je biološki važan tip molekula koje imaju značajnu ulogu u kodiranju, dekodiranju, regulaciji i ekspresiji gena. RNK i DNK predstavljaju dva tipa nukleinskih kiselina, koje sa proteinima spadaju u esencijalne makromolekule svih živih bića. Kao i DNK, molekuli RNK se sastoje od dugih kovalentno vezanih jedinica - nukleotida, s tim što su RNK molekuli najčešće jednolančani. Svaki nukleotid u RNK molekuli se sastoji od heterociklične baze, šećera riboze i fosfatne grupe.
RNK molekuli u ćeliji nastaju transkripcijom (prepisivanjem) DNK pomoću enzima koji se nazivaju RNK polimeraze. Većina gena u DNK molekulu određuje aminokiselinsku sekvencu određenog proteina. RNK molekuli, koji nastaju kao kopije tih gena, a u funkciji su prenosa genetičke informacije sa DNK iz nukleusa (ćelijskog jedra) u proteinski molekul koji se sintetiše u ribozomima, označavaju se kao iRNK (informaciona RNK, kurir, glasnička RNK). Međutim, finalni produkti nekih gena su različiti RNK molekuli koji imaju ili funkcionalnu (enzimatsku) ili strukturnu ulogu u ćeliji. Iako je uloga mnogih od ovih nekodirajućih RNK molekula još nepoznata, poznata je funkcija nekih od njih (npr. transportna RNK - tRNK; ribozomska RNK - rRNK i dr).[1]
Struktura
[uredi | uredi izvor]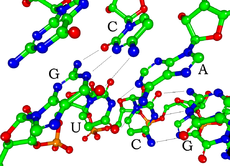
Svaki nukleotid u RNK molekulu (ribonukleotid) sadrži petougljenični šećer ribozu, jednu od četiri heterociklične baze (adenin - A, citozin - C, guanin G ili uracil - U) vezanu za ribozu na poziciji prvog atoma ugljenika i fosfatnu grupu vezanu za ribozu na poziciji trećeg atoma ugljika. Preko fosfatne grupe vrši se povezivanje susednih nukleotida fosfodiesterskom vezom na taj način što je fosfatna grupa jednim krajem vezana za trećim C atomom riboze jednog nukleotida, a drugim za petim C atomom riboze susednog nukleotida. Fosfatne grupe imaju negativni naboj, sa pH vrednošću u fiziološkim granicama, čineći RNK molekul polianjonom. RNK molekuli, s obzirom da su jednolančani kao i polipeptidi mogu se savijati u određene trodimenzionalne strukture što je kod nekih RNK molekula i neophodno za ostvarivanje njihove strukturne i katalitičke funkcije. RNK molekuli često sadrže kratke nukleotidne sekvence koje sa komplementarnim sekvencama na drugom delu molekula ostvaruju konvencionalno kovalentno uparivanje baza (između citozina i guanina, kao i između adenina i uracila). Takođe, u formiranju trodimenzionalnih struktura značajne su i nekovalentne interakcije između baza.
Važna strukturna osobina RNK koja je razlikuje od DNK je prisustvo hidroksil grupe na poziciji 2 šećera riboze. Prisustvo ove funkcionalne grupe uzrokuje da zavojnica poprimi geometriju A-forme DNK umesto B-forme koja je obično prisutna u DNK.[2] Ova osobina dovodi do veoma dubokih i uskih velikih žlebova i plitkih a širokih malih žlebova u molekulu.[3] Druga posledica prisustva hidroksilne grupe na drugoj poziciji riboze je ta da u konformaciono fleksibilnim područjima molekula RNK (koja nisu uključena u formiranje trodimenzionalne strukture) može doći do cepanja fosfodiesterskih veza unutar molekula.[4]
Iako u sintezi RNK učestvuju samo četiri baze (adenin, citozin, guanin i uracil),[5] one zajedno sa vezanim šećerom, tokom sazrevanja RNK molekuli mogu biti modifikovani na različite načine. Pseudouridin, u kojem je veza između uracila i riboze izmenjena iz C-N veze u C-C vezu, te ribotimidin (T) su pronađeni na raznim mestima (među najznačajnijim u T?C zavoju u transportnoj RNK).[6] Druga značajna modifikovana baza je hipoksantin, deaminisani adenin čiji se nukleozid naziva inozin (I). Inozin ima ključnu ulogu u dinamičkoj hipotezi genetičkog koda.[7] Poznato je gotovo 100 drugih prirodnih modifikacija nukleosida.[8] Najrazličitije strukturne modifikacije se nalaze u tRNK, a pseudoridin i nukleosid sa 2'-0-metilribozom, često prisutni u rRNK, su najčešće.[9] Specifične uloge mnogih od ovih modifikacija u RNK nisu u potpunosti istražene. Međutim, značajno je da se u ribozomskoj RNK pojavljuju mnoge od posttranskripcijskih modifikacija u visoko funkcionalnim područjima, poput središta peptidil transferaze, što vodi do zaključka da su veoma važne za normalne funkcije.[10]
Funkcionalna forma jednostruko uvijenog molekula RNK, poput belančevina, često da zahteva određene tercijarne RNK strukture. Osnova za ovu strukturu je zasnovana na sekundarnim strukturnim elementima koji su u principu vodonikove veze unutar molekula. Ovo dovodi do nekoliko prepoznatljivih domena sekundarne strukture poput zašiljenih prstenova, unutrašnjih prstenova i deformacija.[11] Pošto je RNK molekul sa naelektrisanjem, joni metala poput magnezijuma Mg2+ su neophodni za stabilizaciju mnogih sekundarnih i tercijarnih struktura.[12]
Primarna i sekundarna struktura RNK
[uredi | uredi izvor]U izgradnji molekula RNK (ribonukleinske kiseline) učestvuju pentozni šećer riboza, purinske baze adenin i guanin i pirimidinske baze, citozin i uracil, koji je karakterističan za ribonukleinske kiseline.
RNK su jednolančani molekuli koji nastaju tako što se nukleotidi povezuju fosfodiestarskim vezama čineći tako primarnu strukturu RNK. Priroda ovih veza je ista kao u DNK, samo što umesto dezoksiriboze učestvuje riboza. Unutar ovih jednolančanih molekula komplementarne baze mogu da nagrade kraće ili duže dvolančane, spiralizovane delove spajajući se vodoničnim vezama (adenin je vezan dvostrukom vodoničnom vezom sa uracilom, dok je guanin vezan trostrukom vezom sa citozinom). Ti dvolančani delovi čine sekundarnu strukturu RNK.
Poređenje sa DNK
[uredi | uredi izvor]
RNK i DNK su nukleinske kiseline, ali se razlikuju u tri važna elementa.
- Prvo, za razliku od DNK koja je dvostruka zavojnica, molekul RNK je jednostruko uvijen u većini svojih bioloških uloga i ima daleko manji lanac nukleotida (ne više od nekoliko hiljada nukleotida). Ipak, na osnovu komplementarnog uparivanja baza, unutar RNK molekule se, kao u tRNK, formiraju unutrašnji dvolančani segmenti.
- Drugo, dok DNK sadrži petougljenični šećer dezoksiribozu, RNK sadrži ribozu (koja za razliku od dezoksiriboze ima hidroksilnu funkcionalnu grupu spojenu na pentozni prsten na poziciji 2'). Ove hidroksilne grupe čine RNK manje stabilnom molekulom od DNK, jer su daleko podložnije hidrolizi.
- Treće, komplementarna baza adeninu nije timin, kao što je slučaj kod DNK, nego je uracil, koji je nemetilirana forma timina.[13]
Biološki najaktivniji RNK molekuli poput iRNK, tRNK, rRNK, male nuklearne RNK i druge nekodirajuće RNK, sadrže sekvence komplementarne sebi koje omogućavaju delovima RNK da se uparuju obrazujući na taj način dvostruke zavojnice. Analiza ovih RNK je otkrila da su one veoma kompleksno struktuirane. Na ovaj način RNK molekuli imaju hemikatalitičku sposobnost.[14] Na primer, analizom strukture ribozima, enzima koji katalizuju formiranje peptidne veze, otkriveno je da je njegovo aktivno mesto sastavljeno u potpunosti od RNK.[15]
Sinteza
[uredi | uredi izvor]Sintezu RNK katalizira djelovanje enzima - RNK polimeraza - koristeći jedan od lanaca DNK (kodirajući, matrični lanac) kao šablon, što je proces označen kao transkripcija. Uspešna transkripcija je esencijalna za gensku ekspresiju s obzirom da je to glavni momenat u kome ćelija reguliše koje proteine će proizvoditi i kojom stopom produkcije. Uspešna transkripcija gena zahteva da RNK polimeraze precizno deluju, a način na koji se to delovanje ostvaruje se razlikuje kod prokariota i eukariota. Početak trankripcije određuje vezanje enzima na specifičnu sekvencu nukleotida koja predstavlja startnu tačku RNK sinteze promoter na DNK molekulu. Dvostruka zavojnica DNK se odmotava delovanjem enzima helikaze. Enzim zatim na matričnom lancu napreduje u 3' prema 5' smeru, sintetišući komplementarni RNK molekul ugradnjom novih ribonukleotida u smeru od 5' prema 3' kraju. DNK sekvenca takođe određuje kada će se desiti prekid sinteze RNK[16]. Novonastali RNK lanac se odmah po završetku transkripcije odvaja od DNK matrice što omogućava produkciju velikog broja RNK kopija sa istog gena u relativno kratkom vremenu. Primarni transkript se često modifikuje nakon transkripcije delovanjem enzima. Na primer, poliadeninski - poli(A) rep i 5' kapa se dodaju na pre-RNK a introni bivaju eliminisani.
Postoji i veliki broj RNK zavisnih RNK polimeraza koje koriste RNK kao svoj šablon za sintezu novih lanaca RNK. Na primer, veliki broj RNK virusa (kao što je poliovirus) koriste ovaj tip enzima za replikovanje svog genetičkog materijala.[17] Takođe, RNK zavisna RNK polimeraza je deo RNK interferencije u mnogim organizmima.[18]
Vrste i uloge RNK
[uredi | uredi izvor]
Po ulozi koju u ćeliji imaju i po svom prostornom izgledu, RNK se deli na: informacionu, transportnu i ribozomsku. Sve tri vrste nastaju prepisivanjem (transkripcija) određenih delova jednog lanca DNK, odnosno prepisivanjem gena, tako da RNK predstavljaju kopije pojedinih gena.
Informaciona RNK (iRNK) nastaje prepisivanjem strukturnih gena koji sadrže uputstvo za sintezu proteina. Uloga iRNK je da to uputstvo (informaciju) za sintezu proteina prenese do ribozoma (mesto sinteze proteina). Sinteza iRNK počinje onda kada je ćeliji potreban neki protein, a kada se obezbedi dovoljna količina proteina iRNK biva razgrađena.
Transportna RNK (tRNK) nastaje prepisivanjem male grupe specifičnih gena. Transportna RNK ima dvostruku ulogu: prevodi uputstvo za sintezu proteina sa iRNK u redosled aminokiselina u proteinu i prenosi aminokiseline do ribozoma.
Ribozomska RNK (rRNK) nastaje prepisivanjem gena koji se zajednički nazivaju »organizatori jedarceta«. Njena uloga je da zajedno sa određenim proteinima nagradi ribozome.
Ćelije jednog organizma se međusobno razlikuju po iRNK i tRNK koje sadrže dok su rRNK i DNK u svim ćelijama jednog organizma iste.
Informaciona RNK
[uredi | uredi izvor]Informaciona RNK (iRNK) je tip RNK molekula koja prenosi genetičku informaciju od DNK do ribozoma, ćelijskih organela na kojima se vrši sinteza belančevina (translacija). Kodirajuća sekvenca iRNK određuje sekvencu aminokiselina u novosintetiziranim belančevinama.[19] Međutim, mnogi RNK molekuli ne kodiraju proizvodnju belančevina (oko 97% transkripcijskih produkata ne kodiraju belančevine u eukariotskim ćelijama.[20][21][22][23])
Nekodirajuće RNK (nkRNK)
[uredi | uredi izvor]Ove takozvane nekodirajuće RNK (nkRNK) kodiraju RNK geni[24]. Najpoznatiji primeri nekodirajućih RNK su transportne RNK (tRNK) i ribozomske RNK (rRNK), obe su uključene u proces translacije.[13] Postoje i nekodirajuće RNK koje su uključene u regulaciju gena, procesiranje RNK i druge uloge. Određeni RNK molekuli imaju mogućnost da kataliziraju hemijske reakcije poput isecanja i vezivanja drugih RNK molekula,[25] te katalizu formiranja peptidnih veza u ribozomima;[15] ove RNK su poznate kao ribozimi.
Translacija
[uredi | uredi izvor]Informaciona RNK (iRNK) prenosi genetičku informaciju, predstavljenu sekvencom nukleotida DNK molekule, do ribozoma, organela u ćeliji, gde određuje ugradnju određenih aminokiselina u polipeptidni molekul. Redosled od tri nukleotida (kodon) u iRNK određuje ugradnju određene aminokiseline u polipeptidni lanac. U eukariotskim ćelijama, nakon transkripcije i sinteze primarnog transkripta (pre-iRNK) brojnim procesima i modifikacijama se ona dorađuje do konačne forme iRNK. Ovi procesi između ostalog uključuju i uklanjanje initrona - nekodirajućih delova primarnog transkripta. Nakon toga iRNK prolazi iz ćelijskog jedra u citoplazmu, gde se veže za ribosome i translira u odgovarajuću belančevinu uz pomoć transportne RNK (tRNK). U prokariotskim ćelijama, koje nemaju ćelijsko jedro, iRNK se može vezati za ribozome tokom transkripcije. Nakon određenog vremena, iRNK se degradiraju u svoje nukleotidne komponente uz pomoć ribonukleaze[19].
Transportna RNK (tRNK) je RNK lanac od oko 80 nukleotida koji prenosi određenu aminokiselinu u rastući polipeptidni lanac prilikom translacije. Transportna RNK ima mesto za vezanje specifične aminokiselina i antikodon - region za prepoznavanje kodona u lanacu iRNK.[24]
Ribozomska ribonukleinska kiselina (rRNK) je katalitička i strukturna komponenta ribozoma. Eukariotski ribozomi sadrže četiri različita rRNK molekula: 18S, 5.8S, 28S i 5S rRNK. Kod eukariota geni za rRNK (osim za 5S rRNK) mogu biti locirani na više hromosoma, na tzv. nukleolarnim delovima genoma koji učestvuju u formiranju nukleolusa (jedarceta. Geni za rRNK, uključujući i one za 5S rRNK koja se sintetiša odvojeno od ostalih rRNK, su visoko repetitivni, tako da ćelija sisara može da sadrži od 100 do 2000 kopija rRNK gena. U citoplazmi, rRNK i belančevine se kombinuju u nukleobelančevinaste strukture - ribozome. Ribozomi vežu iRNK, a u njima se odvija sinteza belančevina. Nekoliko ribozoma može biti istovremeno vezano na jednu iRNK.[19] Ribozomska RNK je glavni proizvod transkripcije i čini 80-90% ukupne RNK ekstrahovane iz tipične eukariotske ćelije.[26]
Transportno-informaciona RNK (tiRNK) pronađena je u mnogim bakterijama i plastidima. Ona označava belančevine koje kodira iRNK, a kojima nedostaju stop kodoni za degradaciju i preventira odugovlačenje rada ribosoma.[27]
Vidi još
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. (2008): Molecular Biology of the Cell, 5th edition, Garland Science, Taylor & Francis Group New York, USA.
- ^ Salazar M, Fedoroff OY, Miller JM, et al. (1992). „The DNA strand in DNAoRNA hybrid duplexes is neither B-form nor A-form in solution”. Biochemistry. 32 (16): 4207—15.
- ^ Hermann T, Patel DJ (2000). „RNA bulges as architectural and recognition motifs”. Structure. 8 (3): R47—R54.
- ^ Mikkola S, Nurmi K, Yousefi-Salakdeh E, et al. (1999). „The mechanism of the metal ion promoted cleavage of RNA phosphodiester bonds involves a general acid catalysis by the metal aquo ion on the departure of the leaving group”. Perkin transactions 2: 1619—26.
- ^ Jankowski JA, Polak JM (1996). Clinical gene analysis and manipulation: Tools, techniques and troubleshooting. Cambridge University Press. стр. 14. ISBN 0-521-47896-0
- ^ Yu Q, Morrow CD (2001). „Identification of critical elements in the tRNA acceptor stem and T?C loop necessary for human immunodeficiency virus type 1 infectivity”. J Virol. 75 (10): 4902—6.
- ^ Elliott MS, Trewyn RW (1983). „Inosine biosynthesis in transfer RNA by an enzymatic insertion of hypoxanthine”. J. Biol. Chem. 259 (4): 2407—10.
- ^ Söll D, RajBhandary U (1995). TRNA: Structure, biosynthesis, and function. ASM Press. str. 165. ISBN 1-55581-073-X
- ^ Kiss T (2001). „Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs”. The EMBO Journal. 20: 3617—22.
- ^ King TH, Liu B, McCully RR, Fournier MJ (2002). „Ribosome structure and activity are altered in cells lacking snoRNPs that form pseudouridines in the peptidyl transferase center”. Molecular Cell. 11 (2): 425—35.
- ^ Mathews DH, Disney MD, Childs JL, et al. (2004). „Incorporating chemical modification constraints into a dynamic programming algorithm for prediction of RNA secondary structure”. Proc. Natl. Acad. Sci. USA. 101 (19): 7287—92.
- ^ Tan ZJ, Chen SJ (2008). „Salt dependence of nucleic acid hairpin stability”. Biophys. J. 95 (2): 738—52.
- ^ a b Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (5. izd. izd.). WH Freeman and Company. str. 118-19, 781-808. ISBN 0-7167-4684-0
- ^ Higgs PG (2000). „RNA secondary structure: physical and computational aspects”. Quarterly Reviews of Biophysics. 33 (3): 199—253. PMID 11191843. doi:10.1017/S0033583500003620.
- ^ a b Nissen P, Hansen J, Ban N, et al. (2000). „The structural basis of ribosome activity in peptide bond synthesis”. Science. 289 (5481): 920—30.
- ^ Nudler E, Gottesman ME (2002). „Transcription termination and anti-termination in E. coli”. Genes to Cells. 7: 755—68.
- ^ Jeffrey LH, Alexander ML, Steve CS (1997). „Structure of the RNA-dependent RNA polymerase of poliovirus”. Structure. 5 (8): 1109—22.
- ^ Ahlquist P (2002). „RNA-Dependent RNA Polymerases, Viruses, and RNA Silencing”. Science. 296 (5571): 1270—73.
- ^ a b v Cooper GC, Hausman RE (2004). The Cell: A Molecular Approach (3. izd. izd.). Sinauer. str. 261-76, 297, 339-44. ISBN 0-87893-214-3
- ^ Mattick JS, Gagen MJ (1. 9. 2001). „The evolution of controlled multitasked gene networks: the role of introns and other noncoding RNAs in the development of complex organisms”. Mol. Biol. Evol. 18 (9): 1611—30.
- ^ Mattick, J.S. (2001). "Noncoding RNAs: the architects of eukaryotic complexity" Arhivirano 2005-12-27 na sajtu Wayback Machine, EMBO Reports, 2(11), 986-991.
- ^ Mattick, J.S. (2003). "Challenging the dogma: The hidden layer of non-protein-coding RNAs on complex organisms" Arhivirano 2009-03-06 na sajtu Wayback Machine, Bioessays. 25, 930-939.
- ^ Mattick, J.S. (2004): "The hidden genetic program of complex organisms", Scientific American. 291(4), 30-37.
- ^ а б Wirta W (2006). Mining the transcriptome - methods and applications (PDF). Stockholm: School of Biotechnology, Royal Institute of Technology. ISBN 91-7178-436-5
- ^ Rossi, JJ (2004). „Ribozyme diagnostics comes of age”. Chemistry & Biology. 11 (7): 894—95.
- ^ Kampers, T.; Friedhoff, P.; Biernat, J.; Mandelkow, E. -M.; Mandelkow, E.; et al. (1996). „RNA stimulates aggregation of microtubule-associated protein tau into Alzheimer-like paired helical filaments”. FEBS Letters. 399 (3): 104D. Bibcode:1996FEBSL.399..344K. doi:10.1016/S0014-5793(96)01386-5.
- ^ Gueneau De Novoa, P.; Williams, K. P. (2004). „The tmRNA website: reductive evolution of tmRNA in plastids and other endosymbionts”. Nucleic Acids Res. 32 (Database issue): D104—8. PMC 308836
 . PMID 14681369. doi:10.1093/nar/gkh102.
. PMID 14681369. doi:10.1093/nar/gkh102.
Spoljašnje veze
[uredi | uredi izvor]- RNA World website Link collection (structures, sequences, tools, journals)
- Nucleic Acid Database Images of DNA, RNA and complexes.
- Anna Marie Pyle's Seminar: RNA Structure, Function, and Recognition
