Оксид

Оксид је општи назив за свако неорганско хемијско једињење, у коме се јавља хемијска веза између кисеоника и неког другог елемента.[1] Оксиди имају међусобно веома различите хемијске и физичке особине, које зависе од електронегативности елемента који се једини са кисеоником: од скоро нереактивних чврстих супстанција са веома високим температурама топљења (нпр. оксид волфрама), преко умерено реактивних течности (нпр. вода), до веома реактивних гасова (нпр. азот субоксид).
Сам „оксид” је дијон кисеоника, O2– атом. Метални оксиди стога типично садрже анјон кисеоника у оксидационом стању −2. Већи део Земљине коре састоји се од чврстих оксида, који су последица оксидације елемената кисеоником у ваздуху или води. Чак и материјали који се сматрају чистим елементима често стварају оксидни покров. На пример, алуминијумска фолија развија танки слој Al2O3 (звани пасивизациони слој) која штити фолију од даље корозије.[2] Поједини елементи могу да формирају више оксида, разликујући се у количини елемента који се комбинује са кисеоником. Примери су угљеник, гвожђе, азот (погледајте азотне оксиде), силицијум, титанијум и алуминијум. У таквим се случајевима оксиди разликују специфицирањем броја укључених атома, као што је у угљен моноксиду и угљен диоксиду, или навођењем оксидационог броја елемента, као у гвожђе(II) оксиду и гвожђе(III) оксиду.
Оксиди такође могу имати и особине које иду од киселих до базних. Тако постоје:
- кисели оксиди- нпр. угљен-диоксид или сумпор(VI)-оксид, који реагују са базама и водом
- оксиди са киселим особинама - нпр. силицијум оксид, реагују са јаким базама али не и са водом
- базни оксиди- нпр. оксиди метала IА и IIА групе, реагују са киселинама и водом
- оксиди са базним особинама - нпр. манган моноксид или хром моноксид, реагују са киселинама али не и са водом
- амфотерни оксиди - нпр. алуминијум-оксид, не реагују са водом али реагују и са киселинама и са базама
- неутрални оксиди- нпр. угљен-моноксид, не реагују са водом, киселинама ни базама.
Сем оксида постоје пероксиди и супероксиди
Давање имена
[уреди | уреди извор]Постоји неколико начина грађења имена оксида, од којих је већина остала само као навика или у историји.
Тренутно, у складу са номенклатуром IUPAСа, имена оксида се граде по општем шаблону именовања простих неорганских једињења. За оксиде овај шаблон изгледа:
- име_елемента(његов оксидациони број)- оксид
На пример сумпор(IV)-оксид.
У случају, када дати елемент гради само један познати оксид, оксидациони број хемијског елемента не мора да се наводи. Ова номенклатура се тренутно користи у научним круговима.[3]
Многи оксиди имају називе који уопште нису давани по номенклатури већ су од давнина укорењени у народу. На пример: вода је оксид водоника, калцијум(II)-оксид је познат под називом негашени креч.
Формирање
[уреди | уреди извор]Услед његове електронегативности, кисеоник формира стабилне хемијске везе са скоро свим елементима и даје кореспондирајуће оксиде. Племенити метали (као што су злато или платина) су цењени зато што су они отпорни на директно хемијско комбиновање са кисеоником, и супстанце као што је гвожђе(III) оксид морају се формирати индиректним путем.
Два независна пута за корозију елемената су хидролиза и оксидација кисеоником. Комбинација воде и кисеоника је још корозивнија. Готово сви елементи сагоревају у атмосфери кисеоника или окружењу богатом кисеоником. У присуству воде и кисеоника (или једноставно ваздуха), неки елементи - натријум - брзо реагују, дајући хидроксиде. Делом се из тог разлога алкални и земноалкални метали не налазе у природи у свом металном, тј. изворном облику. Цезијум је толико реактиван са кисеоником да се користи као прикупљач у вакуумским цевима, а раствори калијума и натријума, такозвани NaK, се користе за деоксигенацију и дехидрацију неких органских растварача. Површина већине метала састоји се од оксида и хидроксида у присуству ваздуха. Добро познат пример је алуминијумска фолија која је пресвучена танким филмом алуминијум оксида који пасивизира метал, успоравајући даљу корозију. Слој алуминијум оксида може се изградити до веће дебљине поступком електролитичке анодичке оксидације. Иако чврсти магнезијум и алуминијум споро реагирају са кисеоником при СТП - они, као и већина метала, сагоревају у ваздуху, остварујући веома високе температуре. Финозрнати прахови већине метала могу бити опасно експлозивни у ваздуху. Због тога се често користе у ракетама на чврсто гориво.

У сувом кисеонику, гвожђе с лакоћом формира гвожђе(II) оксид, док формирање хидратисаних фери оксида, Fe2O3−x(OH)2x, који углавном сачињавају рђу, типично захтева кисеоник и воду. Продукција слободног кисеоника од стране фотосинтетичких бактерије пре неких 3,5 милијарди година узроковала је таложење гвожђа из раствора у океанима као Fe2O3 у економски важну руду гвожђа хематит.
Структура
[уреди | уреди извор]Оксиди имају опсег различитих структура, од појединачних молекула до полимерних и кристалних структура. У стандардним условима, оксиди могу да се крећу од крутих материја до гасова.
Метални оксиди
[уреди | уреди извор]Оксиди већине метала попримају полимерне структуре.[4] Оксид обично повезује три атома метала (нпр. структура рутила) или шест атома метала (структуре карборундума или камене соли). Пошто су M-O везе обично јаке и ова једињења су умрежени полимери, чврсте супстанце су обично нерастворљиве у растварачима, мада их нападају киселине и базе. Формуле су често варљиво једноставне, при чему су многе од тих материја нестехиометријска једињења.[2]
Молекуларни оксиди
[уреди | уреди извор]- Неки важни гасовити оксиди
-
Угљен диоксид је главни производ сагоревања фосилног горива.
-
Угљен моноксид је производ некомплетног сагоревања горива базираних на угљенику и прекурзор многих корисних хемикалија.
-
Азот диоксид је проблематични загађивач из мотора са унутрашњим сагоревањем.
-
Сумпор диоксид, главни оксид сумпора, бива емитован из вулкана.
-
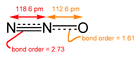
Азотсубоксид („гас смејавац”) је потентан стакленички гас који производе бактерије земљишта.
Иако је већина оксида метала полимерна, неки оксиди су молекули. Примери молекуларних оксида су угљен диоксид и угљен моноксид. Сви једноставни оксиди азота су молекуларни, нпр. NO, N2O, NO2 и N2O4. Фосфор пентоксид је комплекснији молекуларни оксид са варљивим називом, права формула је P4O10. Неки полимерни оксиди се деполимеризују се када се загревају и дају молекуле, примери су селен диоксид и сумпор триоксид. Тетроксиди су ретки. Чешћи примери су: рутенијум тетроксид, осмијум тетроксид и ксенон тетроксид.
Познати су многи оксианјони, као што су полифосфати и полиоксометалати. Оксикатјони су ређи, неки примери су нитрозонијум (NO+), ванадил (VO2+) и уранил (UO2+
2). Позната су многа једињења која су оксиди али имају и друге групе. У органској хемији, таква једињења су кетони и многа сродна карбонилна једињења. За прелазне метале, познати су многи оксо комплекси као и оксихалиди.
Редукција
[уреди | уреди извор]Претварање металног оксида у метал назива се редукцијом. Редукција може бити индукована многим реагенсима. Многи оксиди метала претварају се у метале једноставним загревањем.
Редукција угљеником
[уреди | уреди извор]Метали се „добијају” из њихових оксида хемијском редукцијом, тј. додавањем хемијског реагенса. Уобичајено и јефтино редуктивно средство је угљеник у облику кокса. Најистакнутији пример је топљење жељезне руде. Укључене су многе реакције, али поједностављена једначина се обично приказује као:[2]
- 2 Fe2O3 + 3 C → 4 Fe + 3 CO2
Метални оксиди се могу редуковати органским једињењима. Овај редукциони процес је основа за многе важне трансформације у хемији, као што су детоксикација лекова ензимима P450 и производња етилен оксида, који се претвара у антифриз. У таквим системима метални центар преноси оксидни лиганд у органско једињење, што је праћено регенерацијом металног оксида, често кисеоником из ваздуха.
Редукција загревањем
[уреди | уреди извор]Метали који су ниже у серији реактивности могу се редуковати загревањем. На пример, сребро оксид се распада на 200 °C:[5]
- 2 Ag2O → 4 Ag + O2
Редукција заменом
[уреди | уреди извор]Метали који су реактивнији замењују оксид метала који су мање реактивни. На пример, цинк је реактивнији од бакра, те он врши замену у бакар(II) оксидз чиме се формира цинк оксид:
- Zn + CuO → ZnO + Cu
Редукција водоником
[уреди | уреди извор]Поред метала, водоник такође може да изврши замену у металним оксидима и да формира водоник оксид, такође познат као вода:
- H2 + CuO → Cu + H2O
Редукција електролизом
[уреди | уреди извор]Пошто метали који су реактивни формирају стабилне оксиде, неки метални оксиди се морају електролизовати да би се редуковали. Овим су обухваћени натријум оксид, калијум оксид, калцијум оксид, магнезијум оксид и алуминијум оксид. Оксиди морају да буду истопљени пре него што у њих уроне графитне електроде:
- 2Al2O3 → 4Al + 3O2
Хидролиза и солватација
[уреди | уреди извор]Оксиди обично реагују са киселинама или базама, понекад и обоје. Они који реагују само са киселинама су означени као базни оксиди. Они који реагују само базама називају се „киселим оксидима”. Оксиди који реагују с обоје су амфотерни. Метали имају тенденцију да формирају базне оксиде, неметали обично стварају киселе оксиде, а амфотерне оксиде формирају елементи близу границе између метала и неметала (металоиди). Ова реактивност је основа многих практичних процеса, као што је екстракција неких метала из њихових руда у процесу званом хидрометалургија.
Оксиди више електропозитивних елемената углавном су базни. Они се називају базним анхидридима. Изложени води они могу да формирају базне хидроксиде. На пример, натријум оксид је базан - када је хидратисан, он ствара натријум хидроксид. Оксиди више електронегативних елемената имају тенденцију киселости. Називају се „киселинским анхидридима”; при додавању воде, они формирају оксокиселине. На пример, дихлор хептоксид је анхидрид киселине; перхлорна киселина је његов потпуно хидратизован облик. Неки оксиди могу да делују као киселина и база. Они су амфотерни. Пример је алуминијум оксид. Неки оксиди не показују понашање ни киселине, ни базе.
Оксидни јон има формулу O2−. То је конјугована база хидроксидног јона, OH−, а налази се у јонским чврстим материјама, као што је калцијум оксид. O2− је нестабилан у воденом раствору - његов афинитет за H+је толико велик (pKb ~ -38) да апстрахује протон из молекула растварача H2O:
- O2− + H2O → 2 OH−
Константа равнотеже горе наведене реакције је pKeq ~ −22
У 18. веку, оксиди су називани calxes или calces по процесу калцинације који је кориштен за продукцију оксида. Calx је касније замењено са оксид.
Редуктивна солватација
[уреди | уреди извор]Редуктивна солватација оксида прелазних метала се јавља кад је растварање спрегнуто са редокс догађајем.[6] На пример, фери оксиди се растварају у присуству редуктаната, чиме су обухваћена органска једињења,[7] или бактерије.[8] Редуктивна солватација интегрални део геохемијских феномена као што је циклус гвожђа.[9]
Редуктивно растварање се не мора нужно појавити на месту где се редуктант адсорбује. Уместо тога, додати електрони путују кроз честицу, узрокујући редуктивно растварање на другом месту.[10][11]
Важнији оксиди
[уреди | уреди извор]У најпознатије оксиде убрајају се:
- H2O - оксид водоника, познат као вода
- N2O - азот субоксид познат као весели гас
- SO2 - сумпор диоксид (исправно: сумпор(IV) оксид) - присутан у диму
- CO - угљен-моноксид (исправно: угљеник(II) оксид) - токсичан гас у малим количинама присутан у диму
- CO2 - угљен-диоксид (правилно: угљеник(IV) оксид) - присутан у ваздуху
- MgO - магнезијум-оксид
- CaO - калцијум-оксид - или негашени креч
- TiO2 - титанијум(IV)-оксид
- SiO2 - песак (правилно: силицијум(IV)-оксид)
- Cr2O3 - хром(III)-оксид
- CrO3 - хром(VI)-оксид
Важнији пероксиди
[уреди | уреди извор]- H2O2 - водоник - пероксид
Референце
[уреди | уреди извор]- ^ Foundations of College Chemistry, 12th Edition
- ^ а б в Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ Schultz, Emeric (2005). „Fully Exploiting the Potential of the Periodic Table through Pattern Recognition”. J. Chem. Educ. 82 (11): 1649. Bibcode:2005JChEd..82.1649S. doi:10.1021/ed082p1649.
- ^ P.A. Cox (2010). Transition Metal Oxides. An Introduction to Their Electronic Structure and Properties. Oxford University Press. ISBN 9780199588947.
- ^ Properties of substance silver oxide
- ^ Cornell, R. M.; Schwertmann, U. (2003). The Iron Oxides: Structure, Properties, Reactions, Occurrences and Uses, Second Edition. стр. 306. ISBN 9783527302741. doi:10.1002/3527602097.
- ^ Sulzberger, Barbara; Suter, Daniel; Siffert, Christophe; Banwart, Steven; Stumm, Werner (1989). „Dissolution of fe(III)(hydr)oxides in natural waters; laboratory assessment on the kinetics controlled by surface coordination”. Marine Chemistry. 28 (1–3): 127—144. ISSN 0304-4203. doi:10.1016/0304-4203(89)90191-6.
- ^ Roden, Eric E. (2008). „Microbiological Controls on Geochemical Kinetics 1: Fundamentals and Case Study on Microbial Fe(III) Oxide Reduction”. Kinetics of Water-Rock Interaction. стр. 335–415. ISBN 978-0-387-73562-7. doi:10.1007/978-0-387-73563-4_8.
- ^ Cornell, R. M.; Schwertmann, U. (2003). The Iron Oxides: Structure, Properties, Reactions, Occurrences and Uses, Second Edition. стр. 323. ISBN 9783527302741. doi:10.1002/3527602097.
- ^ Yanina, S. V.; Rosso, K. M. (2008). „Linked Reactivity at Mineral-Water Interfaces Through Bulk Crystal Conduction”. Science. 320 (5873): 218—222. Bibcode:2008Sci...320..218Y. ISSN 0036-8075. PMID 18323417. doi:10.1126/science.1154833.
- ^ Chatman, S.; Zarzycki, P.; Rosso, K. M. (2015). „Spontaneous Water Oxidation at Hematite (α-Fe2O3) Crystal Faces” (PDF). ACS Applied Materials & Interfaces. 7 (3): 1550—1559. ISSN 1944-8244. doi:10.1021/am5067783.
Спољашње везе
[уреди | уреди извор]- Materials science: Enter the oxides
- Condensed-matter physics: Complex oxides on fire
- Complex oxides: A tale of two enemies
- Oxide interfaces