Amin (hemija)
| Primarni amin | Sekundarni amin | Tercijarni amin |
|---|---|---|
 |
 |
 |
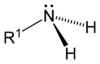
Amini pripadaju grupi organskih jedinjenja koja sadrže najmanje jednu ili više baznih azotovih atoma u molekulu. Amini se smatraju derivatima amonijaka i strukturno su mu sliči. Jedan ili više vodonikovih atoma zamijenjen sa jednom ili više alkilnih ili arilnih organskih grupa.[1] Važni amini su aminokiseline, trimetilamini, i anilini. Neorganski derivati amonijaka se takođe nazivaju aminima, npr. hloramin (NClH2).
Slični aminima su amidi, međutim oni su derivati karboksilnih kiselina i imaju karbonilnu grupu vezanu na amino skupinu, npr.: RC(O)NR2. Amidi i amini imaju različitu strukturu i svojstva, stoga je razlika u nazivu važna. Supstituent -NH2 se naziva amino grupa.[2] Jedinjenja sa atomom azota vezanim za karbonil grupu, koja imaju strukturu R–CO–NR′R″, se nazivaju amidima i imaju različita hemijska svojstva od amina.[3][4][5][6][7]
Nomenklatura amina
[уреди | уреди извор]- prefiks N označava supstituciju na atomu azota (npr.: N,N-dimetiletilamin)
- kao prefiks: „amino-”"
- kao sufiks: „-amin”
Kod nižih amina koristi se sufiks -amin, a kod viših amina koristi se prefiks amino-.
- Primarni amini: metilamin, etanolamin ili 2-aminoetanol
- Sekundarni amini: dimetilamin, metiletanolamin ili 2-(metilamino)etanol
- Tercijarni amini: trimetilamin, dimetiletanolamin ili 2-(dimetilamin)etanol
Četvrta podkategorija je određena povezanošću supstituenata vezanih za azot:
- Ciklični amini — Ciklični amini su bilo sekundarni ili tercijarni amini. Primeri cikličnih amina su tročlani prsten aziridina i šestočlani prsten piperidina. N-metilpiperidin i N-fenilpiperidin su primeri cikličnih tercijarnih amina.
Isto tako je moguće da postoje četiri organska supstituenta na azotu. Ove vrste nisu amini već su kvaternarni amonijum katjoni i imaju naelektrisani azotni centar. Kvaternarne amonijum soli postoje sa mnogim vrstama anjona.
Fizička svojstva
[уреди | уреди извор]Vodonična veza znatno utiče na svojstva amina[8], zbog toga je tačka ključanja viša nego kod sličnih alkana i niža od sličnih alkohola. Zbog veće elektronegativnosti kiseonika od azota, amini su više bazični od alkohola i alkana koji su time kiseliji. Amini manjih relativnih molekulskih masa (metil-, dimetil-, trimetil- i etilamin) su gasovi pri sobnoj temperaturi. Amini veće molekulske mase su tečnosti ili čvrste materije (dietilamin ili trietilamin).
Gasoviti amini imaju neugodan miris sličan amonijaku, dok tečni amini mirišu poput pokvarene ribe. Amini s manjim brojem ugljenikovih atoma dobro se rastvaraju u vodi stvarajući vodonične veze, rastvorljivost se smanjuje s povećanjem molekulske mase amina - odnosno hidrofobnog dela molekula. Alifatični amini dobro su rastvorni u organskim rastvaračima, pogotovo polarnim. Primarni amini reagiraju sa ketonima kao što je aceton.
Spektroskopska identifikacija
[уреди | уреди извор]Tipično se prisustvo aminske funkcionalne grupe određuje kombinacijom tehnika, uključujući masenu spektrometriju kao i NMR i IR spektroskopije. 1H NMR signali za amini nestaju nakon tretiranja uzorka sa D2O. U svom infracrvenom spektru primarni amini ispoljavaju dve N-H veze, dok sekundarni amini imaju samo jednu.[2]
Struktura
[уреди | уреди извор]Alifatični amini
[уреди | уреди извор]Razlikuju se tri vrste amina: primarni, sekundarni i tercijarni, i to s obzirom na broj ugljovodoničnih grupa vezanih za azotov atom umjesto vodonika. Slovo R označava organsku (ugljovodoničnu) grupu.
Alkil amini karakteristično imaju tetraedralne azotne centre. C-N-C i C-N-H uglovi teže idealizovanom uglu 109°. C-N rastojanja su nešto kraća od C-C rastojanja. Energetska barijera barijera za azotnu inverziju stereoizomera je oko 7 kcal/mol za trialkilamin. Interkonverzija se može uporediti sa inverzijom otvorenog kišobrana na jakom vetru.
Amini tipa NHRR′ i NRR′R″ su hiralni: azotni centar nosi četiri supstituenta računajući slobodni par. Usled niske barijere inverzije, amini tipa NHRR′ se ne mogu dobiti u optički čistoj formi. Za hiralne tercijarne amine, NRR′R″ se jedino može rešiti kad su R, R′, i R″ grupe ograničene u cikličnim strukturama kao što su N-supstituisani aziridini (kvaternarne amonijum soli se mogu razdvojiti).

|
⇌ | 
|
| Inverzija amina. Par tačaka predstavlja usamljeni elektronski par na atomu azota. | ||
Aromatični amini
[уреди | уреди извор]Aromatični amini na azotovom atomu imaju vezan aromatični prsten, trivijalno se zovu anilini, primer je fenilamin. Anilin i njegovi derivati su u industrijskoj sintezi boja polazna jedinjenja. Aromatični prsten snižava bazičnost amina zavisno od supstituenata, a prisustvo amino grupe povećava reaktivnost kod aromatičnog prstena, zbog elektron-donatora. Jedna od reakcija aromatičnog prstena je Goldbergova reakcija.[9][10]
U aromatičnim aminima („anilinima”), azot je često skoro planaran usled konjugacije slobodnog elektronskog para sa aril substituentom. C-N rastojanje je respektivno kraće. U anilinu, C-N rastojanje je isto kao C-C rastojanja.[11]
Bazičnost
[уреди | уреди извор]Poput amonijaka, amini su baze.[12] U poređenju sa alkalnim metalnim hidroksidima, amini su slabi (pogledajte tabelu za primere Ka vrednosti konjugovanih kiselina).
| Alkilamin[13] or aniline[14] | pKa protonovanog amina | Kb |
|---|---|---|
| metilamin (MeNH2) | 10,62 | 4,17E-04 |
| dimetilamin (Me2NH) | 10,64 | 4,37E-04 |
| trimetilamin (Me3N) | 9,76 | 5,75E-05 |
| etilamin (EtNH2) | 10,63 | 4,27E-04 |
| anilin (PhNH2) | 4,62 | 4,17E-10 |
| 4-metoksianilin (4-MeOC6H4NH2) | 5,36 | 2,29E-09 |
| N,N-dimetilanilin (PhNMe2) | 5,07 | 1,17E-09 |
| 3-Nitroanilin (3-NO2-C6H4NH2) | 2,46 | 2,88E-12 |
| 4-Nitroanilin (4-NO2-C6H4NH2) | 1 | 1,00E-13 |
| 4-trifluorometilanilin (CF3C6H4NH2) | 2,75 | 5,62E-12 |
Bazičnost amina zavisi od:
- Elektronskioh svojstava supstituenata (alkil grupe povećavaju bazičnost, aril grupe smanjuju itd).
- Stepena solvacije protonisanog amina, čime su obuhvaćeni sterni efekti grupa na azotu.
Elektronski efekti
[уреди | уреди извор]Zahvaljujući induktivnim efektima, može se očekivati da se bazičnost amina povećava sa brojem alkil grupa na aminu. Korelacije su komplikovane zbog efekata solvatacije koji su suprotni trendovima induktivnih efekata. Efekti solvatacije takođe dominiraju bazičnost aromatičnih amina (anilina). Za aniline, usamljeni par elektrona na azotu se delokalizuje u prsten, što dovodi do smanjenja bazičnosti. Supstituenti na aromatičnom prstenu, i njihovi položaji u odnosu na amino grupu, takođe utiču na bazičnost kao što se vidi u tabeli.
Solvacioni efekti
[уреди | уреди извор]Solvatacija značajno utiče na bazičnost amina. N-H grupe formiraju jake interakcije sa vodom, a posebno amonijum joni. Nasuprot tome, bazičnost amonijaka se povećava za 1011 usled solvacije. Intrinzična bazičnost amina, tj. situacija u kojoj je solvatacija nevažna, je izučavana u gasnoj fazi. U gasnoj fazi amini pokazuju bazičnosti predviđene iz delovanja organskih supstituenata na oslobađanje elektrona. Tako su tercijarni amini u većoj meri bazični od sekundarnih amina, koji su više bazični od primarnih amina, i na kraju amonijak je najmanje bazičan. pKb redosled (bazičnosti u vodi) ne sledi ovaj trend. Slično tome anilin je više bazičan od amonijaka u gasnoj fazi, ali je deset hiljada puta manje bazičan u vodenom rastvoru.[15]
U aprotičnim polarnim rastvaračima kao što su DMSO, DMF, i acetonitril energija solvacije nije jednako visoka kao u protičnim rastvorima poput vode i metanola. Iz tog razloga, bazičnost amina u tim aprotičnim rastvaračima je skoro potpuno vođena elektronskim efektima.
Sinteza
[уреди | уреди извор]Alkilacija
[уреди | уреди извор]Najznačajniji industrijski postupak pripreme amina je putem alkilacije amonijaka alkoholima:[16]
- ROH + NH3 → RNH2 + H2O
Za razliku od reakcija amina sa alkil halidima, ovaj industrijski metod je zelen u smilu da se kao nusproizvod formira voda. Reakcija amina i amonijaka sa alkil halidima se koristi za laboratorijsku sintezu:
- RX + 2 R′NH2 → RR′NH + [RR′NH2]X
Takve reakcije, koje su najkorisnije za alkil jodide i bromide, retko se primenjuju jer je stepen alkilacije teško kontrolisati.[16] Selektivnost se može poboljšati putem Delepinove reakcije, mada se ona retko koristi u industrijskim razmerama.
Reduktivne rute
[уреди | уреди извор]Putem procesa hidrogenacije, nitrili se redukuju do amina koristeći vodonik u prisustvu nikla kao katalizatora. Reakcije su senzitivne za kisele i bazne uslove, što može da uzrokuje hidrolizu –CN grupe. LiAlH4 se češće koristi za redukciju nitrila u laboratorijskim razmerama. Slično tome, LiAlH4 redukuje amide do amina. Mnogi amini se formiraju iz aldehida i ketona putem reduktivne aminacije, koja se može odvijati bilo katalitički ili stehiometrijski.
Anilin (C6H5NH2) i njegov i derivati se pripremaju redukcijom nitroaromatičnih jedinjenja. U industriji, vodonik je preferentni reaktant, dok se u laboratorijskim uslovima često koriste kalaj i gvožđe.
Neke vrste amina
[уреди | уреди извор]Alkaloidi
[уреди | уреди извор]Alkaloidi su amini u prirodi, posebno u biljnom svetu. U prirodi većinom nastaju iz aminokiselina. Znatan broj alkaloida je otrovan, gorkog ukusa s vrlo jakim farmakološkim učinkom. Primeri alkaloida: kofein (nalazi se u kafi, čaju, bezalkoholnim pićima, letalna doza kofeina je 10 grama), nikotin (nalazi se u lišću duhana, letalna doza nikotina je 500 miligrama (u krvotoku)), morfin (nalazi se u opijumu, osušenom soku iz maka).
Triptamini
[уреди | уреди извор]Triptamini su alkaloidni monoamini. Stvaraju se oko indolnog prstena. Odgovaraju aminokiselini triptofan. Neki deluju kao neurotransmiteri, a neki kao halucinogeni (psihoaktivne droge, psihodelične droge). Primeri triptamina: serotonin, melatonin, dimetiltriptamin, psilocin. Droge vrste triptamina se nalaze u porodici (TiHKAL).
Feniletilamini
[уреди | уреди извор]Feniletilamini su alkaloidni monoamini. Odgovaraju aminokiselini fenilalanin. Supstituisani feniletilamini su jedinjenja sa mnoštvom funkcija: neurotransmiteri, hormoni, stimulanti, halucinogeni, antidepresivi. Primeri feniletilamina: dopamin, adrenalin, noradrenalin, amfetamin, metamfetamin, meskalin, MDMA, tiramin, salbutamol. Druge vrste feniletilamina se nalaze u porodici (PiHKAL).
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd изд.). Belmont: Wadsworth. ISBN 0-534-16218-5.
- ^ а б Smith, Janice Gorzynski (2011). „Chapter 25 Amines”. Ур.: Hodge, Tami; Nemmers, Donna; Klein, Jayne. Organic chemistry (на језику: енглески) (3rd изд.). New York, NY: McGraw-Hill. стр. 949—993. ISBN 978-0-07-337562-5. Архивирано из оригинала (Book) 28. 06. 2018. г. Приступљено 12. 05. 2019.
- ^ Harrison L. G. : The shaping of life: The generation of biological pattern. . Cambridge University Press. 2011. ISBN 978-0-521-55350-6.; http://books.google.com/books?id=-IPG-vg7Pr8C.
- ^ Hadžiselimović R., Pojskić N. : Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. 2005. ISBN 978-9958-9344-3-8.
- ^ Alberts B. ː Molecular biology of the cell. Garland Science. . New York. 2002. ISBN 978-0-8153-3218-3.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. : Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. 2005. ISBN 978-9958-9344-1-4.
- ^ Kapur Pojskić L., Ed. : Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. 2014. ISBN 978-9958-9344-8-3.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Ullmann, Fritz (1905). „Ueber die Phenylirung von Phenolen”. Berichte der deutschen chemischen Gesellschaft. 38 (2): 2211—2212. doi:10.1002/cber.190503802176.
- ^ Irma Goldberg (1906). „Ueber Phenylirungen bei Gegenwart von Kupfer als Katalysator”. Berichte der deutschen chemischen Gesellschaft. 39 (2): 1691—1692. doi:10.1002/cber.19060390298.
- ^ G. M. Wójcik "Structural Chemistry of Anilines" in Anilines (Patai's Chemistry of Functional Groups), S. Patai, Ed. 2007, . Weinheim: Wiley-VCH. doi:10.1002/9780470682531.pat0385. Недостаје или је празан параметар
|title=(помоћ) - ^ Smith, J. W. (1968). S. Patai, ур. „Basicity and complex formation”. Patai's Chemistry of Functional Groups. doi:10.1002/9780470771082.ch4.
- ^ Hall, H. K. (1957). „Correlation of the Base Strengths of Amines”. Journal of the American Chemical Society. 79 (20): 5441—5444. doi:10.1021/ja01577a030.
- ^ Kaljurand, I.; Kütt, A.; Sooväli, L.; Rodima, T.; Mäemets, V.; Leito, I.; Koppel, I. A. (2005). „Extension of the Self-Consistent Spectrophotometric Basicity Scale in Acetonitrile to a Full Span of 28 pKa Units: Unification of Different Basicity Scales”. The Journal of Organic Chemistry. 70 (3): 1019—1028. PMID 15675863. doi:10.1021/jo048252w.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ а б Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000). „Amines, Aliphatic”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a02_001.
