Ензим

| Биохемија |
|---|
 |
| Кључне компоненте |
| Историја и теме |
| Портали: Биологија, Хемија, MCB |
Ензим или фермент је биолошки катализатор, тј има моћ да утиче на брзину хемијске реакције.[1][2]
Ензими су неопходни како би живот био могућ, јер многе реакције које се одвијају у ћелијама организма су превише споре и водиле би до другачијих продуката које организму или нису потребни или би му штетили. Квар, генетичке мутације, недовољна или повећана производња, једног јединог ензима може да буде буде главни узрок тешких генетичких поремећаја. На пример, поремећај фенилкетонурија је резултат недостатка ензима фенилаланин хидроксилаза, који катализује први корак у разлагању амино киселине фенилаланина. Ако овај ензим не функционише како треба, и не разложи амино киселину, неограничена производња фенилаланина води до менталне ретардације. Поред фенилкетонурије постоји још читав низ обољења, заједнички названих ензимопатије, чији је узрок мутација гена, а последица недостатак неког ензима.

Као и сви катализатори ензими функционишу тако што снижавају активациону енергију реакције, и на тај начин је убрзавају. Ензими могу да убрзају реакције на нивоу од по неколико милиона пута. Ензим, као сваки катализатор, остаје непромењен реакцијом на коју утиче и то му омогућава да, кад се једна реакција заврши, укључи у другу, потпуно непромењен. Такође ензими не утичу на релативну енергију између реагената и продуката, тако да не утичу на еквилибријум реакције. Међутим, оно што ензим одваја од свих осталих катализатора је њихова специфичност у погледу стереохемије, хемијске селективности и специфичности.
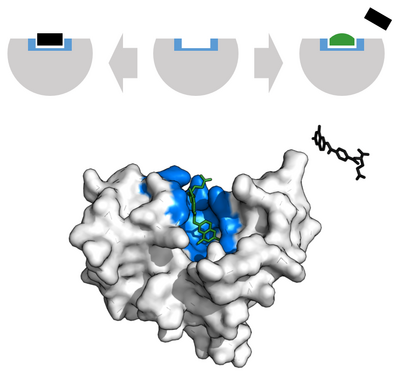
Основна идеја ензима је та да се на ензим повежу молекули реакције на коју ензим делује, створи се комплекс састављен од ензима и молекула који није дугорочан, и из тог комплекса, односно те интеракције, имамо производ те реакције, док ензим остаје потпуно непромењен реакцијом. Ово је приказано графички:
Ензими се такође свакодневно користе у продуктима као што су детерџенти за судове, веш, и разне друге кућне хемикалије.
Данас је познато више од 5.000 ензима. Номенклатура ензима нам помаже при именовању овог великог броја ензима, и по њој ензимима се даје име које се завршава са -за, а префикс је хемијска супстанца која трансформише, односно на коју ензим утиче. На пример, ензима који има улогу у ДНК репликацији и који врши реакцију полимеризације молекула ДНК се назива ДНК полимераза.
Историја[уреди | уреди извор]

Термин ензим је пореклом из грчког језика ένζυμο и значи закиселити. Крајем 1700. и почетком 1800, научници су приметили реакције које настају варењем меса помоћу жучних киселина и реакције које прате конверзацију декстрина у шећер.
Проучавањем ферментације шећера у алкохол помоћу квасца, Луј Пастер је дошао до закључка да је ферментација могућа услед постојања фермената у квасцу, за које је мислио да су присутне само у живим организмима.
Године 1897, Ханс и Едуард Бухнер су користили екстракте квасца како би ферментисали шећер без присуства живих ћелија квасца. Они су били заинтересовани у прављење екстраката квасца у медицинске сврхе, и један од начина чувања, је био додавање велике количине шећера у екстракте. На њихово изненађење, открили су да је шећер ферментисан, иако у целој смеси није било присутних живих ћелија квасца. Термин ензим је коришћен тад први пут и описује супстанцу у екстракту квасца који је довео до ферментације шећера.
3-Д Структура[уреди | уреди извор]
Дуго се сматрало да су сви ензими по хемијском саставу протеини. Међутим, као што у биохемији често бива, имамо изузетак у виду неколико врста рибонуклеинских киселина (РНК) које се специфично називају рибозими. Сматра се да су РНК вероватно биле и први катализатори у еволуцији живе материје.
Што се протеинских ензима тиче, а они чине велику већину ензима у људском телу, њихова функција је као и код других протеина, одређена структуром. Ензим може бити:
- Мономеричан, што значи да садржи само један полипептидни ланац, обично од сто или више амино киселина
- Олигомеричан, односно садржи већи број полипептидних ланаца, који могу бити или идентични или да се разликују, али који функционишу заједно као једна јединица.
Као и сваки протеин, мономер је један дугачак линеаран ланац амино киселина, који се савија и повија на одређени начин и за продукат има тродимензионалну структуру.
Већина ензима су обично већи молекули од оних молекула на које делују, и свега десетак амино киселина ензима дође у директан контакт са молекулом који бива трансформисан. Регион у којем долази до тог директног контакта ензима и молекула се назива Активни регион. Већи број ензима такође има додатне регионе за кофакторе који су потребни при катализацији реакције. Контакти између молекула на који се делује и постојећих кофактора убрзава или успорава активност ензима по потреби.
Специфичност[уреди | уреди извор]
Ензими су углавном веома специфични кад су у питању реакције које употребљавају са молекулима на које делују. Облик, форма, структура, наелектрисање, хидрофилни и хидрофобни карактер ензима као и молекула утичу на ову специфичност.
Хипотеза кључа и браве[уреди | уреди извор]

Најуочљивија карактеристика ензима је њихова специфичност. Емил Фишер је 1890. године констатовао да је ова хипотеза коректна услед специфичности облика ензима и молекула на које они делују. Сваки молекул на који одређени ензим утиче, има тачно одређени облик, помоћу којег се молекуле повеже на тачно одређени ензим. На пример, ако је молекул на који ензим утиче у облику коцке, а сам ензим има регион у облику троугла на који молекул треба да се надовеже, до повезивања неће доћи, јер у том случају ензим није коректан за тај молекул. Ова хипотеза се зато и назива хипотеза кључа и браве, јер је сваки кључ специфичан за сваку браву коју откључава. Овај модел је данас у великој мери напуштен због ригидности с којом посматра ензим и супстрат, као и услед немогућности да се њиме објасне алостеризација и ензимска кооперативност.
Хипотеза Индукованог прилагођавања[уреди | уреди извор]

1958. Данијел Кошланд је предложио модификацију хипотезе Кључ и брава која је названа хипотеза Индукованог прилагођавања (енг. Induced-Fit-Model). Ензими су веома флексибилне структуре. Активни регион ензима може бити модификован како би дошло до интеракције молекула и ензима. Ланци амино киселина се могу преклапати на тај начин који би одговарао ензиму, како би дошло до интеракције, и на тај начин ензим могао да изврши своју каталитичку функцију. У веома ретким случајевима, молекули при уласку у Активни регион могу да се прилагоде ензиму, како би дошло до интеракције ензима и молекула. Аналогија слична овој је на пример када облачимо рукавицу, и како се рукавица прилагођава нашој руци, како би се савршено прилагодила руци.
Кофактори[уреди | уреди извор]

Неки ензими су као самосталне јединице саме себи довољне да би биле потпуно активне, тј. нису им потребни додатни фактори да би се та активност постигла. Међутим, неким ензимима су потребни молекули који би помогли при активирању ензима, и ти молекули се зове кофактори. Кофактори могу бити неорганског порекла, као на пример јони метала, или могу да имају органско порекло, и као такви се називају коензими.
Ензими којима су потребни кофактори, а тренутно их немају се називају апоензими. Ензим који је повезан са својим кофактором, назива се холоензим, и тај облик представља активни облик ензима. Већина кофактора није ковалентно повезана са ензимима, али има и оних који су ковалентним везама повезани за ензим, и као такви, кофактори се називају простетична група нпр. кофактор хем је повезан ковалентном везом за хемоглобин.
Већина кофактора су или регенерисани или хемијски непромењени током и после реакције у којој учествују. Велики број кофактора су деривати витамина и служе као транспортна тела за транспорт електрона, атома или функционалних група, од ензима ка молекулу. Најчешћи примери су NAD и NADP, који су транспортна тела за електроне, и Коензим А, који је транспортно тело за ацетилну групу.
Термодинамика[уреди | уреди извор]

Као са свим катализаторима, све реакције на које утиче ензим, тј. које су катализаторског типа, морају бити спонтанте, односно вредност Гибсове слободне енергије мора бити негативна. Без ензима реакције се крећу у истом правцу као и са ензимом, али много мањом брзином, где долази улога ензима, а то је убрзање брзине реакције. Међутим, некатализиране спонтане реакције могу довести до другачијих продуката од катализираних реакција, тј. од реакција у којима су присутни ензими. Такође ензими могу да утичу на више реакција истовремено, тако да она реакција која је са термодинамичке тачке гледишта боља, тј. има веће шансе да буде реализована, може да повуче са собом ону реакцију која није, и на тај начин обе реакције су реализоване. На пример, цепање једињења које поседује веома велику енергију АТП (Аденозин-три-фосфат) је са термодинамичке тачке гледишта успешна реакција, и она заузврат помаже реакцијама које нису, а на које истовремено делује исти ензим као и на цепање АТП реакције.
Ензими катализују реакције у оба смера једнако. Ензими никад не мењају еквилибријум реакције, већ само брзину која доводи до стварања тог еквилибријума, тј. равнотеже.
Кинетика[уреди | уреди извор]
Године 1913. Леонор Микелис и Мауд Ментен су представили квантитативну теорију кинетике ензима, која је данас позната под именом Микелис-Ментенина теорија кинетике.[3] Њихов рад је даље усавршио Г. Е. Бригс и Џ. Б. С. Халден, који су разрадили велики број кинетичких једначина које се и данас користе.[4]
Ензими могу да изведу и до неколико милиона реакције у једној секунди. Да би се утврдила максимална брзина реакције, концентрација молекула на који ензим делује се увећава све док се не достигне константна рата производње, односно формације хемијских продуката. Ово је максимална брзина ензима Vmax. У овом кораку, сви региони ензима су у интеракцији са молекулом, односно великим бројем истих молекула на које ензим делује. Vmax је једна од кинетичких параметара за који су биохемичари заинтересовани. Такође од интереса је рата, односно стопа реакције, а то је одређено количином молекула на који ензима делује.
Овај параметар, концентрација молекула се означава Микелис-Ментен константом Km), и та константа представља концентрацију молекула како би ензим достигао половину своје максималне брзине. Сваки ензим има карактеристичну константу Km за дати, односно одређени молекул.
Ефикасност ензима може бити представљена kcat/Km. Параметар kcat се такође назива производни број, који узима у обзир све кораке реакције, и количник је Vmax као и крајње свеукупне концентрације ензима. kcat/Km је користан параметар при компарацији, односно упоређивању једног ензима наспрам другог, или једног ензима наспрам свог молекула, јер се узимају у обзир и афинитет као каталитичка способност. Теоријски максимум за kcat/Km зе назива дифузијски лимит, тј. ограничење распрострањености, и оно је између 108 to 109 (M−1 s−1). У овом кораку, тј. у овом моменту, сваки судар, тј. сваки контакт ензима са својим молекулом ће имати за резултат катализу и брзина формирања продуката није ограничена брзином реакције, већ ограничењем распрострањености, тј. дифузијским лимитом. Ензими који достигну kcat/Km вредност се називају каталитички савршеним или кинетички савршеним. Примери таквих ензима су трио-фосфатна изомераза, угљеникова анхидраза, фумараза, ацетилхолинестераза.
Брзина ензимских реакција зависи од услова раствора и концентрације супстрата. Да би се одредила максимална брзина ензиматске реакције, концентрација супстрата се повећава док се не достигне константна брзина формирања продукта. То је приказано кривом засићења. До засићења долази зато што са повећањем концентрације супстрата, све више и више слободног ензима бива конвертовано у ЕС (ензим - супстрат) комплекс. При максималној ензимској брзини реакције (Вмаx), сва активна места ензима су везана за супстрат, и количина ЕС комплекса је једнака тоталној количини ензима.[5]:8.4
Инхибиција[уреди | уреди извор]
Брзине ензимских реакција се могу умањити дејством различитих типова ензимских инхибитора.[6]:73–74
Типови инхибиције[уреди | уреди извор]
- Компетитивни
- Компетитивни инхибитор и супстрат не могу да се истовремено вежу за ензим.[7] Компетитивни инхибитори су често веома слични стварном ензимском субстрату. На пример, лек метотрексат је компетитивни инхибитор ензима дихидрофолатна редуктаза, који катализује редукцију дихидрофолата до тетрахидрофолата. Сличност између структура дихидрофолата и тог лека је приказана на слици. Овај тип инхибиције се може превазићи применом високих концентрација супстрата. У неким случајема, инхибитор се може везати за различито место од места везивања супстрата и тиме извршити алостерни утицај којим се мења облик уобичајеног места везивања.
- Некомпетитивни
- Некомпетитивни инхибитор се везује на различито место од места везивања супстрата. Субстрат се још увек везује са својим уобичајеним афинитетом и стога Км остаје исти. Међутим инхибитор редукује каталитичку ефикасност ензима тако да се Вмаx смањује. У контрасту са компетитивном инхибицијом, некомпетитивна инхибиција се не може превазићи високом концентрацијом супстрата.[6]:76–78
- Бескомпетитивни
- Бескомпетитивни инхибитор се не може везати за слободни ензим, него само за комплекс ензима и супстрата. Из тог разлога овај тип инхибитора је најефективнији при високом концентрацијама супстрата. У присуству инхибитора, комплекс ензима и супстрата је неактиван.[6]:78 Ова врста инхибиције је ретка.[8]
- Мешовити
- Мешовити инхибитори се везују за алостерно место, и везивање супстрата и инхибитора утиче једно на друго. Ензимска функција бива редукована али се не елиминише везивањем инхибитора. Овај тип инхибитора не следи Михаелис-Ментенину једначину.[6]:76–78
- Иреверзибилни
- Иреверзибилни инхибитор перманентно инактивира ензим, обично путем формирања ковалентне везе са протеином. Пеницилин[9] и аспирин[10] су лекови у широкој употреби који делују на такав начин.
Функције инхибитора[уреди | уреди извор]
У многим организмима, инхибитори могу да делују као компонента повратног механизма. Ако ензим производи превелику количину једне супстанце у организму, та супстанца може да делује као инхибитор ензима на почетку пута којим се она формира, узрокујући успоравање продукције супстанце, или заустављање процеса кад је супстанца присутна у довољној количини. Ово је облик негативне повратне спреге. Главни метаболички путеви, као што је циклус лимунске киселине, користе овај механизам.[5]:17.2.2
Пошто инхибитори модулирају функцију ензима, они се често користе као лекови. Многи такви лекови су реверзибилни компетитивни инхибитори који структурно подсећају на природни супстрат ензима, попут метотрексата. Други добро познати примери су статини, који се користе за третирање високих нивоа холестерола,[11] и протеазни инхибитори који се користе у третману ретровиралних инфекција, као што је ХИВ.[12] Познати пример иреверзибилног инхибитора који се користи као лек је аспирин, који инхибира ензиме COX-1 и COX-2 који производе инфламационог гласника, простагландина.[10] Инхибитори ензима могу да буду отрови. На пример, отров цијанид је иреверзибилни ензимски инхибитор који се комбинује са бакром и гвожђем у активном месту ензима цитохром ц оксидаза и блокира ћелијско дисање.[13]
Номенклатура ензима[уреди | уреди извор]
Према конвенцији, име ензима се састоји од назива радње коју обавља, и суфикса - аза. На пример, имамо ензим који се зове ДНК полимераза. Из овога можемо да закључимо да ензим врши полимеризацију ДНК молекула, и ензим се завршава са суфиксом -аза. Други пример, имамо ензим Алкохол дехидрогеназа, за којег можемо да закључимо да врши дехидрогенизацију алкохола и ензим се опет завршава са - аза.
Киназе су ензими који учествују у трансферу фосфатних група. У овом случају таквих ензима има јако пуно, што би довело до конфузије јер би се појавило пуно ензима за истом функцијом. У овом случају, поред горенаведених примера давања имена, додају су карактеристике специфичне за дати ензим, као на пример оптимална pH вредност (пример оваквог ензима је ензим Алкална фосфатаза).
Међународна Унија Биохемије и Молекуларне Биологије је развила номенклатуру по којој се ензими називају. Сваки ензим садржи у имену (латиница ЕС број) ЕЦ број (комисациони број ензима, или на енглеском Enzyme Commission number) и ред од четири броја. Ради објашњавања сви појмови у давању имена ензима ће у даљем тексту бити писана латиницом по правилу номенклатуре.
Дакле, први (од четири броја) нашироко класификује ензим на основу механизма:
| Група | Катализована реакција | Типична реакција | Пример ензими |
| EC 1 Оксидоредуктазе |
катализују оксидо-редукционе реакције; врше трансфер водоникових и кисеоникових атома са једног молекула на други | AH + B → A + BH (редукована) A + O → AO (оксидована) |
Дехидрогеназа, Оксидаза |
| EC 2 Трансферазе |
врше трансфер функционалних група (нпр. трансфер метил групе или фосфатне групе) | AB + C → A + BC | Киназе |
| EC 3 Хидролазе |
катализују хидролитичне реакције | AB + H2O → AOH + BH | Липаза, Амилаза, Пептидаза |
| EC 4 Лијазе |
цепају или кидају разлиите хемијске везе (изузеци су хидролитичне и оксидативне реакције, јер су ти ензими тих реакције већ поменути у горњим групама). C-C, C-N, C-O или C-S везе се кидају | RCOCOOH → RCOH + CO2 | |
| EC 5 Изомеразе |
катализују реакције изомеризације у појединачном молекулу | AB → BA | Изомераза |
| EC 6 Лигазе |
спајају молекуле са ковалентним везама: C-O, C-S, C-N и C-C | X + Y+ ATP → XY + ADP + Pi | ДНК Лигаза |
За комплетну листу ензима по горенаведеној номенклатури, видети следећу страницу [1]
Употреба ензима[уреди | уреди извор]
Ензими су неопходни у свакодневном животу, од функционисање организма до свакодневних кућних послова.
- Ензим Протеаза се добија из бактерија, а користи се у супстанцама као што је детерџент. Ензим помаже у уклањању мрља са тканина и одеће.
- Ензим Амилоглукосидаза се користи при производњи пива, јер се помоћу овог ензима производи ниско калорично пиво.
- Ензим Липаза је нашао употребу у прехрамбеној индустрији и користи се веома пуно при прављењу Буђавог сира.
Референце[уреди | уреди извор]
- ^ Smith 1997.
- ^ Grisham & Garrett 1999, стр. 426–427.
- ^ Michaelis L, Menten M (1913). „Die Kinetik der Invertinwirkung” [The Kinetics of Invertase Action] (PDF). Biochem. Z. (на језику: German). 49: 333—369. doi:10.1021/bi201284u.; Michaelis L, Menten ML, Johnson KA, Goody RS (2011). „The original Michaelis constant: translation of the 1913 Michaelis-Menten paper”. Biochemistry. 50 (39): 8264—9. PMC 3381512
 . PMID 21888353. doi:10.1021/bi201284u.
. PMID 21888353. doi:10.1021/bi201284u.
- ^ Briggs GE, Haldane JB (1925). „A Note on the Kinetics of Enzyme Action”. The Biochemical Journal. 19 (2): 339—339. PMC 1259181
 . PMID 16743508.
. PMID 16743508.
- ^ а б Stryer L, Berg JM, Tymoczko JL (2002). Biochemistry (5th изд.). San Francisco: W.H. Freeman. ISBN 978-0-7167-4955-4.
- ^ а б в г Cornish-Bowden A (2004). Fundamentals of Enzyme Kinetics (3 изд.). London: Portland Press. ISBN 978-1-85578-158-0.
- ^ Price NC (1979). „What is meant by 'competitive inhibition'?”. Trends in Biochemical Sciences. 4 (11): N272—N273. doi:10.1016/0968-0004(79)90205-6.
- ^ Cornish-Bowden A (1986). „Why is uncompetitive inhibition so rare? A possible explanation, with implications for the design of drugs and pesticides”. FEBS Letters. 203 (1): 3—6. PMID 3720956. doi:10.1016/0014-5793(86)81424-7.
- ^ Fisher JF, Meroueh SO, Mobashery S (2005). „Bacterial resistance to beta-lactam antibiotics: compelling opportunism, compelling opportunity”. Chemical Reviews. 105 (2): 395—424. PMID 15700950. doi:10.1021/cr030102i.
- ^ а б Johnson DS, Weerapana E, Cravatt BF (2010). „Strategies for discovering and derisking covalent, irreversible enzyme inhibitors”. Future Medicinal Chemistry. 2 (6): 949—64. PMID 20640225. doi:10.4155/fmc.10.21.
- ^ Endo A (1. 11. 1992). „The discovery and development of HMG-CoA reductase inhibitors” (PDF). J. Lipid Res. 33 (11): 1569—82. PMID 1464741.
- ^ Wlodawer A, Vondrasek J (1998). „Inhibitors of HIV-1 protease: a major success of structure-assisted drug design”. Annual Review of Biophysics and Biomolecular Structure. 27: 249—84. PMID 9646869. doi:10.1146/annurev.biophys.27.1.249.
- ^ Yoshikawa S, Caughey WS (1990). „Infrared evidence of cyanide binding to iron and copper sites in bovine heart cytochrome c oxidase. Implications regarding oxygen reduction”. The Journal of Biological Chemistry. 265 (14): 7945—58. PMID 2159465.
Литература[уреди | уреди извор]
- Cornish-Bowden A (2004). Fundamentals of Enzyme Kinetics (3 изд.). London: Portland Press. ISBN 978-1-85578-158-0.
- Stryer L, Berg JM, Tymoczko JL (2002). Biochemistry (5th изд.). San Francisco: W.H. Freeman. ISBN 978-0-7167-4955-4.
- Grisham, Charles M.; Garrett, Reginald H. (1999). Biochemistry. Philadelphia: Saunders College Pub. стр. 426-7. ISBN 978-0-03-022318-1.
- Smith, AL, ур. (1997). Oxford dictionary of biochemistry and molecular biology. Oxford Oxfordshire: Oxford University Press. ISBN 978-0-19-854768-6.
- Koshland D. The Enzymes, v. I, ch. 7, Acad. Press, New York, 1959
- Perutz M. Proc. Roy. Soc., B (1967) 167, 448,
- Cha, Y., Murray, C. J. & Klinman, J. P. Science (1989) 243, 1325-1330.
- Leonor Michaelis, Maud Menten, Die Kinetik der Invertinwirkung, Biochem. Z. (1913) 49, 333-369.
- G. E. Briggs and J. B. S. Haldane, A note on the kinetics of enzyme action, Biochem. J., (1925) 19, 339-339.
- R.R. Dogonadze and V.G. Levich. Theory of Non-radiative Electronic Transitions between Ions in Solution, Dokladi Akademii Nauk SSSR. Ser. Fizicheskoy Khimii, Moscow, Vol. 124, 1959, 123-126.
- R.R. Dogonadze. Rate of Electron Transfer Reactions in Solutions, Dokladi Akademii Nauk SSSR. Ser. Fizicheskoy Khimii, Moscow, Vol. 133, 1960, 1368-1371.
- Nishimura M and Chance B. Biochim Biophys Acta. (1963) 66, 1-16.
- V.G. Levich, R.R. Dogonadze, E.D. German, A.M. Kuznetsov and Yu.I. Kharkats. Theory of Homogeneous Reactions Involving Proton Transfer, Electrochim.Acta, 15, 1970, 353-367.
- M.V. Volkenshtein, R.R. Dogonadze, A.K. Madumarov, Z.D. Urushadze, Yu.I. Kharkats. Theory of Enzyme Catalysis.- Molekuliarnaya Biologia, (1972), 431-439 (In Russian, English summary)
- Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (5th изд.). New York, NY: W. H. Freeman. ISBN 978-0-7167-3051-4., A biochemistry textbook available free online through NCBI Bookshelf.
- Cornish-Bowden A, ур. (1997). New Beer in an Old Bottle: Eduard Buchner and the Growth of Biochemical Knowledge. Universitat de València. ISBN 978-84-370-3328-0. Архивирано из оригинала 13. 12. 2010. г. Приступљено 25. 02. 2017., A history of early enzymology.
- Suzuki, H. (2015). How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ISBN 978-981-4463-92-8.
- Cornish-Bowden A (2012). Fundamentals of Enzyme Kinetics (4th изд.). Weinheim: Wiley-VCH. ISBN 978-3527330744.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 5. izdanje. Spektrum Akademischer Verlag, Heidelberg – Berlin. 2003. ISBN 978-3-8274-1303-1.
- David Fell: Understanding the Control of Metabolism. Portland Press Ltd, London 1997. 2003. ISBN 978-1-85578-047-7.
- Alfred Schellenberger (ed): Enzymkatalyse. Einführung in die Chemie, Biochemie und Technologie der Enzyme. Gustav Fischer Verlag, Jena. 1989. ISBN 978-3-540-18942-8.
- Donald Voet, Judith G. Voet (2004). Biochemistry (3rd изд.). London: John Wiley & Sons Inc. ISBN 978-0-471-39223-1.
- Maria-Regina Kula: Enzyme in der Technik, Chemie in unserer Zeit, 14. Jahrg. 1980, Nr. 2. стр. 61–70, ISSN 0009-2851
- Brigitte Osterath, Nagaraj Rao, Stephan Lütz, Andreas Liese: Technische Anwendung von Enzymen. Chemie in unserer Zeit 41(4). стр. 324–333 (2007), ISSN 0009-2851
Спољашње везе[уреди | уреди извор]
- PDBsum Датотека познатих 3Д структура ензима
- BRENDA, компилација информација и литературе свих познатих ензима
- Expanding the toolbox of cytochrome P450s through enzyme engineering Архивирано на сајту Wayback Machine (26. фебруар 2014)