Малтоза
Изглед
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
2-(hydroxymethyl)-6-[4,5,6-trihydroxy-2-(hydroxymethyl)oxan-3-yl]oxyoxane-3,4,5-triol
| |||
| Други називи
4-O-α-D-Glucopyranosyl-D-glucose
Isomaltose 6-O-α-D-Glucopyranosyl-D-glucose | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.000.651 | ||
| MeSH | Maltose | ||
| |||
| Својства | |||
| C12H22O11 | |||
| Моларна маса | 342,30 g/mol | ||
| Агрегатно стање | бели прах или кристали | ||
| Густина | 1,54 g/cm3[3] | ||
| Тачка топљења | 160–165 °C (анхидрат) 102-103 °C (монохидрат) | ||
| 1.080 g/mL (20 °C) у води[3] | |||
| Хирална ротација [α]D | +140.7º (H2O, c = 10)[4][4] | ||
| Сродна једињења | |||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |||
| Референце инфокутије | |||
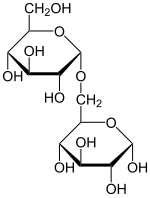
Малтоза, је дисахарид изграђен од две јединице глукозе спојене α(1→4) везом. Други је члан важне биохемијске серије глукозних ланаца. Додатак још једне јединице глукозе даје малтотриозу, док је ланац четири глукозе малтотетроза, итд.[5] Даље додавање даје декстрине, који се такође називају малтодекстринима, и коначно скроб.
Малтоза се хидролизом може разложити на два молекула глукозе. У живим организмима, ензим малтаза ово постиже врло брзо.[6] У лабораторији загревање са јаком киселином неколико минута постиже исти ефекат.
Галерија
[уреди | уреди извор]-
Сируп малтозе
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б MSDS за малтозу монохидрат Архивирано на сајту Wayback Machine (12. септембар 2006), Приступљено 12. 4. 2013.
- ^ а б Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ David L. Nelson; Michael M. Cox (2005). Principles of Biochemistry (IV изд.). New York: W. H. Freeman. ISBN 0-7167-4339-6.
- ^ Thomas L. Lemke; David A. Williams, ур. (2002). Foye's Principles of Medicinal Chemistry (5. изд.). Baltimore: Lippincott Willams & Wilkins. стр. 647. ISBN 0781744431.
Литература
[уреди | уреди извор]Спољашње везе
[уреди | уреди извор]- Детаљан увид у протеин који везује малтозу