Alkan

Alkani su zasićeni ugljovodonici, tj. oni ne poseduju višestruke veze između atoma ugljenika. Razlika između metana i etana je samo u jednoj CH2 grupi. Razlika između svakog sledećeg alkana je takođe u jednoj CH2 grupi. Takav tip hemijskih jedinjenja čiji se susedni članovi razlikuju za pojedinu grupu (u ovom slučaju za CH2 grupu) naziva se homologi red.[1]
Nazivaju se još i parafini (od latinskog parum affinis - nedovoljno afiniteta) što je posledica činjenice da alkani nemaju funkcionalnu grupu kao centar reaktivnosti molekula i da su generalno veoma postojana hemijska jedinjenja.
Predstavnici i nomenklatura[uredi | uredi izvor]
U prošlosti, dok je bio poznat mali broj organskih jedinjenja, svako je imalo svoje ime. Međutim kako je broj poznatih organskih jedinjenja rastao, postalo je jasno da je potreban novi sistem po kome će ime organskih jedinjenja da pokazuje sastav i strukturu tog organskog jedinjenja. Takav sistem je usvojen 1892. godine u Ženevi. Od tog vremena on se neprestano dopunjava na sastancima komisije za nomenklaturu Internacionalne unije za čistu i primenjenu hemiju (IUPAC). Odluke IUPAC-a poštuju sve zemlje sveta. Pravila IUPAC-a su veoma prosta, ime organskog jedinjenja je u stvari opis njegove strukture: jedan deo imena opisuje ugljenikov skelet, a drugi funkcionalne grupe koje su za taj skelet vezane.
Prva četiri člana homologog niza nose nazive metan, etan, propan i butan. Od alkana sa pet ugljenikovih atoma, imena se dobijaju kada se na grčki broj koji označava broj ugljenikovih atoma doda nastavak an.

Alkani normalnog (opruženog) niza, n-alkani, su pripadnici homologog niza. Račvasti nizovi su sa druge strane strukturni izomeri normalnog niza pa ih IUPAC-ova nomenklatura tako i tretira. Pre standardizacije nomenklature, račvasti alkani su dobijali prefikse (izo-, neo-, terc-...) dok je osnovni naziv poticao od ukupnog broja ugljenika u molekulu.
| Normalan | Razgranat |
|---|---|
 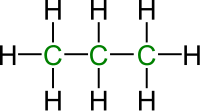 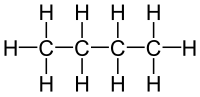 |
 |
IUPAC daje nekoliko osnovnih pravila za imenovanje svih alkana:
- Naći najduži niz
- najduži niz postaje osnovni alkan dok su sve bočne grupe supstituenti tog osnovnog niza
- Niz sa više supstituenata ima prednost
- drugačije rečeno, onaj niz koji ima prostije supstituente ima prioritet
- Posmatraj supstituente i imenuj ih
- ukoliko je bočni niz račvast, ime dobija tako što se traži najduži niz počevši od ugljenika kod kojeg je došlo do račvanja, a zatim se imenuju njegovi supstituenti. Celokupan naziv se stavlja u zagradu, a ako ih je više, umesto tradicionalnih prefiksa di-, tri-, tetra-, za složene supstituente koriste se bis-, tris-, tetrakis-.
- radi pojednostavljivanja imenovanja bočnih račvastih nizova, IUPAC dozvoljava sledeće trivijalne nazive: izopropil, izobutil, sec-butil, terc-butil, neopentil.
- Numeracija počinje od onog kraja kome je najbliži supstituent
- kada su oba kraja podjednako blizu supstituentu, numeracija se vrši prema prvom mestu razlikovanja odnosno tako da su pozicije supstituenata označene što manjim brojevima
- Ređanje naziva supstituenata se vrši po abecednom redosledu (a ne numerički)
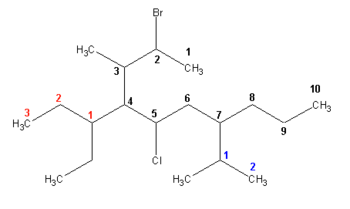
2-brom-4-(1-etilpropil)-5-hlor-3-metil-7-(1-metiletil)dekan
Geometrija molekula[uredi | uredi izvor]
Molekularna geometrija alkana direktno utiče na njihove fiziko-hemijske osobine. Specifična geometrija je proizvod stvaranja kovalentne sigma veze između atoma ugljenika koja je preduslovljena hibridizacijom jedne s i tri p orbitale ugljenika, koji je uvek četvorovalentan u organskim jedinjenjima. sp3 hibridizacija prisutna je u svim alkanima i ona uslovljava tetraedarsko prostorno raspoređivanje hibridizovanih atomskih orbitala.
Dužina i ugao između veza[uredi | uredi izvor]
Dužina veza kod alkana je relativno konstantna i iznosi za C-C vezu: 1,54 A° a za C-H vezu: 1,1 A°. Atomske orbitale su raspoređenje u zamišljenom tetraedru tako da ugao između C-H veza iznosi 109°28'. Sigma veza je relativno elastična i dozvoljava rotiranje oko nje, a nastaje čeonim koaksijalnim preklapanjem hibridnih orbitala.
Konformacije[uredi | uredi izvor]

Priroda sigma veza između sp3 hibridizovanih C atoma u nizu je takva da je moguće uslovno slobodno rotiranje molekula oko ose te veze. Ovo se dešava u cilju maksimalnog smanjenja elektrostatičkih odbojnih sila između elektronskih oblaka orbitala. U šematski prikazanim slučajevima veze između ugljenika i vodonika nalaze se postavljene paralelno jedna naspram druge. Ovakva konformacija se naziva zaklonjena ili eklipsna, i odlikuje je visok stepen nestabilnosti zbog torzionog (eklipsnog) napona koji se javlja i teži da iskrivi vezu. Zato se, rotiranjem oko sigma veze, uspostavlja daleko stabilnija stepeničasta konformacija gde su elektronski oblaci fazno pomereni a stepen interakcije između suprotnih naelektrisanja sveden na minimum. Ovakvi različiti prostorni oblici nazivaju se rotomeri, a oblici sa najmanjim sadržajem energije konformeri. Rezultujuća količina energije je zapravo rezultanta više interakcija: torzionog napona, ugaonog napona, van der Valsovog napona i napona usled deformacije veze. Konformacije etana su veoma jednostavne dok one viših alkana, a posebno cikloalkana imaju daleko veću složenost.
Nalaženje i laboratorijsko dobijanje[uredi | uredi izvor]
Alkani se u velikim količinama mogu naći u nafti (čiji najveći deo čine) i u prirodnom gasu (metan, etan, propan, butan). Metan nastaje usled truljenja organskih materija i može se naći u močvarama, a ima ga i u rudnicima. Metan u rudnicima predstavlja veoma veliku opasnost jer kada se naiđe na njegove zalihe može da izazove eksploziju jer pri većim koncentracijama može i spontano da se zapali.
Listovi karfiola, kupusa, kao i kora jabuke u sebi sadrže alkan C29H60 koji služi kao zaštita od gubitka vlage, dok većina drugih biljaka kao zaštitu koristi biljne voskove koji su po sastavu estri.
Alkani se mogu dobiti iz raznih jedinjenja redukcijom. U laboratoriji se metan dobija zagrevanjem natrijum-acetata sa natrijum hidroksidom:
- CH3COOH-Na + NaOH → CH4 + Na2CO3
Druge metode uključuju:
- Katalitičku hidrogenizaciju alkana na paladijumovoj (ili platine/nikla) rešetki
- R-CH2-CH=CH-R + H2 → R-CH2-CH2-CH2-R
- Redukciju alkil-halogenida u kiseloj sredini
- RX + Zn + H+ → RH + Zn+ + X-
- Reakcijom Grinjarevog reagensa (magnezijuma u „suvom“ etru) i hidrolizom dobijenog proizvoda
- RX + Mg → RMgX + H2O → RH + MgX(OH)
Fizičke osobine[uredi | uredi izvor]
Fizičke osobine alkana zavise od nekoliko faktora. Prvi i najvažniji je broj ugljenikovih atoma. Drugi je struktura niza.
- Pod normalnim uslovima alkani koji sadrže od 1 do 4 ugljenikovih atoma su u gasovitom agregatnom stanju, alkani koji sadrže od 5 do 17 ugljenikovih atoma su u tečnom agregatnom stanju, a sa preko 18 su u čvrstom.
- Svaki sledeći predstavnik homologog niza ima temperaturu ključanja za 20-30 °C višu od prethodnog. Ovo se objašnjava činjenicom da između molekula vladaju Londonove sile a da se dipol daleko lakše indukuje kod većih molekula, pa su kod njih mećumolekulske sile veće.
- Račvanjem niza se uvek smanjuje temperatura ključanja. Ovo se objašnjava smanjenjem dodirnih površina molekula, što smanjuje disperzione sile.
Alkani se kao i većina neorganskih jedinjenja rastvaraju u nepolarnim rastvaračima, a u polarnim (npr. voda) se ne rastvaraju.
Hemijske osobine - reakcije[uredi | uredi izvor]
Alkani su slabo reaktivna hemijska jedinjenja, pod normalnim uslovima ne reaguju sa jakim kiselinama kao što su sulfatna kiselina i hloridna kiselina a ni sa jakim bazama kao što su natrijum hidroksid i kalijum hidroksid. Alkani ne reaguju ni sa oksidacionim sredstvima kao što su kalijum permanganat ili kalijum dihromat, ali je njihova oksidacija moguća. Alkani su nereaktivni jer su izgrađeni od sigma C-C-C veza. Ove veze se teško raskidaju jer je potrebno uložiti veliku energiju za taj proces. Zato alkani reaguju samo na posebnim uslovima.
Oksidacija[uredi | uredi izvor]
Oksidacija je proces sagorevanja ugljovodika. Pri potpunom sagorevanju bilo kog ugljovodonika nastaje ugljenik(IV)-oksid(ugljendioksid) i voda.
- CH4 + 2O2 ---------> CO2 + 2H2O
Halogenovanje[uredi | uredi izvor]
Za alkane je karakteristična reakcija supstitucije halogenim elementima pri čemu nastaju derivati alkana - alkil halogenidi. U mehanizam reakcije uključeni su slobodni radikali, sama reakcija je veoma egzotermna i odvija se pod specifičnim uslovima. Odvija se u tri faze:
- Inicijacija - u kojoj dolazi do homolitičkog raskidanja kovalentne veze u molekulu halogena npr. hlora. Da bi se ovo desilo potrebno je prisustvo sunčeve svetlosti odnosno ultravioletnog zračenja. Pritom nastaju slobodni radikali sa po jednim nesparenim elektronom koji su inicijatori reakcije.
- Cl2 → 2 Cl·
- Propagacija - u kojoj dolazi do reakcije između slobodnih radikala i alkana. Najčešće je dvostepena pri čemu je proizvod monosupstituisan ali u zavisnosti od koncentracije hlora, može doći i do supstituisanja većeg broja vodonika.
- CH4 + Cl· → CH3· + HCl
- CH3· + Cl2 → CH3Cl + Cl·
- u višku hlora, može dalje da nastaje:
- CH3Cl + Cl· → CH2Cl· + HCl
- CH2Cl· + Cl2 → CH2Cl2 + Cl·
- ...
- Terminacija - nakon supstituisanja većeg broja vodonika, povećava se šansa sudara i reakcije slobodnih radikala međusobno odnosno njihove rekombinacije do neutralnih molekula. Ovime nestaju inicijatori reakcije i ona se postepeno gasi. Proizvod reakcije je usled toga uvek smeša različitih produkata reakcije čije se udeo može pretpostaviti preko njihove statističke distribucije.
- Cl· + Cl· → Cl2
- CH3· + CH3· → C2H6
- CH3· + Cl· → CH3Cl
Regioselektivnost halogena u reakciji sa alkanima[uredi | uredi izvor]
U slučaju nižih alkana, kao što su metan i etan, relativno je lako predvideti procentualnu distribuciju proizvoda. Sama reaktivnost halogena, pak, takođe varira sa fluorom kao najreaktivnijim, kod koga je najteže predvideti proizvode, i hlorom i jodom sa znatno manjom reaktivnošću. Takođe, prisustvo bočnih grupa usložnjava predviđanja jer postoji mogućnost supstituisanja kako vodonika iz osnovnog niza tako i onih sa bočnih grupa. U tom slučaju za procenu distribucije, koristi se osobina regioselektivnosti koju pokazuju halogeni, a koja se ogleda u većem afinitetu supstituisanja vodonika sa što sekundarnijih ugljenika. Ne preterano veliku ulogu igra i pozitivan induktivni efekat alkil grupa.
Poznavanje reaktivnosti halogena kao i njihove regioselektivnosti posebno je važno u industrijskim postupcima dobijanja alkil halogenida gde se uslovi reakcije podešavaju tako da se dobije najveći procenat željenog proizvoda.
| alkan | F (25 °C) | Cl (25 °C) | Br (150 °C) |
| H3C-H | 0,5 | 0,004 | 0,002 |
| RH2C-H | 1 | 1 | 1 |
| R2HC-H | 1,2 | 4 | 80 |
| R3C-H | 1,4 | 5 | 1700 |
Stabilnost alkil-radikala[uredi | uredi izvor]

Prilikom slobodnoradikalskog halogenovanja alkana nastaju alkil-radikali koji u zavisnosti od početnog reaktanta mogu da budu primarni, sekundarni ili tercijarni. To su sp2 hibridizovane, planarne čestice. Stabilnost ovako dobijenih alkil-radikala varira i objašnjava se pojavom hiperkonjugacije. Naime, radikalske p orbitale se preklapaju sa sigma orbitalama C-C veza stabilizujući radikal. Samim tim, što se više bočnih grupa nalazi na radikalskom ugljeniku, radikal je stabilniji i veća je verovatnoća njegovog nastanka. Duži nizovi, u cilju nastajanja što stabilnijeg radikala, podležu i skeletnom premeštanju čime se često dobijaju naizgled neočekivani proizvodi. S tim treba napomenuti i da je metil-radikal veoma nestabilna čestica.
Krakovanje (piroliza)[uredi | uredi izvor]
Krakovanje ili piroliza je proces razlaganja ugljovodonika na ugljenik i vodonik ili neki drugi ugljovodonik i vodonik. Proces se obavlja na vrlo visokim temperaturama(preko 500 °C) i bez vazduha. Ovaj proces je veoma bitan u industriji nafte.
- CH4 --> C + 2H2, i
- C2H6 --> C2H4 + H2
Primena alkana[uredi | uredi izvor]
Alkani se upotrebljavaju kao gorivo. Koriste se i za proizvodnju velikog broja organskih supstancija u hemijskoj industriji.
Hazardi[uredi | uredi izvor]
Metan je zapaljiv, eksplozivan i opasan za udisanje; pošto je to gas bez boje i mirisa, poseban oprez se mora voditi oko metana.[2] Etan je takođe izuzetno zapaljiv, eksplozivan i opasan za udisanje.[3] I jedno i drugo može izazvati gušenje.[2][3] Propan je takođe zapaljiv i eksplozivan,[4] i može izazvati pospanost ili nesvest ako se udiše.[4] Butan predstavlja iste opasnosti kao i propan.[5]
Alkani takođe predstavljaju pretnju po životnu sredinu. Razgranati alkani imaju manju biorazgradljivost od nerazgranatih alkana.[6] Metan se smatra gasom staklene bašte koji je najopasniji po životnu sredinu,[7] iako je količina metana u atmosferi relativno mala.[7] Prema podacima iz aprila 2022, koncentracije metana u atmosferi bile su oko 1910 ppb.[8]
Vidi još[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I izd.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ a b „CDC - METHANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov. Pristupljeno 19. 9. 2017.
- ^ a b „CDC - ETHANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov. Pristupljeno 19. 9. 2017.
- ^ a b „CDC - PROPANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov. Arhivirano iz originala 23. 11. 2017. g. Pristupljeno 19. 9. 2017.
- ^ „CDC - BUTANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov. Pristupljeno 19. 9. 2017.
- ^ Woodside, Gayle; Kocurek, Dianna (26. 5. 1997). Environmental, Safety, and Health Engineering. John Wiley & Sons. ISBN 9780471109327.
- ^ a b „Pollutant Fact Sheet”. apps.sepa.org.uk. Pristupljeno 19. 9. 2017.
- ^ „Increase in atmospheric methane set another record during 2021”. www.noaa.gov. 7. 4. 2022. Pristupljeno 2023-02-17.
