Калцијум хлорид

| |

| |
| Називи | |
|---|---|
| IUPAC назив
Калцијум хлорид
| |
| Други називи
Неутрални калцијум хлорид; калцијум(II) хлорид, калцијум дихлорид, E509
| |
| Идентификација | |
| |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.030.115 |
| EC број | 233-140-8 |
| Е-бројеви | E509 (регулатор киселости, ...) |
| RTECS | EV9800000 |
| UNII |
|
| |
| |
| Својства | |
| CaCl2 | |
| Моларна маса | 110,98 g·mol−1 |
| Агрегатно стање | Бели прах, хигроскопан |
| Мирис | Без мириса |
| Густина |
|
| Тачка топљења | 772 °C (1.422 °F; 1.045 K) анхидрат[7] 260 °C (500 °F; 533 K) монохидрат, разлаже се 175 °C (347 °F; 448 K) дихидрат, разлаже се 45,5 °C (113,9 °F; 318,6 K) тетрахидрат, разлаже се[7] 30 °C (86 °F; 303 K) хексахидрат, разлаже се[3] |
| Тачка кључања | 1.935 °C (3.515 °F; 2.208 K) анхидрат[3] |
| анхидрат: 74,5 g/100 mL (20 °C)[4] Хексахидрат: 49,4 g/100 mL (−25 °C) 59,5 g/100 mL (0 °C) 65 g/100 mL (10 °C) 81,1 g/100 mL (25 °C)[3] 102,2 g/100 mL (30.2 °C) α-Тетрахидрат: 90,8 g/100 mL (20 °C) 114,4 g/100 mL (40 °C) Дихидрат: 134,5 g/100 mL (60 °C) 152,4 g/100 mL (100 °C)[5] | |
| Растворљивост |
|
| Растворљивост у етанол |
|
| Растворљивост у метанол |
|
| Растворљивост у ацетон | 0,1 g/kg (20 °C)[6] |
| Растворљивост у пиридине | 16,6 g/kg[6] |
| Киселост (pKa) |
|
| Магнетна сусцептибилност | −5,47·10−5 cm³/mol[3] |
| Индекс рефракције (nD) | 1,52 |
| Вискозност |
|
| Структура | |
| Кристална решетка/структура |
|
| Кристалографска група |
|
| |
a = 6,259 Å, b = 6,444 Å, c = 4,17 Å (анхидрат, 17 °C)[8] α = 90°, β = 90°, γ = 90°
| |
| Геометрија молекула | Октаедралан (Ca2+, анхидрат) |
| Термохемија | |
| Специфични топлотни капацитет, C | |
Стандардна моларна
ентропија (S |
108,4 J/mol·K[3][7] |
Стандардна енталпија
стварања (ΔfH |
|
Гибсова слободна енергија (ΔfG˚)
|
−748,81 kJ/mol[3][7] |
| Фармакологија | |
| A12AA07 (WHO) B05XA07, G04BA03 | |
| Опасности | |
| Главне опасности | Иритант |
| ГХС пиктограми |  [9] [9]
|
| ГХС сигналне речи | Упозорење |
| H319[9] | |
| P305+351+338[9] | |
| NFPA 704 | |
| Смртоносна доза или концентрација (LD, LC): | |
LD50 (средња доза)
|
1,000-1,400 mg/kg (пацови, орално)[10] |
| Сродна једињења | |
Други анјони
|
|
Други катјони
|
|
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Калцијум хлорид (CaCl2) је неорганско, јонско једињење калцијума и хлора. Веома је растворљиво у води. Ово је со, чврста на собној температури. Добија се директно из руде, али се велике количине овога једињења добијају и Солвејевим поступком. Ово је јако хигроскопно једињење. Гради ди, тетра и хексахидрате.
Калцијум хлорид се често среће као хидратисана чврста супстанца са општом формулом CaCl2(H2O)x, где је x = 0, 1, 2, 4 и 6. Ова једињења се углавном користе за одлеђивање и контролу прашине. Будући да је безводна сол хигроскопна, користи се као средство за сушење.[12]
Хемијске особине
[уреди | уреди извор]Калцијум хлорид може да служи као донор јона калцијума у растворима пошто су многа једињења калцијума нерастворљива у води:
3 CaCl2(aq) + 2 K3PO4 (aq) → Ca3(PO4)2 (s) + 6 KCl (aq)
Из отопљеног CaCl2 се може путем електролизе добити метални калцијум:
Примена
[уреди | уреди извор]Калцијум хлорид се користи:
- у медицини као средство при недостатку калцијума
- за дехидратацију гасова
- за добијање различитих једињења калцијума
- за уклањање трагова воде из органских супстанци
- заједно са натријум хлоридом као средство за спречавање стварања леда на путевима
Припрема
[уреди | уреди извор]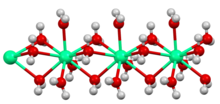
У већем делу света калцијум хлорид се добија из кречњака као нуспроизвод Солвејевog поступка, који следи ову нето реакцију:[12]
- 2 NaCl + CaCO3 → Na2CO3 + CaCl2
Северноамеричка потрошња у 2002. години износила је 1.529.000 тона (3,37 милијарди фунти).[13]
У САД се већина калцијум хлорида добија пречишћавањем из слане воде.
Као и код већине ринфузних производа од соли, обично се јављају трагови осталих катјона алкалних метала и земноалкалних метала (групе 1 и 2) и других анјона из халогена (група 17), али концентрације су незнатне. Појава
Појава
[уреди | уреди извор]Калцијум хлорид се јавља у виду ретких евапоритних минерала сињарита (дихидрат) и антарктицит (хексахидрат).[14][15][16] Још један познати природни хидрат је гијарајит - тетрахидрат.[16][17] Сродни минерали хлорокалцит (калијум калцијум хлорид, KCaCl3) и тахихидрит (калцијум магнезијум хлорид, Ca Mg2Cl6·12H2O) су такође врло ретки.[16][18][19] То важи и за рорисит, CaClF (калцијум хлорид флуорид).[16][20]
Хазарди
[уреди | уреди извор]Иако није токсичан у малим количинама када је влажан, изразито хигроскопна својства нехидратисане соли представљају извесну опасност. Калцијум хлорид може деловати надражујуће исушивањем влажне коже. Чврсти калцијум хлорид се егзотермно раствара, а опекотине се могу јавити и усној шупљини и једњаку ако се прогутају. Гутање концентрованих раствора или чврстих производа може проузроковати гастроинтестиналну иритацију или стварање чирева.[21]
Конзумација калцијум хлорида може довести до хиперкалцемије.[22]
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г д ђ е ж з Lide, David R., ур. (2009). CRC Handbook of Chemistry and Physics (90th изд.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ „Calcium chloride (anhydrous)”. ICSC. International Programme on Chemical Safety and the European Commission.
- ^ Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd изд.). New York: D. Van Nostrand Company. стр. 196.
- ^ а б в г д ђ Anatolievich, Kiper Ruslan. „Properties of substance: calcium chloride”. chemister.ru. Приступљено 2014-07-07.
- ^ а б в г д ђ Pradyot, Patnaik (2019). Handbook of Inorganic Chemicals. The McGraw-Hill Companies, Inc. стр. 162. ISBN 978-0-07-049439-8.
- ^ а б в г Müller, Ulrich (2006). Inorganic Structural Chemistry. wiley.com (2nd изд.). England: John Wiley & Sons Ltd. стр. 33. ISBN 978-0-470-01864-4.
- ^ а б в Sigma-Aldrich Co. Retrieved on 2014-07-07.
- ^ Donald E. Garrett (2004). Handbook of Lithium and Natural Calcium Chloride. Elsevier. стр. 379. ISBN 978-0080472904. Приступљено 29. 08. 2018. „Its toxicity upon ingestion, is indicated by the test on rats: oral LD50 (rat) is 1.0–1.4 g/kg (the lethal dose for half of the test animals, in this case rats...)”
- ^ „MSDS of Calcium chloride”. fishersci.ca. Fisher Scientific. Приступљено 2014-07-07.
- ^ а б Kemp, Robert; Keegan, Suzanne E. (2000). „Calcium Chloride”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a04_547.
- ^ Calcium Chloride SIDS Initial Assessment Profile, UNEP Publications, SIAM 15, Boston, 22–25 October 2002, page 11.
- ^ „Sinjarite”.
- ^ „Antarcticite”.
- ^ а б в г List of Minerals
- ^ „Ghiaraite”.
- ^ „Chlorocalcite”.
- ^ „Tachyhydrite”.
- ^ „Rorisite”.
- ^ „Product Safety Assessment (PSA): Calcium Chloride”. Dow Chemical Company. 2. 5. 2006. Архивирано из оригинала 17. 9. 2009. г. Приступљено 22. 7. 2008.
- ^ „Calcium Chloride Possible Side Affects”. Архивирано из оригинала 27. 07. 2020. г. Приступљено 01. 05. 2021.
Литература
[уреди | уреди извор]- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
Додатна литература
[уреди | уреди извор]- „Difusivity of calcium chloride”. doi:10.1021/ja01131a021.
Спољашње везе
[уреди | уреди извор]- International Chemical Safety Card 1184[мртва веза]
- Product and Application Information (Formerly Dow Chemical Calcium Chloride division)
- „Report on steel corrosion by chloride including CaCl2” (PDF). Архивирано из оригинала (PDF) 16. 06. 2011. г.
- „Collection of calcium chloride reports and articles”. Архивирано из оригинала 06. 02. 2009. г.
- „Calcium chloride, Anhydrous MSDS”. Архивирано из оригинала 15. 10. 2012. г.
- Centers for Disease Control and Prevention, National Institutes of Occupational Safety and Health, "Calcium Chloride (anhydrous)"

