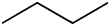Butan (jedinjenje)
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| Preferisani IUPAC naziv
Butan[3] | |||
| Sistemski IUPAC naziv
Tetrakarben (nije preporučeno[3]) | |||
| Drugi nazivi | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| Bajlštajn | 969129 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.136 | ||
| EC broj | 203-448-7 | ||
| E-brojevi | E943a (glazing agents, ...) | ||
| Gmelin Referenca | 1148 | ||
| KEGG[4] | |||
| MeSH | butane | ||
| RTECS | EJ4200000 | ||
| UNII | |||
| UN broj | 1011 | ||
| |||
| |||
| Svojstva | |||
| C4H10 | |||
| Molarna masa | 58,12 g·mol−1 | ||
| Agregatno stanje | bezbojni gas | ||
| Miris | Slično benzinu ili prirodnom gasu[1] | ||
| Gustina | 2,48 kg/m3 (на 15 °C (59 °F)) | ||
| Tačka topljenja | −140 °C; −220 °F; 133 K | ||
| Tačka ključanja | −1 °C; 30 °F; 272 K | ||
| 61 mg/L (na 20 °C (68 °F)) | |||
| log P | 2,745 | ||
| Napon pare | ~170 kPa na 283 K [7] | ||
| kH | 11 nmol Pa−1 kg−1 | ||
| Konjugovana kiselina | Butanijum | ||
| Magnetna susceptibilnost | −57,4·10−6 cm³/mol | ||
| Termohemija | |||
| Specifični toplotni kapacitet, C | 98,49 J/(K·mol) | ||
Standardna entalpija
stvaranja (ΔfH |
−126,3–−124,9 kJ/mol | ||
Std entalpija
sagorevanja (ΔcH⦵298) |
−2,8781–−2,8769 MJ/mol | ||
| Opasnosti[8] | |||
| GHS piktogrami |  
| ||
| GHS signalne reči | Opasnost | ||
| H220 | |||
| P210 | |||
| NFPA 704 | |||
| Tačka paljenja | −60 °C (−76 °F; 213 K) | ||
| 405 °C (761 °F; 678 K) | |||
| Eksplozivni limiti | 1,8–8,4% | ||
| Granice izloženosti zdravlja u SAD (NIOSH): | |||
PEL (дозвољено)
|
нема[1] | ||
REL (preporučeno)
|
TWA 800 ppm (1900 mg/m³)[1] | ||
IDLH (trenutna opasnost)
|
1600 ppm[1] | ||
| Srodna jedinjenja | |||
Srodna alkani
|
|||
Srodna jedinjenja
|
Perfluorobutan | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |||
| Reference infokutije | |||
Butan, pošto ima izomere obeležava se i sa n-butan, četvrti je pripadnik homologog reda alkana. Racionalna formula butana je CH3CH2CH2CH3. Butan se često koristi i kao naziv za n-butan i za njegov izomer 2-metilpropan (poznat i pod nazivom izobutan), CH3CH(CH3)2. Butan je veoma zapaljiv, slabo rastvorljiv gas.
Ime butan potiče od korena but- (od buterne kiseline, nazvane po grčkoj reči za puter) i -ane. Otkrio ga je hemičar Edvard Frankland 1849. godine.[9] Edmund Ronalds je pronašao butan rastvoren u sirovoj nafti 1864. Edmund Ronalds, koji je prvi opisao njena svojstva.[10][11]
Izomeri[uredi | uredi izvor]
| Uobičajeni naziv | normalni butan nerazgranati butan n-butan |
izobutan i-butan |
| IUPAC назив | бутан | метилпропан |
| Молекуларни дијаграм |

|

|
| Скелетални дијаграм |

|
Ротација око централне C−C veze proizvodi dve različite konformacije (trans i gauči) za n-butan.[12]
Reakcije i primena[uredi | uredi izvor]

Kada je kiseonika dostupan u izobilju, butan sagoreva i formira ugljen-dioksid i vodenu paru; kada je kiseonik ograničen, mogu se formirati i ugljenik (čađ) ili ugljen-monoksid. Butan je gušći od vazduha.
Kada ima dovoljno kiseonika:
- 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
Kada je pristup kiseoniku ograničen:
- 2 C4H10 + 9 O2 → 8 CO + 10 H2O
Ukoliko je vazduh zagađen, umesto ugljen-dioksida mogu nastati i čađ ili ugljen-monoksid. Granice zapaljivosti u smesi sa vazduhom (u zapreminskim procentima gasa u vazduhu) su 1,9 ÷ 8,5 vol% (uz prisustvo izvora upaljenja). Butan je jedan od dva glavna sastojka „plina“ („propan-butan“, tj. tečni naftni gas — TNG) koji se koristi za kuvanje, a takođe i kao pogonsko gorivo za vozila („autogas“ — TNG). Usled oštećivanja ozonskog omotača zemlje od freona povećava se primena izobutana u rashladnim uređajima.
Po težini, butan sadrži oko 49,5 MJ/kg (13,8 kWh/kg; 22,5 MJ/lb; 21.300 Btu/lb) ili po zapremini tečnosti 29,7 megadžula po litru (8,3 kWh/l; 112 MJ/U.S. gal; 107,000 Btu/U.S. gal).
Maksimalna temperatura adijabatskog plamena butana sa vazduhom je 2.243 K (1.970 °C; 3.578 °F).
n-Butan je sirovina za Dupontov katalitički proces za pripremu maleinskog anhidrida:
- 2 CH3CH2CH2CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O
n-Butan, kao i svi ugljovodonici, podleže hlorisanju slobodnih radikala dajući i 1-hloro- i 2-hlorobutane, kao i ekstenzivnije hlorisane derivate. Relativna stopa hlorisanja se delimično objašnjava različitim energijama disocijacije veze, 425 i 411 kJ/mol za dva tipa C-H veza.
Upotrebe[uredi | uredi izvor]
Normalni butan se može koristiti za blendiranje benzina, kao gas za gorivo, rastvarač za ekstrakciju mirisa, bilo sam ili u mešavini sa propanom, i kao sirovina za proizvodnju etilena i butadiena, ključnog sastojka sintetičke gume. Izobutan se prvenstveno koristi u rafinerijama za povećanje (povećanje) oktanskog broja motornog benzina.[13][14][15][16]
Kada se pomeša sa propanom i drugim ugljovodonicima, može se komercijalno nazvati tečni naftni gas, LPG. On se koristi se kao komponenta benzina, kao sirovina za proizvodnju baznih petrohemikalija u parnom krekingu, kao gorivo za upaljače za cigarete i kao propelant u aerosolnim sprejevima kao što su dezodoransi.[17]
Veoma čisti oblici butana, posebno izobutan, mogu se koristiti kao rashladna sredstva i u velikoj meri su zamenili halometane koji oštećuju ozonski omotač, na primer u frižiderima i zamrzivačima u domaćinstvu. Radni pritisak sistema za butan je niži nego za halometane, kao što je R-12, tako da sistemi R-12 kao što su sistemi za klimatizaciju u automobilima, kada se pretvore u čisti butan ne funkcionišu optimalno, i stoga se mešavina izobutana i propana koristi za davanje performansi sistema hlađenja koje su uporedive sa R-12.
Butan se takođe koristi kao gorivo za upaljače za uobičajeni upaljač ili butanski plamenik i prodaje se flaširan kao gorivo za kuvanje, roštilj i peći za kampovanje. Globalnim tržištem kanistera butana dominiraju južnokorejski proizvođači.[18]
Kao gorivo, često se meša sa malim količinama vodonik-sulfida i merkaptana koji nesagorelom gasu daju neprijatan miris koji ljudski nos lako detektuje. Na ovaj način se lako može identifikovati curenje butana. Dok su vodonik sulfid i merkaptani toksični, oni su prisutni u toliko niskim nivoima da opasnost od gušenja i požara od butana postaje problem daleko pre toksičnosti.[19][20] Većina komercijalno dostupnog butana takođe sadrži određenu količinu zagađujućeg ulja koje se može ukloniti filtracijom, ali koje će inače ostaviti talog na mestu paljenja i na kraju može blokirati ravnomeran protok gasa.[21] Butan koji se koristi za ekstrakciju mirisa ne sadrži ove zagađivače,[22] i gasovi butana mogu izazvati eksplozije gasa u prostorima sa lošom ventilacijom ako curenje ostane neprimećeno i ako se zapali varnicom ili plamenom.[8] Butan u svom najčistijem obliku se takođe koristi kao rastvarač u industrijskoj ekstrakciji ulja kanabisa.
-
Kanisteri butanskog gorivo za upotrebu u pećima za kampovanje
-
Butanski upaljač, prikazuje rezervoar tečnog butana
-
Kontejner aerosol spreja, koji može da koristi butan kao propelant
-
Boca butan gasa koji se koristi za kuvanje
Efekti i zdravstveni problemi[uredi | uredi izvor]
Udisanje butana može izazvati euforiju, pospanost, nesvesticu, asfiksiju, srčanu aritmiju, fluktuacije krvnog pritiska i privremeni gubitak pamćenja, kada se zloupotrebljava direktno iz kontejnera pod visokim pritiskom, i može dovesti do smrti od gušenja i ventrikularne fibrilacije. On ulazi u krvotok i u roku od nekoliko sekundi izaziva intoksikaciju.[23] Butan je najčešće zloupotrebljavana isparljiva supstanca u Velikoj Britaniji i bio je uzrok 52% smrtnih slučajeva povezanih sa rastvaračem 2000. godine.[24] Prskanjem butana direktno u grlo, mlaz tečnosti može dovesti do brzog hlađenja na −20 °C (−4 °F) širenjem, izazivajući produženi laringospazam.[25] Sindrom „iznenadne smrti inhalacijom“, koji je prvi opisao Bas 1970. godine,[26] najčešći je pojedinačni uzrok smrti uzrokovane rastvaračem, što rezultira u 55% poznatih fatalnih slučajeva.[25]
Vidi još[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ a b v g d NIOSH Džepni vodič hemijskih hazarda. „#0068”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ Hofmann, August Wilhelm Von (1. 1. 1867). „I. On the action of trichloride of phosphorus on the salts of the aromatic monamines”. Proceedings of the Royal Society of London. 15: 54—62. S2CID 98496840. doi:10.1098/rspl.1866.0018.
- ^ a b „Front Matter”. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. str. 4. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001. „Similarly, the retained names ‘ethane’, ‘propane’, and ‘butane’ were never replaced by systematic names ‘dicarbane’, ‘tricarbane’, and ‘tetracarbane’ as recommended for analogues of silane, ‘disilane’; phosphane, ‘triphosphane’; and sulfane, ‘tetrasulfane’.”
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ W. B. Kay (1940). „Pressure-Volume-Temperature Relations for n-Butane”. Industrial & Engineering Chemistry. 32 (3): 358—360. doi:10.1021/ie50363a016.
- ^ a b „Safety Data Sheet, Material Name: N-Butane” (PDF). USA: Matheson Tri-Gas Incorporated. 5. 2. 2011. Arhivirano iz originala (PDF) 1. 10. 2011. g. Pristupljeno 11. 12. 2011.
- ^ Russel, Colin A. (20. 3. 2009). „Frankland – the First Organometallic Chemist” (PDF). The Sixth Wheeler Lecture. Royal Society of Chemistry. Arhivirano iz originala 17. 4. 2017. g.
- ^ Watts, H.; Muir, M. M. P.; Morley, H. F. (1894). Watts' Dictionary of Chemistry. Watts' Dictionary of Chemistry. Longmans, Green. str. 385.
- ^ Maybery, C. F. (1896). „On the Composition of the Ohio and Canadian Sulphur Petroleums”. Proceedings of the American Academy of Arts and Sciences. 31: 1—66. JSTOR 20020618. doi:10.2307/20020618.
- ^ Roman M. Balabin (2009). „Enthalpy Difference between Conformations of Normal Alkanes: Raman Spectroscopy Study of n-Pentane and n-Butane”. J. Phys. Chem. A. 113 (6): 1012—9. Bibcode:2009JPCA..113.1012B. PMID 19152252. doi:10.1021/jp809639s.
- ^ MarkWest Energy Partners, L.P. Form 10-K. Sec.gov.
- ^ Copano Energy, L.L.C. Form 10-K. Sec.gov. Retrieved on 2012-12-03.
- ^ Targa Resources Partners LP Form10-k. Sec.gov. Retrieved on 2012-12-03.
- ^ Crosstex Energy, L.P. FORM 10-K. Sec.gov.
- ^ A Primer on Gasoline Blending Arhivirano na sajtu Wayback Machine (30. jun 2013). An EPRINC Briefing Memorandum.
- ^ „Entrepreneur overcame hardships of Chinese prison”. houstonchronicle.com. 21. 6. 2016. Pristupljeno 20. 9. 2018.
- ^ Gresham, Chip (16. 11. 2019). „Hydrogen Sulfide Toxicity: Practice Essentials, Pathophysiology, Etiology”
 . Medscape Reference. Pristupljeno 22. 3. 2021.
. Medscape Reference. Pristupljeno 22. 3. 2021.
- ^ 2. Methyl Mercaptan Acute Exposure Guideline Levels. NCBI Bookshelf. Committee on Acute Exposure Guideline Levels; Committee on Toxicology; Board on Environmental Studies and Toxicology; Division on Earth and Life Studies; National Research Council. National Academies Press (US). 26. 9. 2013.
- ^ „BHO Mystery Oil”. Skunk Pharm Research (na jeziku: engleski). 2013-08-26. Pristupljeno 2019-12-05.
- ^ „Final Report of the Safety Assessment of Isobutane, Isopentane, n-Butane, and Propane”. Journal of the American College of Toxicology. SAGE Publications. 1 (4): 127—142. 1982. ISSN 0730-0913. S2CID 208503534. doi:10.3109/10915818209021266.
- ^ „Neurotoxic Effects from Butane Gas”. thcfarmer.com. 19. 12. 2009. Pristupljeno 3. 10. 2016.
- ^ Field-Smith M.; Bland J. M.; Taylor J. C.; et al. „Trends in death Associated with Abuse of Volatile Substances 1971–2004” (PDF). Department of Public Health Sciences. London: St George’s Medical School. Arhivirano iz originala (PDF) 27. 3. 2007. g.
- ^ a b Ramsey J.; Anderson H. R.; Bloor K.; et al. (1989). „An introduction to the practice, prevalence and chemical toxicology of volatile substance abuse”. Hum Toxicol. 8 (4): 261—269. PMID 2777265. S2CID 19617950. doi:10.1177/096032718900800403.
- ^ Bass M. (1970). „Sudden sniffing death”. JAMA. 212 (12): 2075—2079. PMID 5467774. doi:10.1001/jama.1970.03170250031004.
Spoljašnje veze[uredi | uredi izvor]
![]() Mediji vezani za članak Butan na Vikimedijinoj ostavi
Mediji vezani za članak Butan na Vikimedijinoj ostavi