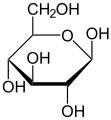
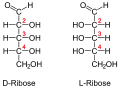Моносахарид

Моносахарид (од грчког monos: један, sacchar: шећер) угљени хидрат је (шећер) са најпростијом структуром.[1][2] Он се не може хидролизом разложити на простија једињења шећерног карактера.[3][4] Према броју угљеникових атома разликују се: триозе које су најпростији моносахариди са три C атома,[5][6] тетроза,[7] пентоза,[8] хексозе итд. Познат је велики број моносахарида. Они су веома ретко јављају у природи у слободном облику (само око двадесет типова моносахарида). Њихова једињења су, међутим, веома распрострањена. Општа формула је C
нХ
2нО
н. Они су обично безбојни, растворни у води, и кристалне материје. Неки моносахариди имају сладак укус.
Примери моносахарида су глукоза (декстроза), фруктоза (левулоза), и галактоза. Моносахариди су градивни блокови дисахарида (као што је сахароза и лактоза) и полисахарида (као што су целулоза и скроб). Сваки атом угљеника који има хидроксилну групу (што су скоро сви угљеници изузев примарног и крајњег угљеника) је хиралан, те је присутан знатан број изомерних форми, све од којих имају исту хемијску формулу. На пример, галактоза и глукоза су обе алдохексозе, али имају различите физичке структуре и хемијска својстава.
Подела моносахарида[уреди | уреди извор]
Моносахарид се деле у две групе у зависности од тога да ли њихов ациклични облик поседује алдехидну или кето групу на: алдозе и кетозе.
Друга подела се врши на основу броја угљикових атома у ланцу молекула моносахарида на: триозе, тетрозе, пентозе, хексозе
-
Глицеролалдехид (пример триозе)
-
Еритроза (пример тетрозе)
-
Рибоза (пример пентозе)
-
Глукоза (пример хексозе)

Моносахариди су често присутни у цикличном облику (хемиацетал). На основу броја атома у прстену деле са на:
- Фуранозе (петочлани прстен – 4 атома угљика и један атом кисеоника)
- Пиранозе (шесточлани прстен – 5 атома угљика и један атом кисеоника)[9]
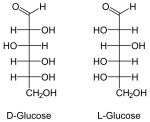
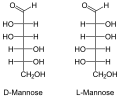
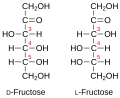
Припадност неког моносахарида L или D-серији је одређена положајем OH-групе на претпоследњем угљиковом атому, где нумерисање почиње од алдехидне, односно кето групе. Моносахариди, који на претпоследњем угљиковом атому имају OH-групу с десне стране, припадају D-серији оптичких изомера, без обзира да ли поларизовану светлост закрећу удесно или улево, а ако се та OH-група налази на левој страни, моносахарид припада L-серији. Закретање равни поларизоване светлости означава с (+) у десно и (-) у лево. Нпр. D(-) фруктоза значи да D-фруктоза закреће раван поларизоване светлости улево, а по конфигурацији припада D-серији.
Хавортове формуле[уреди | уреди извор]
-
Фишерова и Хавортова формула на примеру глукозе
-
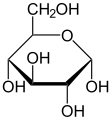
α-D-глукопираноза (Хавортова формула)
-
β-D-глукопираноза (Хавортова формула)
Циклична структура моносахарида се често представља Хавортовим формулама. Интермолекуларним формирањем хемиацетала настају оптички изомери који се означавају као α и β. α изомер има гликозидну OH-групу на десној страни, а у Хавортовој формули испод пиранозног прстена, док β изомер има ту OH- групу изнад прстена.
Преглед[уреди | уреди извор]
Моносахариди су једноставни шећери који се хидролизом не могу разградити на простија једињења који би имали својства угљених хидрата.[10][11] Најчешће су: хексозе (са 6 атома C) и пентозе (са 5 атома C). У хексозе спадају: глукоза, фруктоза, малтоза, лактоза, галактоза и маноза, а у пентозе: рибоза и дезоксирибоза.
Глукоза (гликоза или грожђани шећер) најчешће се сусреће у плодовима (посебно у грожђу), хемолимфи, крви и другим биљним и животињским органима и течностима. Улази у састав олигосахарида и полисахарида биљног и животињског поријекла, као што су сахароза, скроб, целулоза, гликоген и др.
Фруктоза (воћни шећер) у слободном стању најраширенија је у меду и плодовима, а код дисахарида улази у састав сложених молекула сахарозе, рафинозе и инулина.
Галактоза код биљака улази у састав полисахарида галактана, а код животиња и човека састојак је млечног шећера (лактоза).
Маноза се углавном сусреће код биљака, као мономер у молекулима сложених угљених хидрата - полисахарида.[12]
Пентозе су углавном састојци сложених макромолекула нуклеинских киселина, односно нуклеопротеида.
Осим самосталних једињења моносахариди могу учествовати у грађи осталих сложених угљених хидрата (олигосахарида и полисахарида). У зависности о присуству алдехидне и кето групе, деле се на алдозе и кетозе. Слатког су окуса и растворни у води.
Од моносахарида, као основни енергент, у живом свету најчешће се среће глукоза (са 6 атома угљеника), која улази и у састав: скроба, гликогена, целулозе и других једињења шећера. У структури молекула глукозе, на угљениковим атомима који носе ознаку 1 и 4, OH група може бити лево и десно од равни поларизиране свјетлости.
Деловањем минералних киселина (HCl, HN03, H2 S04) моносахариди могу се преводити у естре. Међу најбитнијим естрима за живи свет су глукоза-6-фосфат и глукоза-1, 6- фосфат, преко којих се одвија метаболизам шећера.
Спајањем 2-10 молекула моносахарида, уз издвајање одговарајућег броја олигосахарида (грч. oligoi = мало њих).[12]
Хемијске особине[уреди | уреди извор]
Редукција[уреди | уреди извор]
Моносахариди подлијежу реакцији редукције аналогно алдехидима при чему настају полихидроксилни алкохоли. Нпр. редукцијом D-глукозе настаје алкохол сорбитол.
Оксидација[уреди | уреди извор]
Оксидацијом алдехидне групе из моносахарида настају киселине. Продукт оксидације моносахарида зависи од јачине оксиданса. Благим оксидацијским средствима се оксидира алдехидна група (настају полихидрокси-монокарбоксилне киселине), док јача оксидацијска средства оксидирају и примарну OH-групу на последњем угљиковом атому. Нпр. оксидацијом глукозе настаје глуконска киселина, а даљом оксидацијом глукуронска киселина.
Квалитативне реакције[уреди | уреди извор]
Редукционе особине моносахарида се доказују следећим реакцијама:
- Редукција Фелинговог реагенса: [Cu(NH3)4](OH)2 помешан с раствором K, Na-тартарата у присуству редуцирајућих моносахарида настаје црвени талог бакар(I) оксида
- Редукција Бенедиктовог реагенса: Раствор Cu2+ јона комплексиран натријум цитратом у присуству редуцирајућих моносахарида даје црвени талог бакар(I) оксида
- Редукција Толенсовог реагенса: [Ag(NH3)2](OH) - у присуству редуцирајућих моносахарида редукује се Ag+ jon do elementarnog srebra, koje se istaloži na zidovima posude (reakcija srebrnog ogledala).
Vidi još[уреди | уреди извор]
Reference[уреди | уреди извор]
- ^ „Carbohydrates”. Chemistry for Biologists. Royal Society of Chemistry. Приступљено 10. 3. 2017.
- ^ Collins, Peter M.; Ferrier, Robert J. (1995). Monosaccharides : their chemistry and their roles in natural products (на језику: енглески). Robert J. Ferrier. Chichester: Wiley & Sons. стр. 4. ISBN 0-471-95343-1. OCLC 30894482.
- ^ „Definition of Saccharification”. www.merriam-webster.com (на језику: енглески). Архивирано из оригинала 7. 1. 2021. г. Приступљено 8. 9. 2020.
- ^ Steane, Richard. „Condensation and Hydrolysis”. www.biotopics.co.uk. Архивирано из оригинала 2020-11-27. г. Приступљено 2020-11-13.
- ^ „Trioses - Three Carbon Sugars”. Oxford University Press. Приступљено 2011-07-10.
- ^ „Glycolysis in Detail”. Ohio State University at Mansfield. Приступљено 2011-07-10.
- ^ Batt RD, Dickens F, Williamson DH (новембар 1960). „Tetrose metabolism. 2. The utilization of tetroses and tetritols by rat tissues”. The Biochemical Journal. 77 (2): 281—94. PMC 1204983
 . PMID 13687765. doi:10.1042/bj0770281.
. PMID 13687765. doi:10.1042/bj0770281.
- ^ "D-Ribose". PubChem compound webpage, accessed on 2010-02-06.
- ^ Robert Meyers (Editor): Encyclopedia of physical science and technology, Third edition, Ramtech Limited, Kalifornija. 2001. ISBN 978-0-12-227410-7.
- ^ Линдхорст, Тхисбе К. (2007). Ессентиалс оф Царбохyдрате Цхемистрy анд Биоцхемистрy (1ст изд.). Wилеy-ВЦХ. ИСБН 978-3-527-31528-4.
- ^ Робyт, Јохн Ф. (1997). Ессентиалс оф Царбохyдрате Цхемистрy (1 изд.). Спрингер. ИСБН 0-387-94951-8.
- ^ а б Међедовић С.; Маслић Е.; Хаџиселимовић Р. (2002). Биологија 2. Сарајево: Свјетлост. ИСБН 978-9958-10-222-6.
Литература[уреди | уреди извор]
- Гарретт, Региналд Х; Грисхам, Цхарлес M (2017). Биоцхемистрy. Бостон, МА: Ценгаге Леарнинг. стр. 755—794. ИСБН 978-1-305-57720-6.
- МцМуррy, Јохн. Органиц Цхемистрy. 7тх ед. Белмонт, ЦА: Тхомсон Броокс/Цоле, 2008. Принт.
- Пигман, Wард; Анет, Е.Ф.L.Ј. (1972). „Цхаптер 4: Мутаротатионс анд Ацтионс оф Ацидс анд Басес”. Ур.: Пигман анд Хортон. Тхе Царбохyдратес: Цхемистрy анд Биоцхемистрy Вол 1А (2нд изд.). Сан Диего: Ацадемиц Пресс. стр. 165—194.
- Пигман, Wард; Хортон, D. (1972). „Цхаптер 1: Стереоцхемистрy оф тхе Моносаццхаридес”. Ур.: Пигман анд Хортон. Тхе Царбохyдратес: Цхемистрy анд Биоцхемистрy Вол 1А (2нд изд.). Сан Диего: Ацадемиц Пресс. стр. 1—67.
- Цампбелл, Неил А.; Wиллиамсон, Брад; Хеyден, Робин Ј. (2006). Биологy: Еxплоринг Лифе. Бостон, Массацхусеттс: Пеарсон Прентице Халл. ИСБН 978-0-13-250882-7.
- Ахерн, К. Г.; К. Е. Ван Холде; Маттхеwс, C. Е. (1999). Биоцхемистрy (3рд изд.). Бењамин Цуммингс. ИСБН 978-0-8053-3066-3.
- Буртис, Царл А.; Асхwоод, Едwард Р.; (ПхД.), Барбара Бордер; Тиетз, Норберт W. (2001). Тиетз Фундаменталс оф Цлиницал Цхемистрy. Палме yаyıнцıлıк. ИСБН 978-0-7216-8634-9.
- Цоултер, Јохн Мерле; Барнес, Цхарлер Реид; Цоwлес, Хенрy Цхандлер (2009). А Теxтбоок оф Ботанy фор Цоллегес анд Университиес. БиблиоБазаар. стр. 375. ИСБН 978-1-113-90995-4.
- Матон, Антхеа; Хопкинс, Јеан; МцЛаугхлин, Цхарлес Wиллиам; Јохнсон, Сусан; Wарнер, Марyанна Qуон; ЛаХарт, Давид; Wригхт, Јилл D. (1993). Хуман Биологy анд Хеалтх. Енглеwоод Цлиффс, Неw Јерсеy, УСА: Прентице Халл. стр. 52-59. ИСБН 978-0-13-981176-0.
- Соломон, Елдра Пеарл; Берг, Линда Р.; Мартин, Диана W. (2004). Биологy. Ценгаге Леарнинг. стр. 52. ИСБН 978-0534278281 — преко гоогле.боокс.цом.
- „Цомполитион оф фоодс раw, процессед, препаред” (ПДФ). www.арс.усда.гив. 2015. Приступљено 30. 10. 2016.
- Алфароук КО, Вердузцо D, Рауцх C, Муддатхир АК, Адил ХХ, Елхассан ГО, et al. (18. 12. 2014). „Глyцолyсис, тумор метаболисм, цанцер гроwтх анд диссеминатион. А неw пХ-басед етиопатхогениц перспецтиве анд тхерапеутиц аппроацх то ан олд цанцер qуестион”. Онцосциенце. 1 (12): 777—802. ПМЦ 4303887
 . ПМИД 25621294. дои:10.18632/онцосциенце.109.
. ПМИД 25621294. дои:10.18632/онцосциенце.109. - Романо АХ, Цонwаy Т (1996). „Еволутион оф царбохyдрате метаболиц патхwаyс”. Ресеарцх ин Мицробиологy. 147 (6–7): 448—455. ПМИД 9084754. дои:10.1016/0923-2508(96)83998-2.
- Келлер МА, Турцхyн АВ, Ралсер M (април 2014). „Нон-ензyматиц глyцолyсис анд пентосе пхоспхате патхwаy-лике реацтионс ин а плаусибле Арцхеан оцеан”. Молецулар Сyстемс Биологy. 10 (4): 725. ПМЦ 4023395
 . ПМИД 24771084. дои:10.1002/мсб.20145228.
. ПМИД 24771084. дои:10.1002/мсб.20145228. - Осхима, Кинтаро; Толленс, Б. (мај 1901). „Уебер Спецтрал‐Реацтионен дес Метхyлфурфуролс”. Берицхте дер Деутсцхен Цхемисцхен Геселлсцхафт (на језику: енглески). 34 (2): 1425—1426. ИССН 0365-9496. дои:10.1002/цбер.19010340212.
- Сеагер, Спенцер L.; Слабаугх, Мицхаел Р.; Хансен, Марен С. (2016-12-05). Сафетy Сцале Лабораторy Еxпериментс (на језику: енглески). Ценгаге Леарнинг. стр. 358. ИСБН 9781337517140.
- Павиа, Доналд L. (2005). Интродуцтион то Органиц Лабораторy Тецхниqуес: А Смалл Сцале Аппроацх (на језику: енглески). Ценгаге Леарнинг. стр. 447. ИСБН 0534408338.