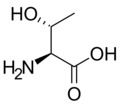
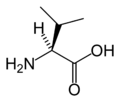
Aminokiselina
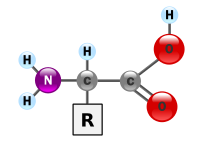
Aminokiseline su jedinjenja koja sadrže amino grupu (-NH2) i karboksilnu grupu (-COOH).[1] U sastav aminokiselina ulaze sledeći elementi: C, H, N i O. Aminokiseline izgrađuju proteine i učestvuju u metaboličkim procesima. Aminokiseline čine 20% svih organskih molekula koji izgrađuju ćelije, tkiva i organe. U prirodi postoji više od petsto aminokiselina, ali se proteini svih vrsta, od bakterija do ljudi, prvenstveno sastoje od samo njih dvadeset.[2] Odrastao čovek može sintetisati sve izuzev devet aminokiselina. Ovih devet se zovu esencijalne aminokiseline, zbog toga što se moraju unositi hranom. Enormna struktura i funkcionalna složenost proteina proizilazi iz različitih kombinacija ovih aminokiselina koje se vezuju u polimere i asocijate sa različitim neproteinskim supstancama.[3][4][5]
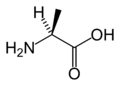
Sve aminokiseline koje grade proteine su α-aminokiseline pošto su amino i karboksilne grupe vezane za isti, α-atom ugljenika. Pored amino i karboksilne grupe, strukturu aminokiselina određuje i bočni lanac koji se naziva i ostatak i obeležava se sa R. R-grupe sadrže karakteristične osobine pojedinih aminokiselina, i mogu ih činiti alifatični ili aromatični bočni lanci koji mogu sadržati druge reaktivne grupe, mogu biti više ili manje polarne, hidrofilne ili hidrofobne itd.
Struktura i svojstva aminokiselina[uredi | uredi izvor]
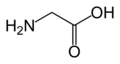
Amino i karboksilna grupa u molekulu aminokiselina vezane su za isti atom, α-atom ugljenika, prema tome to su α-aminokiseline i mogu se prikazati sledećom opštom formulom. R grupa predstavlja bočni niz, a to mogu biti alkil ili polarne grupe. Poseban slučaj je aminoetanska kiselina (glicin, CH2-COOH) čiji bočni lanac je vodonik.
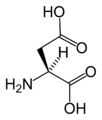
Kod svih aminokiselina koje ulaze u sastav proteina, sem jedne (glicin), alfa ugljenikov atom je asimetričan (hiralan) te se stoga mogu naći u obliku dva enantiomera. Sve aminokiseline koje sintetiše humani organizam imaju relativnu L-konfiguraciju. Postoje aminokiseline koje imaju dva hiralna centra (izoleucin i treonin), što znači da imaju po dva para enantiomera.
Aminokiseline koje su poznate odavno, uglavnom imaju trivijalna imena koja su dobile prema biljnim ili životinjskim tkivima u kojima su prvobitno pronađeni (glutamin prema pšeničnom brašnu glutenu, tirozin prema grčkoj reči za sir itd.). Aminokiseline imaju hemijske nazive koji se formiraju kao derivati kiselina u kojima je supstitucija izvršena sa tačnom oznakom položaja bočnog lanca i supstituenta.
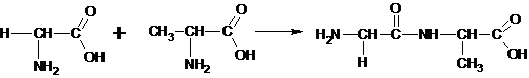
Najvažnija hemijska reakcija aminokiselina je formiranje peptidne veze koja omogućava povezivanje dve aminokiseline i stvaranje lanca aminokiselina (peptida i proteina). Peptidna veza je veza između karboksilne grupe jedne aminokiseline i amino grupe druge aminokiseline, u kojoj se atom ugljenika karboksilne grupe vezuje za atom azota uz oslobađanje molekula vode. U formiranju molekula vode učestvuju -OH iz karboksilne grupe i vodonik iz amino grupe.
Podela[uredi | uredi izvor]
Razlikuju se dve grupe aminokiselina: jedna grupa su one čija je funkcija da izgrađuju proteine i učestvuju u metaboličkim procesima - proteinogene, a druga grupa su one koje učestvuju samo u metaboličkim procesima - neproteinogene.
Prema prirodi R-grupe, aminokiseline koje grade proteine se mogu klasifikovati u sedam grupa:
- Aminokiseline sa nepolarnim (hidrofobnim) bočnim nizom: alanin, valin, leucin, izoleucin, glicin i prolin;
- Aminokiseline sa aromatičnim bočnim nizom: fenilalanin, tirozin i triptofan;
- Aminokiseline sa baznim bočnim nizom: lizin, arginin i histidin;
- Aminokiseline sa kiselinskim ostatkom u bočnom nizu: asparaginska kiselina i glutaminska kiselina;
- Aminokiseline sa amidnim ostatkom u bočnom nizu: asparagin i glutamin;
- Aminokiseline sa hidroksilnom grupom u bočnom nizu: serin i treonin;
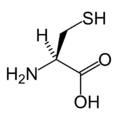
- Aminokiseline sa sumporom u bočnom nizu: metionin i cistein
"Standardne" aminokiseline i njihova svojstva[uredi | uredi izvor]
| Aminokisela | Tri slova[6] | Jedno slovo[6] | Polarnost bočnog lanca[6] | pH bočnog lanca (pH 7,4)[6] | Hidropatski indeks[7] | Apsorbancija λmax(nm)[8] | ε pri λmax (mM−1 cm−1)[8] | MW (Molekulska masa)[9] |
|---|---|---|---|---|---|---|---|---|
| Alanin | Ala | A | Nepolarno | Neutralno | 1.8 | 89 | ||
| Arginin | Arg | R | Bazno polarno | Pozitivan | −4.5 | 174 | ||
| Asparagin | Asn | N | Polarno | Neutralno | −3.5 | 132 | ||
| Asparaginska kiselina | Asp | D | Kiselo polarno | Negativno | −3.5 | 133 | ||
| Cistein | Cys | C | Nepolarno | Neutralno | 2.5 | 250 | 0.3 | 121 |
| Glutaminska kiselina | Glu | E | Kiselo polarno | Negativno | −3.5 | 147 | ||
| Glutamin | Gln | Q | Polarno | Neutralno | −3.5 | 146 | ||
| Glicin | Gly | G | Nepolarno | Neutralno | −0.4 | 75 | ||
| Histidin | His | H | Bazno polarno | Pozitivno (10%)
Neutralno (90%) |
−3.2 | 211 | 5.9 | 155 |
| Izoleucin | Ile | I | Nepolarno | Neutralno | 4.5 | 131 | ||
| Leucin | Leu | L | Nepolarno | Neutralno | 3.8 | 131 | ||
| Lizin | Lys | K | Bazno polarno | Pozitivno | −3.9 | 146 | ||
| Metionin | Met | M | Nepolarno | Neutralno | 1.9 | 149 | ||
| Fenilalanin | Phe | F | Nepolarno | Neutralno | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165 |
| Prolin | Pro | P | Nepolarno | Neutralno | −1.6 | 115 | ||
| Serin | Ser | S | Polarno | Neutralno | −0.8 | 105 | ||
| Treonin | Thr | T | Polarno | Neutralno | −0.7 | 119 | ||
| Triptofan | Trp | W | Nepolarno | Neutralno | −0.9 | 280, 219 | 5.6, 47.0 | 204 |
| Tirozin | Tyr | Y | Polarno | Neutralno | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181 |
| Valin | Val | V | Nepolarno | Neutralno | 4.2 | 117 |
Dve dodatne aminokiseline kod nekih vrsta su kodirane kodonima koji se obično interpretiraju kao stop kodoni:
| 21. i 22. aminokiselina | Tri slova | Jedno slovo |
|---|---|---|
| Selenocistein | Sec | U |
| Pirolizin | Pyl | O |
Pored specifičnih kodova za aminokiseline, držači njihovih mesta koriste se u slučajevima u kojima se proteini sekvenciraju hemijski ili za kristalografske analize peptida ili proteina ne može konačno determinisati identitet ostataka.
| Dvosmislena aminokiselina | Tri slova | Jedno slovo |
|---|---|---|
| Asparagin ili aspartinska kiselina | Asx | B |
| Glutamin ili glutaminska kiselina | Glx | Z |
| Leucin ili Izoleucin | Xle | J |
| Nespecifična ili nepoznata aminokiselina | Xaa | X |
Unk je ponekad umesto Xaa, ali je manje standardno. Osim toga, mnoge nestandardne aminokiseline imaju specifični kod. Na primjer, nekoliko peptidnih droga (lijekova), kao što su Bortezomib i MG132, su umjetno sintetizirani i zadržavali svoje zaštićujuće grupe koje imaju specifične kodova. Bortezomib je Pyz - Phe-boroLeu, a MG132 je karboksibenzil Z-Leu-Leu-Leu-al. Za pomoć u analizi strukture proteina, raspoložive su foto-reaktivne analogne aminokiseline. To uključuje fotoleucin (pLeu) i fotometionin (pMet).[10]
Najvažnija hemijska reakcija aminokiselina je formiranje peptidne veze koja omogućava povezivanje dve aminokiseline i stvaranje lanca aminokiselina (peptidi i proteini). Peptidna veza je veza između karboksilne grupe jedne aminokiseline i amino grupe druge aminokiseline, u kojoj se atom ugljenika vezuje za atom azota uz oslobađanje molekula vode.
U sastav čovekovog organizma ulazi ukupno 20 aminokiselina. 10 od njih mogu da se izgrade u samom organizmu, dok je preostalih 10 neophodno uneti kroz ishranu. Aminokiseline koje čovekov organizam nije u stanju da napravi, a neophodne su za njegovo funkcionisanje se nazivaju esencijalnim aminokiselinama.
Strukturne formule "standardnih" aminokiselina[uredi | uredi izvor]
-
L-alanin (Ala / A)
-
L-arginin (Arg / R)
-
L-asparagin (Asn / N)
-
L-asparaginska kiselina (Asp / D)
-
L-cistein (Cys / C)
-
L-glutaminska kiselina (Glu / E)
-
L-glutamin (Gln / Q)
-
L-glicin (Gly / G)
-
L-histidin (His / H)
-
L-izoleucin (Ile / I)
-
L-leucin (Leu / L)
-
L-lizin (Lys / K)
-
L-metionin (Met / M)
-
L-fenilalanin (Phe / F)
-
L-prolin (Pro / P)
-
L-serin (Ser / S)
-
L-treonin (Thr / T)
-
L-triptofan (Trp / W)
-
L-tirozin (Tyr / Y)
-
L-valin (Val / V)
Sinteza aminokiselina[uredi | uredi izvor]
Biosinteza aminokiselina[uredi | uredi izvor]
Normalna ishrana obezbeđuje većinu aminokiselina potrebnih za biosintezu proteina i za produkciju azotnih jedinjenja male molekulske mase. Održavanje neophodne rezerve aminokiselina u našem organizmu omogućeno je unosom hrane, razgradnjom telesnih proteina i biosintezom neesencijalnih aminokiselina. Upravo biosinteza neesencijalnih aminokiselina najviše varira u organizmu i ključna je u regulaciji ravnoteže. Procesi biosinteze aminokiselina međusobno se razlikuju tako da postoji dvadeset različitih anabiotičkih procesa. U našim ćelijama prisutni su svi potrebni enzimi za sintezu otprilike polovine aminokiselina, koje čine grupu neesencijalnih aminokiselina. Esencijalne aminokiseline se moraju unositi hranom jer naš organizam ne sadrži potrebne enzime za njihovu sintezu.
Većina aminokiselina se mogu sintetisati u dovoljnim količinama od nekog uobičajenog intermedijera metabolizma ili od esencijalnih aminokiselina. Sinteza aminokiselina se odvija obično od odgovarajuće keto kiseline reakcijom transaminacije i generalno glutamat je donor amino - grupe. Procesi biosinteze neesencijalnih aminokiselina su jednostavni i uključuju mali broj enzima, uglavnom jedan. Za razliku od ovih procesa, biosinteza esencijalnih aminokiselina je znatno komplikovanija i uključuje veliki broj enzima.
Hemijska sinteza aminokiselina[uredi | uredi izvor]
- Hel-Volhard-Zelinskijeva reakcija
Ovo je reakcija bromovanja karboksilne kiseline na α-ugljenikovom atomu. Dalje, brom se u proizvodu može zameniti nukleofilom kao što je amonijak.
- Štrekerova sinteza
Ova reakcija se izvodi u prisustvu amonijaka i cijanhidrina. Polazni reagens u ovoj sintezi je određeni aldehid, u zavisnosti koju aminokiselinu želimo dobiti. Na intermedijerni imin se adira cijanhidrin i dobijaju se određeni α-aminonitrili. Daljom kiselom ili baznom hidrolizom se dobijaju α-aminokiseline.
Reakcije aminokiselina[uredi | uredi izvor]
Reakcija nastajanja peptida[uredi | uredi izvor]
Aminokiseline sadrže slobodnu amino i karboksilnu grupu i zbog toga imaju sposobnost da daju sve reakcije karakteristične za ove dve grupe. Kod nekih aminokiselina reaguju i karakteristične funkcionalne grupe u bočnom nizu.
Slobodna karboksilna grupa učestvuje i organskim reakcijama koje daju amide, estre ili anhidride. od svih su najznačajnije reakcije nastajanja amida, nesupstituisani (sa amonijakom) ili supstituisani amidi (sa drugim aminima) koji se nazivaju peptidi.
Reakcija aminokiselina sa hloridima organskih kiselina[uredi | uredi izvor]
Amino grupa u aminokiselinama koja je slobodna i može da reaguje sa hloridima kiselina, odnosno, može se acilovatii, pri čemu gubi svoje bazne osobine. Važna reakcija α-amino grupe je reakcija sa ugljen-dioksidom pri čemu nastaju karbamino kiseline koje kod čoveka predstavljaju jedan od načina prenosa ugljen-dioksida iz tkiva u pluća.
Degradacija aminokiselina[uredi | uredi izvor]
Ključni proces u degradaciji aminokiselina je transaminacija u kojoj α-aminokiselina reaguje sa α-ketokiselinom pri čemu keto i amino grupa menjaju mesta. Primer za to je Krebsov ciklus u kome se pojavljuje α-ketoglutarna kiselina. Ova kiselina u reakciji sa amonijakom daje glutaminsku kiselinu. Dobijena glutaminska kiselina u reakciji sa drugim α-ketokiselinama kao proizvod daje određenu α-ketokiselinu i određenu aminokiselinu. U organizmu veliki broj aminokiselina nastaje na ovaj način.
Aminokiseline kao transmiteri[uredi | uredi izvor]
Važno mesto među neurotransmiterima u centralnom nervnom sistemu zauzimaju aminokiseline i to:
L-glutamat je glavni ekscitatorni transmiter koji je prisutan u svim delovima centralnog nervnog sistema. Šezdesetih godina 20. veka smatralo se da GABA i ekcitatorne aminokiseline (EAA) nisu ništa drugo nego farmakološki kurioziteti. Tokom sedamdesetih ustanovljeno je da je najprostija aminokiselina glicin inhibitorni transmiter u kičmenoj moždini, što je postavilo osnove za ideju da transmiteri moraju da budu neobični molekuli, čija je najbitnija uloga da se vežu za receptore. Najveći napredak učinjen je otkrićem EAA antagonista, koji je omogućio da fiziološka uloga glutamata bude nedvosmisleno potvrđena što je doprinelo i spoznaji heterogene prirode EAA receptora.
Metabolizam i oslobađanje aminokiselina[uredi | uredi izvor]
Glutamat je široko i ravnomerno raspoređen u CNS-u gde je njegova koncentracija mnogo viša nego u drugim tkivima. On ima važnu metaboličku ulogu, pri čemu su metabolički i depoi transmitera povezani preko enzima transaminaza koji katalizuju interkonverziju glutamata i α-ketoglutarata. Glutamat u CNS-u potiče uglavnom iz glukoze, preko ciklusa trikarboksilnih kiselina (Krebsov ciklus), ili iz glutamina, koga sintetišu ćelije glije, a preuzimaju neuroni. Međusobna povezanost puteva sinteze EAA i inhibitornih aminokiselina (GABA i glicina), otežava korišćenje transmitera u eksperimentalnim procedurama s ciljem istraživanja funkcionalnih uloga pojedinih aminokiselina, jer bi poremećaji na bilo kom od koraka u njihovoj sintezi uticali na ekcitatorne i inhibitorne medijatore.
Kao i kod ostalih neurotransmitera, depoi glutamata nalaze se u sinaptičkim vezikulama iz kojih se oslobađa pomoću kalcijum-zavisne egzocitoze specifični transporterski proteini omogućavaju njihovo preuzimanje u neurone i druge ćelije, kao i njihovo nakupljanje u sinaptičkim vezikulama. Dejstvo glutamata uglavnom se prekida ponovnim preuzimanjem u nervne završetke i susedne astrocite preko nosača. Ovaj transport može, pod izvesnim okolnostima funkcionisati i u suprotnom pravcu i tako postati izvor oslobađanja glutamata. Glutamat koji preuzmu astrociti pretvara se u glutamin i vraća se preko nosača nazad u neurone, gde opet dolazi do konverzije glutamina u glutamat.
Reference[uredi | uredi izvor]
- ^ Mišić, Milan, ur. (2005). Enciklopedija Britanika. A-B. Beograd: Narodna knjiga : Politika. str. 43. ISBN 86-331-2075-5.
- ^ Introducing Amino Acids. chemguide.co.uk
- ^ „Amino acids”. Peptides from A to Z: A Concise Encyclopedia. John Wiley & Sons. 2008. str. 20. ISBN 978-3-527-62117-0.
- ^ Pollegioni, Loredano; Servi, Stefano, ur. (2012). Unnatural Amino Acids. Humana Press. str. v. ISBN 978-1-61779-331-8.
- ^ Hertweck 2011, str. 9540–9541.
- ^ a b v g Hausman & Cooper 2004
- ^ Kyte J, Doolittle RF (maj 1982). „A simple method for displaying the hydropathic character of a protein”. Journal of Molecular Biology. 157 (1): 105—32. PMID 7108955. doi:10.1016/0022-2836(82)90515-0.
- ^ a b Freifelder, D. (1983). Physical Biochemistry (2nd izd.). W. H. Freeman and Company. ISBN 978-0-7167-1315-9.
- ^ „Arhivirana kopija”. Arhivirano iz originala 30. 5. 2016. g. Pristupljeno 25. 12. 2018.
- ^ Suchanek M, Radzikowska A, Thiele C (1. 4. 2005). „Foto-leucin i foto-metionina omogućavaju identifikaciju interakcija protein-protein u živim ćelijama”. Nature Methods. 2 (4): 261—7. PMID 15782218. doi:10.1038/nmeth752.
Literatura[uredi | uredi izvor]
- Mišić, Milan, ur. (2005). Enciklopedija Britanika. A-B. Beograd: Narodna knjiga : Politika. str. 43. ISBN 86-331-2075-5.
- Hausman RE, Cooper GM (2004). The cell: a molecular approach. Washington, D.C: ASM Press. str. 51. ISBN 978-0-87893-214-6.
- Pollegioni, Loredano; Servi, Stefano, ur. (2012). Unnatural Amino Acids. Humana Press. str. v. ISBN 978-1-61779-331-8.
- Doolittle, Russell F. (1989). „Redundancies in protein sequences”. Ur.: Fasman, G. D. Predictions of Protein Structure and the Principles of Protein Conformation. New York
- Tymoczko, John L. (2012). „Protein Composition and Structure”. Biochemistry. New York: W. H. Freeman and company. str. 28-31. ISBN 978-1-4292-2936-4.: Plenum Press. str. 599-623. ISBN 978-0-306-43131-9. LCCN 89008555. line feed character u
|location=na poziciji 9 (pomoć) - Guyton, AC; Hall, JE (2005). Textbook of Medical Physiology. Elsevier Science - IE.
- Meierhenrich, Uwe (2008). Amino acids and the asymmetry of life (PDF). Berlin: Springer Verlag. ISBN 978-3-540-76885-2. LCCN 2008930865. Arhivirano iz originala 12. 01. 2012. g. Pristupljeno 20. 06. 2017.
- Morelli, Robert J. (1952). Studies of amino acid absorption from the small intestine. San Francisco.
- Nelson, David L.; Cox, Michael M. (2000). Lehninger Principles of Biochemistry (3rd izd.). Worth Publishers. ISBN 978-1-57259-153-0. LCCN 99049137.
- K. Peter C., Vollhardt; Schore, Neil (1997). Organska hemija. Beograd.
Članci[uredi | uredi izvor]
- Hertweck, Christian (2011). „Biosynthesis and Charging of Pyrrolysine, the 22nd Genetically Encoded Amino Acid”. Angew. Chem. Int. Ed. 50: 9540—9541. doi:10.1002/anie.201103769.