С Википедије, слободне енциклопедије
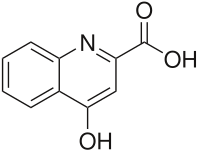
Kinurenska kiselina (transtorin, KYNA ) je proizvod normalnog metabolizma aminokiseline L-triptofan . Za kinurensku kiselinu je bilo pokazano da poseduje neuro-aktivna svojstva. Ona deluje kao antiepileptik , najverovatnije putem delovanja kao antagonist na pobuđivačkim aminokiselinskim receptorima. Ona može da utiče na važne neurofiziološke i neuropatološke procese. Kao rezultat toga, kinurenska kiselina je bila razmatrana za primjenu u terapiji određenih neurobioloških poremećaja. U kontrastu s tim, povišeni nivoi kinurenske kiseline su bili su povezani sa pojedinim patološkim stanjima.
Kinurensku kiselinu je otkrio nemački hemičar Justus fon Libig 1853 . u urinu pasa.[4]
Ona se formira iz L-kinurenina reakcijom koja je katalizovana enzimom kinurenin—oksoglutarat transaminaza .
Za transtorin je utvrđeno da deluje na tri receptora :
^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG” . Yeast . 17 (1): 48—55. doi :10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H . ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.” . Drug Discov Today . 15 (23-24): 1052—7. PMID 20970519 . doi :10.1016/j.drudis.2010.10.003 . уреди ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry . 4 : 217—241. doi :10.1016/S1574-1400(08)00012-1 . ^ Liebig, J., Uber Kynurensäure, Justus Liebigs Ann. Chem. , 86: 125-126, 1853.
^ Grilli M, Raiteri L, Patti L, Parodi M, Robino F, Raiteri M, Marchi M (2006). „Modulation of the function of presynaptic alpha7 and non-alpha7 nicotinic receptors by the tryptophan metabolites, 5-hydroxyindole and kynurenate in mouse brain” . Br. J. Pharmacol . 149 (6): 724—32. PMC 2014664 PMID 17016503 . doi :10.1038/sj.bjp.0706914 . ^ Wang J, Simonavicius N, Wu X, Swaminath G, Reagan J, Tian H, Ling L (2006). „Kynurenic acid as a ligand for orphan G protein-coupled receptor GPR35”. J. Biol. Chem . 281 (31): 22021—8. PMID 16754668 . doi :10.1074/jbc.M603503200 .
Jonotropni
AMPA NMDA Agonisti: Konkurentni agonisti :
Aspartat •
Glutamat •
Homohinolinska kiselina •
Ibotenska kiselina •
NMDA •
Hinolinska kiselina •
Tetrazolilglicin ;
Agonisti glicinskog mesta: ACBD •
ACPC •
ACPD •
Alanin •
CCG •
Cikloserin •
DHPG •
Fluoroalanin •
Glicin •
HA-966 •
L-687,414 •
Milacemid •
Sarkozin •
Serin •
Tetrazolilglicin ;
Agonisti poliaminskog mesta: Akamprosat •
Spermidin •
Spermin Antagonisti :Konkurentni antagonisti: AP5 (APV) •
AP7 •
CGP-37849 •
CGP-39551 •
CGP-39653 •
CGP-40116 •
CGS-19755 •
CPP •
LY-233,053 •
LY-235,959 •
LY-274,614 •
MDL-100,453 •
Midafotel (d-CPPen) •
NPC-12,626 •
NPC-17,742 •
PBPD •
PEAQX •
Perzinfotel •
PPDA •
SDZ-220581 •
Selfotel ;
Nekonkurentni antagonisti: ARR-15,896 •
Karoverin •
Deksanabinol •
FPL-12495 •
FR-115,427 •
Hodgkinsin •
Magnezijum •
MDL-27,266 •
NPS-1506 •
Psihotridin •
Cink ;
Nekonkurentni blokatori pora: 2-MDP •
3-MeO-PCP •
8A-PDHQ •
Amantadin •
Aptiganel •
ARL-12,495 •
ARL-15,896-AR •
ARL-16,247 •
Budipin •
Delucemin •
Deksoksadrol •
Dekstralorfan •
Dieticiklidin •
Dizocilpin •
Endopsihozin •
Esketamin •
Etoksadrol •
Eticiklidin •
Gaciklidin •
Ibogain •
Indantadol •
Ketamin •
Ketobemidon •
Loperamid •
Memantin •
Meperidin (Petidin) •
Metadon •
Metorfan (
Dekstrometorfan ,
Levometorfan ) •
Metoksetamin •
Milnacipran •
Morfanol (
Dekstrorfan ,
Levorfanol ) •
NEFA •
Nerameksan •
Azotsuboksid •
Noribogain •
Orfenadrin •
PCPr •
Fenciklamin •
Fenciklidin •
Propoksifen •
Remacemid •
Rinhofilin •
Riluzol •
Rimantadin •
Roliciklidin •
Sabeluzol •
Tenociklidin •
Tiletamin •
Tramadol •
Ksenon ;
Antagonisti glicinskog mesta: ACEA-1021 •
ACEA-1328 •
Karisoprodol •
CGP-39653 •
CKA •
DCKA •
Felbamat •
Gavestinel •
GV-196,771 •
Kinurenska kiselina •
L-689,560 •
L-701,324 •
Lakosamid •
Likostinel •
LU-73,068 •
MDL-105,519 •
Meprobamat •
MRZ 2/576 •
PNQX •
ZD-9379 ;
Antagonisti NR2B podjedinice: Bezonprodil •
CO-101,244 (PD-174,494) •
CP-101,606 •
Eliprodil •
Haloperidol •
Ifenprodil •
Izoksuprin •
Nilidrin •
Ro8-4304 •
Ro25-6981 •
Traksoprodil ;
Neklasifikovani/nesortirani antagonisti: Hloroform •
Dietil etar •
Enfluran •
Etanol (Alkohol) •
Halotan •
Izofluran •
Metoksifluran •
Toluen •
Trihloroetan •
Trihloroetanol •
Trihloroetilen •
Ksilen Kainat
Metabotropni
Inhibitori transporta
mAChR
Agonisti :77-LH-28-1 AC-42 AC-260,584 Aceklidin Acetilholin AF30 AF150(S) AF267B AFDX-384 Alvamelin AQRA-741 Arekolin Betanehol Butirilholin Karbahol CDD-0034 CDD-0078 CDD-0097 CDD-0098 CDD-0102 Cevimelin cis-Dioksolan Etoksisebacilholin LY-593,039 L-689,660 LY-2,033,298 McNA343 Metaholin Milamelin Muskarin NGX-267 Okvimelin Oksotremorin PD-151,832 Pilokarpin RS86 Sabkomelin SDZ 210-086 Sebacilholin Suberilholin Talsaklidin Tazomelin Tiopilokarpin Vedaklidin VU-0029767 VU-0090157 VU-0152099 VU-0152100 VU-0238429 WAY-132,983 Ksanomelin YM-796 Antagonisti : 3-Hinuklidinil Benzilat 4-DAMP Aklidinijum bromid Anisodamin Anisodin Atropin Atropin metonitrat Benaktizin Benzatropin (Benztropin)Benzidamin BIBN 99 Biperiden Bornaprin CAR-226,086 CAR-301,060 CAR-302,196 CAR-302,282 CAR-302,368 CAR-302,537 CAR-302,668 CS-27349 Ciklobenzaprin Ciklopentolat Darifenacin DAU-5884 Dimetinden Deksetimid DIBD Diciklomin (Dicikloverin)Ditran EA-3167 EA-3443 EA-3580 EA-3834 Etanautin Etibenzatropin (Etulbenztropin)Flavoksat Himbacin HL-031,120 Ipratropijum bromid J-104,129 Hiosciamin Mamba Toksin 3 Mamba Toksin 7 Mazatikol Mebeverin Metoktramin Metiksen N -etil-3-piperidil benzilatN -metil-3-piperidil benzilatOrfenadrin Otenzepad Oskibutinin PBID PD-102,807 PD-0298029 Fenglutarimid Feniltoloksamin Pirenzepin Piroheptin Prociklidin Profenamin RU-47,213 SCH-57,790 SCH-72,788 SCH-217,443 Skopolamin (Hioscin)Solifenacin Telenzepin Tiotropijum bromid Tolterodin Triheksifenidil Tripitamin Tropatepin Tropikamid WIN-2299 Ksanomelin Zamifenacin ; Drugi : Prva generacija antihistamina (Bromfeniramin Hlorfenamin Ciproheptadin Dimenhidrinat Difenhidramin Doksilamin Mepiramin /pirilamin Fenindamin Feniramin Tripelenamin Triprolidin , itd.)Triciklični antidepresanti (Amitriptilin Doksepin Trimipramin , itd.)Tetraciklični antidepresanti (Amoksapin Maprotilin , itd.)Tipični antipsihotici (Hlorpromazin Tioridazin , itd.)Atipični antipsihotici (Klozapin Olanzapin Kvetiapin , itd.) nAChR
Agonisti : 5-HIAA A-84,543 A-366,833 A-582,941 A-867,744 ABT-202 ABT-418 ABT-560 ABT-894 Acetilholin Altiniklin Anabasin Anatoksina AR-R17779 Butirilholin Karbahol Kotinin Citizin Dekametonijum Desformilflustrabromin Dianiklin Dimetilfenilpiperazinijum Epibatidin Epiboksidin Etanol Etoksisebacilholin EVP-4473 EVP-6124 Galantamin GTS-21 Isproniklin Lobelin MEM-63,908 (RG-3487)Nikotin NS-1738 PHA-543,613 PHA-709,829 PNU-120,596 PNU-282,987 Pozaniklin Rivaniklin Sazetidin A Sebacilholin SIB-1508Y SIB-1553A SSR-180,711 Suberilholin TC-1698 TC-1734 TC-1827 TC-2216 TC-5214 TC-5619 TC-6683 Tebaniklin Tropisetron UB-165 Vareniklin WAY-317,538 XY-4083 Antagonisti : 18-Metoksikoronaridin α-Bungarotoksin α-Konotoksin Alkuronijum Amantadin Anatruksonijum Atrakurijum Bupropion (Amfebutamon)Handonijum Hlorizondamin Cisatrakurijum Koklaurin Koronaridin Dakuronijum Dekametonijum Dekstrometorfan Dekstropropoksifen Dekstrorfan Diadonijum DHβE Dimetiltubokurarin (Metokurin)Dipirandijum Dizocilpin (MK-801)Doksakurijum Duador Esketamin Fazadinijum Galamin Heksafluronijum Heksametonijum (Benzoheksonijum)Ibogain Izofluran Ketamin Kinurenska kiselina Laudeksijum (Laudolizin)Levacetilmetadol Malouetin Mekamilamin Memantin Metadon Metorfan (Racemetorfan)Metilikakonitin Metokurin Mivakurijum Morfanol (Racemorfanol)Nerameksan Azot-monoksid Pankuronijum Pempidin Pentamin Pentolinijum Fenciklidin Pipekuronijum Radafaksin Rapakuronijum Rokuronijum Surugatoksin Suksametonijum (Sukcinilholin)Tiokolhikozid Toksiferin Trimetafan Tropeinijum Tubokurarin Vekuronijum Ksenon
 . PMID 17016503. doi:10.1038/sj.bjp.0706914.
. PMID 17016503. doi:10.1038/sj.bjp.0706914.
