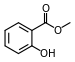
Естар

Естри (нем. Essig-Äther, што је стари назив за етил-етаноат) органска су једињења која у својим молекулима садрже остатак молекула киселине и остатак молекула алкохола.[1] Естри дају мирис воћу, поврћу и четинарима. Њихова општа формула је: CnH2n+1-COO-CnH2n+1. Естри добијају називе у зависности од тога који је алкохол и која киселина изреаговала. Ако је рецимо, реаговао етанол и етанска киселина, добија се естар који се назива етил-етаноат или етил-ацетат. Тај назив је изведен од етил-групе алкохола и назива соли етанске киселине. Соли етанске киселине се називају етаноати или ацетати.
- CH3-COOH + CH3-CH2-OH → CH3-COO-CH2-CH3 + H2O
Естри се добијају у реакцији естерификације. Та се реакција одвија у киселој средини. Супротна реакција естерификацији је хидролиза. У тој реакцији се добијена вода из естерификације једини са естром који је добијен и даје полазне супстанце: алкохол и киселину.
- CH3-COO-CH2-CH3 + H2O → CH3-COOH + CH3-CH2-OH
Користе се у прехрамбеној индустрији за производњу вештачких мириса, као растварачи боја, лакова и као сировина за добијање вештачких влакана. Један од најпознатијих естара је нитроглицерин, који се добија реакцијом тровалентног алкохола глицерола и азотне киселине, уз присуство сумпорне киселине.[2][3][4]
Структура и везивање[уреди | уреди извор]
Естри садрже карбонилни центар, који има структурне мотиве C-C-O и O-C-O са угловима између веза од 120°. За разлику од амида, естри су структурно флексибилне функционалне групе јер ротација око C-O-C веза има ниску баријеру. Њихова флексибилност и ниска поларност се манифестује у њиховим физичким особинама. Они су мање ригидни (имају нижу тачку топљења) и испарљивији су (нижа тачка кључања) од одговарајућих амида.[5] pKa вредности алфа-водоника естера је око 25.[6]
Именовање[уреди | уреди извор]
Именовање естера се базира на називу алкохола који је ступио у реакцију тј. прво иде назив алкилне скупине алкохола (нпр. назив алкилне скупине пропанола је пропил). Другим ријечима, умјесто уобичајеног завршетка -анол на основу имена алкохола дода се наставак -ил. Друга ријеч у називу естера потиче од киселине, а твори се тако да се имену киселине одузме наставак -ска и дода наставак -оат (нпр., друга ријеч у имену естера бутанске киселине била би бутаноат). Код естера са етанском киселином, често се умјесто етаноата употребљава: ацетат, код оних са метанском киселином: формијат, код естера са бутанском киселином: бутират, а код пропанске киселине: пропионат. Код алкохола такођер постоје други називи па се тако умјесто пентил, често нађе и амил: алкохол (-ол → -ил) + карбоксилне киселине (-ска → -оат)
ИУПАЦ-ова номенклатура[уреди | уреди извор]
Естерска имена изведена су из назива матичног алкохола и родитељске киселине, где ова може бити органска или неорганска. Естри изведени из најједноставнијих карбоксилних киселина се обично зове према традицијским, такозваним тривијалним називима, нпр. као формат, ацетат, пропионат, и бутират, за разлику од ИУПАЦ-ове номенклатуре: метаноат, етаноат, пропаноат и бутаноат. Естри изведени из комплекснијих карбоксилних киселина су, с друге стране, чешће под називом који користи систематски назив по ИУПАЦ-у, на основу имена за киселину затим долази суфикс –оат. На пример, естер-хексилоктаноат, познат и под тривијалним именом хексил-каприлат, има формулу CH3(CH2)6CO2(CH2)5CH3.
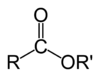
Хемијске формуле органских естера обично имају облик RCO2R', где су R и R' делови угљиководика из карбоксилне киселине и алкохола. На пример, бутил ацетат (систематски бутил-етаноат), изведен из бутанола и ацетатне киселине (систематски етанска киселина) се пише као CH3CO2C4H9. Алтернативно приказивање обично укључује BuOAc и CH3COOC4H9. Циклични естри се зову лактони, без обзира на то да ли су изведени из органске или неорганске киселине. Један пример (органског) лактона је γ-валеролактон.
Ортоестри[уреди | уреди извор]
Неуобичајена класа органских естера су ортоестери, који имају формулу RC(OR′)3. Триетилортоформат (HC(OC2H5)3) је изведеница, у смислу имена (али не и синтезе) из ортомравље киселине (HC(OH)3) и етанола.
Неоргански естри[уреди | уреди извор]

Естери могу такође да буду изведени из неорганских киселина и алкохола. Дакле, номенклатура се протеже на неорганске оксокиселине и њихове одговарајуће естре: фосфорна киселина и фосфатни естер/органофосфати, сумпорна киселина и сулфатни естер/органосулфати, азотна киселина и нитрат, борна киселина и борати. На пример, трифенил фосфат је естер изведен из фосфорне киселине и фенола. Органски карбонати су изведени из угљене киселине; на пример, етилен карбонат је изведен из угљене киселине и етилен гликола.



Алкохол и неорганска киселина повезивани су преко атома кисеоника. Дефиниција естера неорганске киселине који имају везу неорганских хемијских елемената између алкохола и неорганске киселине – везање атома фосфор и три алкокси функционалне групе у органофосфатима – може се проширити на исте елементе у разним комбинацијама ковалентне везе између угљеникових и централног неорганског атома и вези угљеник-кисеоник, са централним неоргански атомима. На пример, фосфорна својства три везе угљеник-кисеоник-фосфор и једну двоструку везу фосфор-кисеоник у органофосфатима, три везе угљеник–кисеоник–фосфор и ниједну двоструку везу фосфор–кисеоник у фосфитни естерима или органофосфитима, две везе угљеник–кисеоник–фосфор, ниједна фосфор–кисеоник двострука веза, али једна веза фосфор–угљеник у фосфонитима, једна веза угљеник–кисеоник–фосфор, ниједна двострука веза фосфор–кисеоник, али две везе фосфор–угљеник у фосфонитима.

Као последица, функције бора је стварање борних естара (n = 2), боронских естара (n = 1) и бората (n = 0). Кисеоник је хемијски елемент групе 16, а атоми сумпора могу заменити неке атоме кисеоника у угљеник–кисеоник централном неорганском атому ковалентних веза естера. Као резултат, стварају се тиосулфинати и тиосулфонати, са централнин неорганским атомом сумпора, јасно показујући асортиман сумпорних естера, који укључују и сулфатне, сулфитне, сулфонатне, сулфинатне и сулфенатне естере.
Триацилглицерол[уреди | уреди извор]

Триацилглицероли (масти и уља) су естри који садрже три хидроксилне групе. Именују се слично као и соли. Нерастворни су или слабо растворни у води (липиди).
Естри се могу добити реакцијом, обично органских, киселина и алкохола, уз каталитско присуство сумпорне киселине, иако има и других начина добијања естера. Естерификација је реверзибилна реакција у којој се истовремено догађа и хидролиза, па је потребно хигроскопно средство које реакцији одузима воду.
- Алкохоли + карбоксилне киселине ↔ естер + вода (естерификација)
- Естер + вода ↔ алкохоли + карбоксилне киселине (хидролиза)
Многи естри имају специфичан мирис, због чега се често користе као вештачке ароме и у производњи мириса. На пример:
- метил бутаноат – ананас, јабука;
- метил бензоат – воћни мирис јиланг-јиланг;
- етил формијат – рум;
- етил бутаноат – ананас, јагода;
- етил хептаноат – грожђе;
- етил ацетат - старо вино;
- амил ацетат - банана, крушка.
Метил формијат[уреди | уреди извор]
Метил метаноат је безбојна течност карактеристичног етерског мириса, лако испарива, са малим површинским напоном.
- C2H4O2O=COC
Етил ацетат / етил етаноат[уреди | уреди извор]
Ово је безбојна, лако запаљива течност карактеристичног мириса, попут лепка или средстава за скидање лака за нокте (C4H8O2, CC(=O)OCC или CH3COOCH2CH3). Етил ацетат је запаљив и кожни иритант.
Добијање естера[уреди | уреди извор]
Естери се добијају при синтези сирћетне киселине и етанола, уз присуство јаких киселина као што је сумпорна киселина.
- CH3CH2OH + CH3COOH → CH3COOCH2CH3 + H2O
Добијају се:
- естерификацијом метанола и етаноата: HCOOH + CH3OH → HCOOCH3 + H2O
- индустријски комбинацијом метанола и угљен моноксида: CH3OH + CO → HCOOCH3.
Употреба[уреди | уреди извор]
Естри се између остало користе:
- као отров за убијање инсеката (за препарирање у ентомологији: инсект се убије, али се не уништи)
- у лепковима и одстрањивачима лака за нокте
- као реагенс за одређивање ангиотензин конвертирајућег ензима (АЦЕ)
Естри се обично употребљавају у прехрамбеној и кондиторској индустрији, производњи растварача и пластичних маса, и производњу парфема. Употребљава се и као инсектицид и у производњи неких лекова.
Естерски мириси[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- ^ Хунтер Г. К. (2000): Витал Форцес. Тхе дисцоверy оф тхе молецулар басис оф лифе. . London: Academic Press. 2000. ISBN 978-0-12-361811-5.
- ^ Нелсон D. L., Цоx M. M. (2013): Лехнингер Принциплес оф Биоцхемистрy. . W. H. Freeman and Co. ISBN 978-1-4641-0962-1.
- ^ Халл Ј. Е., Гуyтон А. C. (2006): Теxтбоок оф медицал пхyсиологy, 11тх едитион. Елсевиер Саундерс, Ст. Лоуис, Мо. ISBN 978-0-7216-0240-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Chemistry of Enols and Enolates - Acidity of alpha-hydrogens