Масна киселина
| Типови масти у храни |
|---|
|
| Види још |
Масне киселине су једињења која улазе у састав масти и уља. У хемији, посебно биохемији, масна киселина је карбоксилна киселина, углавном са дугим неразгранатим низом (ланцем). Најчешће је реч о ланцима са парним бројем угљеникових атома, од 4 до 30, највише 36 C-атома. Разлог парном броју јесте што њихова биосинтеза укључује ацетил коензим А, који даје допринос од два атома угљеника.[1][2]
Масне киселине могу бити засићене или незасићене, у зависности да ли поседују двоструку везу. Појам засићене масне киселине говори да, осим у карбоксилној групи, где је карбонилни угљеник везан за кисеоник, нема двоструких веза. Од незасићених, у мастима се могу наћи оне које садрже двоструке и троструке везе, као и истовремено присуство и двоструких и троструких веза. Масне киселине животињског порекла уколико су незасићене, садрже до 6 двоструких веза. С друге стране, у структури биљака поред засићених и незасићених (са једном или више двоструких веза), пронађене су и киселине са троструком везом, али и епокси-, хидрокси- и кето-групама, као и са циклопентановим прстеном.
Масне киселине се индустријски производе путем хидролизе естерских веза масти или биолошких уља (који су заправо триглицериди), уклањањем алкохола глицерола.
Масне киселине спадају у групу уљних хемикалија.
Физичка својства[уреди | уреди извор]
Масне киселине су углавном моно-карбонске киселине, које имају између 4 и 36 угљеникових атома, обично су правог низа и парног броја C атома.
Масне киселине се састоје из хидрофобног дела – дугачког угљеничног низа, и из хидрофилног дела – поларне карбоксилне групе. Карбоксилна група показује велику склоност ка димеризацији захваљујући присуству ОХ-групе и ЦО-групе, због чега се смањује и онако мала растворљивост у води.
Физичка својства масних киселина зависе од дужине ланца, степену незасићености и разгранатости ланца.[1] Углавном су слабо растворне у води, а добро растворне у неполарним органским растварачима, попут бензена. Објашњење за то јесте да када се угљоводонични низ нађе у поларном растварачу, може изувијати дајући мање или више компактан молекул, стабилизован интрамолекулским хидрофобним контактима. За разлику од тога, у неполарном растварачу може доћи до интермолекулских хидрофобних интеракција при чему се молекули мање или више издужени. У табели 1 дати су примери неколико виших масних киселина са, између осталог, њиховом растворљивошћу у различитим растварачима.
Са повећањем дужине низа, смањује се растворљивост масних киселина, тако да се само сирћетна и бутерна киселина мешају са водом у неограниченом односу, док осталим киселинама растворљивост нагло опада. Најбољи растварач за масне киселине је диетил-етар.
| Структура | Тачка топљења (℃) | Вода | Бензен |
|---|---|---|---|
| 44,2 | 0,0630 | 2600 | |
| 53,9 | 0,0240 | 874 | |
| 63,1 | 0,0083 | 348 | |
| 69,6 | 0,0034 | 124 |
Из табеларног приказа види се да тачка топљења масних киселина линеарно расте са повећањем броја угљеникових атома. Та чињеница је доказ да у стабилизацији молекула учествују и привлачне силе угљоводоничних низова масних киселина. Засићене масне киселина са непарним бројем угљеникових атома и разгранатим низом имају нешто ниже температуре топљења од одговарајућих киселина са нормалним низом, што указује на добро паковање бочних метил-група у кристалну решетку. Незасићене масне киселине имају ниже тачке топљења, уз правило да су температуре још ниже уколико има већи број двоструких веза или уколико су оне ближе центру угљоводоничног низа.
Номенклатура[уреди | уреди извор]
ИУПАЦ номенклатура масних киселина се наводи према стандардној Женевској систематизацији, изводећи из имена угљоводоника који има исти број угљеникових атома. Према томе, имену угљоводоника (које је изведено из грчких бројева) са истим бројем C-атома додаје се суфикс -ска и реч киселина.
На пример, пентанска киселина (Ц5) има пет угљеникових атома, то је нижа масна киселина, а изводи се из угљоводоника пентана. Међутим, ова киселина има тривијално име валеријанска јер се у природи налази у биљци валеријани.
Број двоструких веза у масној киселини означава се модификовањем префикса. Тако се олеинска киселина са једном двоструком везом зове октадеценска киселина; линолна киселина са две двоструке везе октадекандиенска киселина итд. Положај двоструке везе означава се бројем првог угљениковог атома те везе, почињући нумерисање угљениковихатома од карбоксилне групе, при чему је угљеников атом карбоксилне групе Ц1.
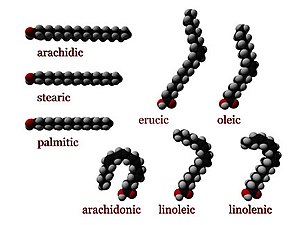
Скраћена ознака масних киселина се представља у виду записа нпр. 12:0, што представља број угљеникових атома и број двоструких веза. Уколико, пак у структури постоји двострука веза, неопходно је назначити на ком угљениковом атому се она и налази. Пример палмитолеинске киселине (цис-9-хексадеценоинска киселина) 16:1(∆9). Ипак, веома су заступљени горепоменути тривијални називи, који углавном потичу од деривата. Тако имамо, примера ради, палмитинску киселину, будући да се налази у дрвећу палми, стеаринску киселину (грч. stear, у преводу тврда маст)...
Врсте масних киселина[уреди | уреди извор]
Засићене масне киселине[уреди | уреди извор]
Засићене масне киселине не садрже двоструке ковалентне везе или друге функционалне групе у молекуларном ланцу. Сам појам "засићен" се односи на водоник који је у максималном могућем броју везан на угљеникове атоме у ланцу (осим код карбоксилне групе -COOH). Другим ријечима, зато што је угљеник 4-валентан, на сваком атому угљеника вежу се друга два атома угљеника и по два атома водоника, осим на другом крају ланца масне киселине (CH3-).
Засићене масне киселине формирају равне ланце атома, и као резултат тога могу се згуснуто складиштити у организму, што повећава количину енергије по јединици запремине. Масно ткиво човека и животиња садржи велике количине дуголанчаних засићених масних киселина.
Скраћени описни назив масних киселина садржи само број атома угљеника и број двоструких веза у њима (нпр. C18:0 или 18:0 - стеаринска киселина садржи 18 атома угљеника и 0 двоструких веза између атома угљеника, док Ц18:1 - олеинска киселина садржи осим 18 атома угљеника и једну двоструку везу, те је она незасићена масна киселина).
| Име | Хемијска структура | C:D |
|---|---|---|
| Лауринска киселина (додекадска) | CH3(CH2)10COOH | 12:0 |
| Миристинска киселина (тетрадекадска) | CH3(CH2)12COOH | 14:0 |
| Палмитинска киселина (хексадекадска) | CH3(CH2)14COOH | 16:0 |
| Стеаринска киселина (октадекадска) | CH3(CH2)16COOH | 18:0 |
| Арахидска киселина (еикозаноидна) | CH3(CH2)18COOH | 20:0 |
| Бехенијска киселина (докозаноидна) | CH3(CH2)20COOH | 22:0 |
| Лигноцеринска киселина | CH3(CH2)22COOH | 24:0 |
| Керотинска киселина | CH3(CH2)24COOH | 26:0 |
Незасићене масне киселине[уреди | уреди извор]

Незасићене масне киселине су киселине сличног облика, осим што постоји једна или више алкенских функционалних група унутар ланца где сваки алкен замењује једноструку угљеникову везу "-CH2-CH2-" у делу ланца са двоструком везом "-CH=CH-".
Такве двоструке везе могу бити формиране у цис или транс конфигурацији.
- цис
- Цис конфигурација има два атома водоника на истој страни двоструке везе. Крутост двоструке везе замрзава њихову конформацију, а "цис" форма изомера узрокује да се ланац пресавија. То ограничава конформациону слободу масне киселине. Што је више двоструких веза у цис облику, то је мања ланац савитљив. Када ланац има много цис веза, постаје изразито закривљен у свим могућим конформерима. На пример олеинска киселина, која има једну двоструку везу има мањи прегиб у ланцу од линолне киселине с две двоструке везе. Линоленска киселина, која има три двоструке везе, посве је завинута у облику куке. Учинак свега овога је да у ограниченом окружењу, као када су масне киселине део фосфолипида у липидном двослоју, или триглицерида у капљици липида, "цис" веза ограничава способност масне киселине да се ускладишти у мањем простору, те на тај начин утиче на тачку топљења мембране или масноће.
- транс
- Транс конфигурација, супротно од горе описане, има два сусједна атома водоника везана на супротним странама двоструке везе. Резултат тога је да не обликује ланац који је савијен, те је облик сличан равном ланцу као што је у засићеним масним киселинама.
У природи се незасићене масне киселине појављују само у "цис" форми. "Транс" облик искључиво настаје утицајем човека и његове намере да прерађује масноће (нпр. хидрогенизацијом).
Ове разлике у геометрији између "цис" и "транс" облика незасићених масних киселина, те између засићених и незасићених масних киселина играју врло значајну улогу у биолошким процесима (нпр. у људском тијелу) и у изградњи биолошких структура (у изградњи ћелијске мембране).
Док код засићених масних киселина не постоје двоструке везе, положај двоструке везе код незасићених масних киселина је битан за њихова својства. Због тога говоримо о почетку и крају ланца тих киселина. Почетак је место где се налази карбоксилна група -COOH, док је крај место на ланцу где се налазе везана три атома водоника на атому угљеника (CH3-). Крај се назива омега (ω), те према месту прве двоструке везе од тог краја говоримо о омега-3, омега-6 или о омега-9 масним киселинама.
| Тривијално име | Хемијска структура | Δx | C:D | н−x |
|---|---|---|---|---|
| Миристолеинска киселина | CH3(CH2)3CH=CH(CH2)7COOH | цис-Δ9 | 14:1 | н−5 |
| Палмитолеинска киселина | CH3(CH2)5CH=CH(CH2)7COOH | цис-Δ9 | 16:1 | н−7 |
| Сапиенска киселина | CH3(CH2)8CH=CH(CH2)4COOH | цис-Δ6 | 16:1 | н−10 |
| Олеинска киселина | CH3(CH2)7CH=CH(CH2)7COOH | цис-Δ9 | 18:1 | н−9 |
| Линолна киселина | CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH | цис,цис-Δ9,Δ12 | 18:2 | н−6 |
| α-Линолеинска киселина | CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH | цис,цис,цис-Δ9,Δ12,Δ15 | 18:3 | н−3 |
| Арахидонска киселина | CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH[3] | цис,цис,цис,цис-Δ5Δ8,Δ11,Δ14 | 20:4 | н−6 |
| Еикозапентаеноинска киселина | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH | цис,цис,цис,цис,цис-Δ5,Δ8,Δ11,Δ14,Δ17 | 20:5 | н−3 |
| Ерукинска киселина | CH3(CH2)7CH=CH(CH2)11COOH | цис-Δ13 | 22:1 | н−9 |
| Докозахексаеноинска киселина | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)2COOH | цис,цис,цис,цис,цис,цис-Δ4,Δ7,Δ10,Δ13,Δ16,Δ19 | 22:6 | н−3 |
Дакле, линоленска, еикозапентаеноинска и докозахексаеноинска киселина су омега-3 масне киселине; линолна и арахидонска су омега-6; а олеинска и ерукинска киселина су омега-9 масне киселине.
Разлика између засићених и незасићених киселина гледајући исти број атома угљеника, је у двоструким везама, те складно томе у мањем броју атома водоника за два (нпр. стеаринска C18H36O2 за разлику од олеинске C18H34O2).
Есенцијалне масне киселине[уреди | уреди извор]
Људско тело може синтетисати све масне киселине које му требају за раст и живот осим две, а то су линолна и линоленска киселина. Зато их називамо есенцијалним јер су врло важне за наш организам и морамо их уносити путем хране. Оне су широко распрострањене у биљној и животињској храни (у уљном облику). У нашем организму оне помажу правилном раду ћелија и органа, а од њих се стварају једињења слична хормонима који управљају широким спектром животних функција, као што су крвни притисак, згрушавање крви, ниво липида у крви (масноћа), имунолошко стање, те упални одговор на претњу инфекције.
Есенцијалне масне киселине су вишеструко незасићене масне киселине и од њих се у организму стварају низови омега-6 и омега-3 масних киселина. Људски организам може једноставно произвести засићене масне киселине или једноструко незасићене масне киселине с двоструком везом на деветом атому угљеника бројећи од краја ланца (омега-9 киселине), али не може створити двоструку везу на шестом или трећем атому угљеника због непостојања ензима који би то омогућио.
Есенцијалне масне киселине регулишу крвни притисак и ојачавају имунски систем јер се помоћу њих стварају једињења као што су простагландини. У мозгу се налазе повећане количина деривата линолне и линоленске киселине. Неравнотежа или помањкање омега-3 киселина у односу на количину омега-6 (данас се претпоставља да је исправан однос тих двију киселина 1 : 2) је кривац за многе болести као што су: депресија и поремећаји понашања (укључујући насиље), дијабетес 2. типа (старачка шећерна болест), артритис и рак.
Трансмасне киселине[уреди | уреди извор]
Трансмасне киселине су незасићене масне киселине које садрже транс двоструку везу између атома угљеника која чини ланац молекуле мање закривљеним у односу на масне киселине са цис двоструком везом. Такве 'транс' структуре настају индустријском прерадом, поступком који се назива хидрогенизација биљних уља.
Истраживања показују да трансмасне киселине у недостатку есенцијалних масних киселина заузму њихово место у виталним процесима и узрокују циркулацијске болести као што су артериосклероза и болест срчаног мишића.
Слободне масне киселине[уреди | уреди извор]
Масне киселине могу бити повезане или придружене другим молекулима као што су триглицериди или фосфолипиди. Ако нису повезане, називамо их слободним масним киселинама. Слободне масне киселине настају разлагањем триглицерида на почетне компоненте, масне киселине и глицерол.
Слободне масне киселине су важан извор енергије за многа ткива, јер могу доставити релативно велике количине АТП-а. Гориво за ћелије може бити глукоза или масне киселине. Већи број типова ћелија дају предност масним киселинама (ћелије срца, мишића). С друге стране, мозак не може користити киселине већ користи глукозу или кетонска тела (кетонска тела се стварају у јетри путем метаболизма масних киселина за време гладовања или за време ниског уноса угљених хидрата).
Масне киселине у прехрамбеним масноћама[уреди | уреди извор]
Следећа таблица приказује удео масних киселина и холестерола у свакодневним прехрамбеним масноћама.[4][5]
| засићене | једноструко незасићене | вишеструко незасићене | холестерол | Витамин Е | |
|---|---|---|---|---|---|
| g/100g | g/100g | g/100g | mg/100g | mg/100g | |
| Масноће животињског порекла | |||||
| Свињска маст | 40.8 | 43.8 | 9.6 | 93 | 0.00 |
| Маслац | 54.0 | 19.8 | 2.6 | 230 | 2.00 |
| Биљне масноће | |||||
| Уље кокоса | 85.2 | 6.6 | 1.7 | 0 | .66 |
| Палмино уље | 45.3 | 41.6 | 8.3 | 0 | 33.12 |
| Уље памучног семења | 25.5 | 21.3 | 48.1 | 0 | 42.77 |
| Уље пшеничних клица | 18.8 | 15.9 | 60.7 | 0 | 136.65 |
| Сојино уље | 14.5 | 23.2 | 56.5 | 0 | 16.29 |
| Маслиново уље | 14.0 | 69.7 | 11.2 | 0 | 5.10 |
| Кукурузно уље | 12.7 | 24.7 | 57.8 | 0 | 17.24 |
| Уље сунцокрета | 11.9 | 20.2 | 63.0 | 0 | 49.0 |
| Шафраново уље | 10.2 | 12.6 | 72.1 | 0 | 40.68 |
| Репичино уље | 5.3 | 64.3 | 24.8 | 0 | 22.21 |
Рачвасте и цикличне масне киселине[уреди | уреди извор]
Што се тиче других природних масних киселина, постоје и масне киселине које су рачвасте структуре. Пример такве је засићена туберкулостеаринска (10-метилоктадеканска) киселина, виша масна киселине, за коју је карактеристично то што је производе бактерије актиномицете, а сам назив је добила када је први пут изолована 1927. године из бацила туберкулозе (лат. Mycobacterium tuberculosis).
Тариринска или 6-октадецинска киселина је природна масна киселина која садржи троструку везу. То је не тако редак пример, али јављају се готово искључиво само код биљака.
Масне киселине поред хидроксилне групе у оквиру карбоксилне групе могу да садрже ОХ-групу и на неком другом угљениковом атому и онда се називају хидрокси киселине. Пример је рицинолна киселина, 12-хидрокси, цис-9-октадеценска. Рицинолна киселина чини 80-90% количинског удела рицинусовог уља, а као и друге хидрокси-киселине, оптички је активна, па је и само уље оптички активно и веома вискозно. Рицинусово уље се користи у медицини за лечење и као помоћно средство код многих обољења, најпознатије је његово пургативно дејство, али се још више користи у козметологији, за разноразне препарате за раст косе, ноктију, браде, у производњи крема за лице, лосиона за тело и слично.
Цикличне масне киселине нису честа појава код природних производа. Ипак, чаулмугрова (Хyдноцарпус wигхтианус) је пример (ИУПАЦ назив 13-∆2,3-циклопетенил-н-тридеканска киселина), чије уље се користи у индијској и кинеској медицини као лек против лепре, а касније и неких других кожних обољења.
Киселост[уреди | уреди извор]
Кратколанчане карбоксилне киселине као што су мравља и сирћетна киселина се могу мешати са водом и дисоцирати се, тако да су умерено јаке киселине(pKa 3.77 и 4.76, респективно). Али како се комплексност киселине повећава, а ланац молекуле киселине продужава, тако се убрзано смањује растворљивост киселина.
Оне масне киселине које нису растворне у води, растворне су у топлом етанолу и могу се титрисати или неутралисати раствором натријум или калцијум хидроксида, уз фенолфталеин као индикатор. Промјена боје индикатора указује на тачку неутрализације слободних масних киселина. Ова анализа се употребљава у одређивању удела слободних масних киселина у масноћи, тј. удела хидролизованих триглицерида, и обично се изражава као "укупна киселост" у mgKOH/g.
Реакције масних киселина[уреди | уреди извор]
Масне киселине реагују као и све друге карбоксилне киселине, нпр. учествују у реакцијама естерификације и кисело-базним реакцијама. Редукцијом масних киселина добивају се масни алкохоли.
Незасићене масне киселине могу бити изложене хидрогенизацији, како би се биљна уља претворила у маргарине (и на тај начин продужио век трајања прехрамбених намирница). Делимичном хидрогенизацијом, незасићене масне киселине прелазе из цис стања у транс облик.
Оксидација и ужеглост[уреди | уреди извор]
Масне киселине се већ на собној температури мењају путем оксидације. Молекул масне киселине се дели на угљоводонике, кетоне, алдехиде, те у мањој мјери на епоксиде и алкохоле. Тешки метали и у малим количинама убрзавају оксидацију (чиме показују ступањ загађења). Масноће и уља се због тога често третирају с хелатима као што је лимунска киселина.
Референце[уреди | уреди извор]
- ^ а б Fatty Acid and Lipid Chemistry. Berlin: Springer Verlag. 1996. ISBN 0-8342-1342-7.
- ^ Chow, Ching Kuang (2008). Fatty acids in foods and their health implications. Boca Raton: CRC Press. ISBN 0-8493-7261-5.
- ^ „Arachidonic acid”.
- ^ Food Standards Agency (1991). „Fats and Oils”. McCance & Widdowson's The Composition of Foods. Royal Society of Chemistry.
- ^ Ted Altar. „More Than You Wanted To Know About Fats/Oils”. Sundance Natural Foods Online. Pristupljeno 31. 8. 2006.
Literatura[уреди | уреди извор]
- Хемија природних органских једињења, Слободан Д. Петровић, Душан Ж. Мијин, Надежда Д. Стојановић; Технолошко-металуршки факултет, Београд, 2009.
- Индустријски производи уља и масти по Бејлију (наслов оригинала Bailey’s Industrial Oil and Fat Products), Данијел Сверн; Накладни завод Знање, Загреб, 1972.
- Хемија природних производа, др Бојана Грујић-Ињац, др Стеван Лајшић; ГРО “Просвета”, Ниш, 1983.
- Употреба молекула - хемијски есеји о молекулима и њиховим применама, Живорад Чековић; Завод за уџбенике, 2012.
- Природно лечење болести и тегоба (наслов оригинала Curing Everyday Ailments the Natural Way) mr sci med dr Милена Комарчевић, Маријана Грошељ, Бранка Маричић; Reader’s Digest; Младинска књига Београд, 2005.
- Fatty Acid and Lipid Chemistry. Berlin: Springer Verlag. 1996. ISBN 0-8342-1342-7.
- Цхоw, Цхинг Куанг (2008). Фаттy ацидс ин фоодс анд тхеир хеалтх имплицатионс. Боца Ратон: ЦРЦ Пресс. ISBN 0-8493-7261-5.
- Фоод Стандардс Агенцy (1991). „Фатс анд Оилс”. МцЦанце & Wиддоwсон'с Тхе Цомпоситион оф Фоодс. Роyал Социетy оф Цхемистрy.




