Кухињска со

| |
 Натријум хлорид као минерал халит
| |
 Кристална структура са натријумом у пурпурној и хлором у зеленој боји
| |
| Називи | |
|---|---|
| IUPAC назив
Натријум хлорид
| |
Други називи
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| Бајлштајн | 3534976 |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.726 |
| EC број | 231-598-3 |
| Гмелин Референца | 13673 |
| KEGG[1] | |
| MeSH | Sodium+chloride |
| RTECS | VZ4725000 |
| UNII | |
| |
| |
| Својства | |
| NaCl | |
| Моларна маса | 58,443 g/mol[4] |
| Агрегатно стање | Безбојни кубни крисали[4] |
| Мирис | Безукусна |
| Густина | 2,17 g/cm3[4] |
| Тачка топљења | 800,7 °C (1.473,3 °F; 1.073,8 K)[4] |
| Тачка кључања | 1.465 °C (2.669 °F; 1.738 K)[4] |
| 360 g/L[4] | |
| Растворљивост у амонијак | 21,5 g/L |
| Растворљивост у метанол | 14,9 g/L |
| Магнетна сусцептибилност | −30,2·10−6 cm3/mol[5] |
| Индекс рефракције (nD) | 1,5441 (на 589 nm)[6] |
| Структура[7] | |
| Кристална решетка/структура | чеоно центрирана кубна (погледајте текст), cF8 |
| Кристалографска група | Fm3m, No. 225 |
a = 564.02 pm
| |
| Геометрија молекула | Октаедарска (Na+) октаедарска (Cl−) |
| Термохемија[8] | |
| Специфични топлотни капацитет, C | 50,5 J/(K·mol) |
Стандардна моларна
ентропија (S |
72,10 J/(K·mol) |
Стандардна енталпија
стварања (ΔfH |
−411,120 kJ/mol |
| Фармакологија | |
| A12CA01 (WHO) B05CB01, B05XA03, S01XA03 | |
| Опасности | |
| NFPA 704 | |
| Смртоносна доза или концентрација (LD, LC): | |
LD50 (средња доза)
|
3 g/kg (орално, пацови)[9] |
| Сродна једињења | |
Други анјони
|
Натријум флуорид натријум бромид натријум јодид натријум астид |
Други катјони
|
литијум хлорид калијум хлорид рубидијум хлорид цезијум хлорид францијум хлорид |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Кухињска со,[10] хемијски натријум-хлорид (молекулска формула NaCl) је једно од најраспрострањенијих хемијских једињења у природи. Натријум хлорид је бела кристална супстанца, веома добро растворљива у води, ипак са малом максималном концентрацијом. Натријум хлорид спада у ред најзначајнијих једињења у хемијској индустрији и извор је сланости морске воде. Молекул натријум хлорида се састоји од једног атома натријума и једног атома хлора. Молекулска маса кухињске соли је 58.4 u. Температура топљења натријум хлорида износи 801 °C, а температура кључања 1465 °C.
Човек често користи кухињску со у својој исхрани као зачин или као средство које утиче на квалитет и брзину припремања хране. Натријум хлорид је со која је најодговорнија за сланост морске воде и ванћелијске течности многих вишећелијских организама. У свом јестивом облику кухињске соли уобичајено се користи као конзерванс и зачин за храну. Велике количине натријум хлорида користе се у многим индустријским процесима, а он је главни извор једињења натријума и хлора, која се користе као сировине за даље хемијске синтезе. Друга велика примена натријум хлорида је за одлеђивање путева при нискотемпературним временским приликама.
Биолошки значај NaCl
[уреди | уреди извор]Кухињска со је главни извор јона Na+ и Cl- за људе и животиње. Јони Na+ имају кључну улогу у многим физиолошким процесима од одржања сталног крвног притиска до одржања делатности нервног система. Зато је уношење кухињске соли неопходно за живот.
Дневне потребе за њом износе око 50 mg али у данашњим условима уноси неколико пута више. Оптимална количина од 50 mg соли налази се у једној векни обичног белог хлеба.
Претпоставља се да прекомерна употреба соли може да изазове појаву неких обољења.
Својства и распрострањеност
[уреди | уреди извор]

Со је доступна у облику прозирних кристала добро растворних у води, релативне молекулске масе 58,4 u. Привлачне силе међу јонима у кристалној решетки су јаке, те због јаке јонске везе између јона натријума и хлора, тачка топљења је релативно висока 801 °C, а тачка кључања је 1465 °C.
У природи је со врло распрострањена и најраширеније је једињење натријума, а њен најважнији извор је вероватно морска вода у којој је њен масени удео око 2,8 - 3%. У Земљиној кори налази се у наслагама као камена со, халит, а у мањим количинама је има у сваком тлу.
Чист натријум хлорид је безбојни јонски кристал сланог укуса. Он кристализира у кубичном систему. Градивне јединице кристалне структуре су натријумови и хлоридни јони. Кристал је састављен од равно центрираних структура натријумових и хлоридних јона међусобно помакнутих за половину дужине брида елементарне ћелије. Координациони број натријумовог и хлоридног јона је шест. За такав је координациони број најчешћи октаедарски просторни распоред јона. Кухињска со се кристализује у безбојне коцке, и понекад у октаедре.
Снижење тачке смрзавања зависи од удела растворене материје у раствору; w(NaCl) 10% раствор има тачку топљења од -7,4 °C, а 20%-ни раствор NaCl -14,5 °C. При нижим температура (-10 °C) из водених раствора излучује се у облику дихидрата (NaClx2H2O) који при 0,15 °C прелази у безводну со. Натријум хлорид (употребљаван као кухињска со), је често влажан због присуства магнезијум хлорида (MgCl) или магнезијум сулфата (MgSO4), који су хигроскопни. Чист натријум хлорид није хигроскопан. Он се добро раствара у поларним растварачима као што су: вода, метанол, етанол и течни амонијак; а апсолутна вредност енталпије растварања је јако мала. При растварању се разграђује кристална решетка.
У 100g воде при 50 °C може се растворити 39g NaCl. Једна литра морске воде садржи 10,5 g натријумових хона и 19,0g хлорних јона. Енталпија растварања натријум хлорида је врло мала (4 kJ mol−1), што показује да се растворљивост NaCl неће битно променити повишењем температуре, за разлику од неких других соли. То је разлог што је масени удео натријум хлорида у мору релативно сталан, око 2,8% без обзира на климатске услове;
- NaCl(s) --> (H2O) Na+(aq) + Cl-(aq)
Иако је водени раствор натријум хлорида неутралан, он због активирајућег деловања хлоридних јона делује корозивно (посебно ако садржи кисеоник из ваздуха).
У литри морске воде има 10,6g натријумових и 0,38g калијумових јона. Будући да је масени удео натријума и калијума у Земљиној кори готово једнак, велика се разлика њихових концентрација у морској води може се протумачити тиме што биљке из вода које продиру у тло вежу претежно калијумове јоне.
Со је неопходна у људској и животињској прехрани. У живом је организму важан однос концентрације (Na+) унутар и изван ћелије (Na-K пумпа). Ако се равнотежа тих јона поремети, долази до поремећаја рада срца, метаболизма угљених хидрата, те подражљивости и контракције мишића. Натријум хлорид је потребан и неким биљкама које расту на обалама мора (халофите).
Производња
[уреди | уреди извор]Натријум хлорид се може синтетисати по реакцији:
- 2 Na + 2 HCl → 2 NaCl + H2
Алтернативно, може се излучити из природних извора као што су море, слана језера, дубинске наслаге слане воде, или се копа као минерал. Кухињска со се добија из морске воде (велике количине се налазе растворене у мору (просечно је w(NaCl) = 2,7%), и из великих дебелих наслага као камена со, као остатак праисторијских мора која су се исушила у прошлим геолошким периодима.
Из природних се налазишта добија копањем и вађењем из рудника камене соли, црпљењем, концентрисањем и упаравањем слане воде из подземних наслага и упаравањем морске воде у плитким базенима.
Из природних налазишта натријум хлорид се добија на три начина:
- Рударским копањем добивају се блокови соли који се растварају за индустријске потребе, или се дробе и мељу за прехрану. Таква камена со обично је врло чиста и садржи само трагове магнезијума.
- Наслаге камене соли растварају се у води до засићења. Слана вода се црпи и упарава. Со кристализује у облику врло ситних кристала (варена сол). На тај начин добија се со у Тузли у Босни и Херцеговини. Ова со је поприлично чиста, али ипак садржи више нечистоћа (посебно магнезијума) од камене соли.
- Упаравањем морске воде (Нин, Паг, Стон). Како је морска вода богата натријум хлоридом, со се добива и упаравањем (у топлим крајевима) или смрзавањем (у хладним крајевима) морске воде у плитким базенима.
Морска со је најмање чиста и садржи прилично магнезијума (w(MgO) = 0,5 до 1,2%). Количина магнезијума у морској соли зависи од начина кристализације. Ако се кристализује из мање концентрованих раствора (26°Be ~ 1,219g cm−3), со садржи врло мало магнезијума. Осим тога је важно да ли се со скупља свакога дана (Пиран) или једном годишње (Улцињ). Код свакодневне бербе садржај магнезијумових једињења у натријум хлориду је максималан (w(MgO) = 1,5%). Таква со је горка и врло хигроскопна. Велике количине соли троше се за људску и сточну храну. За људску храну обично је потребно со претходно јодирати.
Употребе
[уреди | уреди извор]Поред познате домаће употребе соли, доминантније примене од око 250 мегатона годишње (према подацима из 2008) укључују хемикалије и средства за одлеђивање.[11]
Хемијска продукција
[уреди | уреди извор]Со се користи директно или индиректно у производњи многих хемикалија, што конзумира већину светске производње.[12]
Хлоралкална индустрија
[уреди | уреди извор]Со је полазна основа за хлоралкални процес, индустријски процес за производњу хлора и натријум хидроксида, према хемијској једначини
- 2 NaCl + 2 H2O → Cl2 + H2 + 2 NaOH
Ова електролиза се врши или у живиној ћелији, ћелији с дијафрагмом или мембранској ћелији. Свака од њих користи другачију методу за одвајање хлора од натријум хидроксида. Остале технологије су у развоју због велике потрошње енергије при електролизи, при чему мала побољшања ефикасности могу имати велике економске повраћаје. Неке примене хлора укључују ПВЦ, дезинфекциона средства и раствараче. Натријум хидроксид је сировина у индустрији папира, сапуна и алуминијума.
Стандард
[уреди | уреди извор]Натријум-хлорид има међународни стандард који је креирала организација ASTM. Стандард је именован ASTM E534-13 и обухвата стандардне поступке испитивања за хемијску анализу натријум хлорида. Наведене методе пружају поступке за анализу натријум хлорида како би се утврдило да ли је погодан за његову намеравану употребу и примену.
Омекшавање воде
[уреди | уреди извор]Тврда вода садржи јоне калцијума и магнезијума који ометају дејство сапуна и доприносе накупљању каменца или филма алкалних наслага минерала у домаћинству и индустријској опреми и цевима. Комерцијалне и стамбене јединице за омекшавање воде користе јоноизмењивачке смоле за уклањање штетних јона који узрокују тврдоћу. Ове смоле се стварају и регенеришу коришћењем натријум хлорида.[11][12]
Друмска со
[уреди | уреди извор]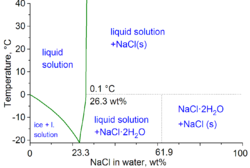
Друга велика примена соли је за уклањање леда и спречавање залеђивања путева, помоћу посуда за со, као користећи возила зимских служби. У ишчекивању сњежних падавина, путеви су оптимално припремају сланом водом (концентровани раствор соли у води), чиме се спречава везивање снежног леда за пут. Овај поступак спречава велику употребу соли након снежних падавина. За одлеђивање се користе смеше раствора соли и соли, каткад са додатним средствима као што су калцијум хлорид и/или магнезијум хлорид. Употреба соли или раствора соли постаје неефикасна испод −10 °C (14 °F).

Со за уклањање леда у Великој Британији углавном долази из једног рудника у Винсфорду у Чеширу. Пре дистрибуције она се меша са <100 ppm натријум фероцијанида као средства против згрудњавања, што омогућава каменој соли да слободно тече из носача за мрвљење упркос томе што је била складиштена пре употребе. Последњих година овај адитив се примењује и у кухињској соли. Остали адитиви су коришћени у друмској соли за смањење укупних трошкова. На пример, у САД нуспроизвод угљено хидратног раствора од прераде шећерне репе је мешан са каменом соли, јер је утврђено да приања за друмске површине око 40% боље од саме растресите камене соли. Пошто се дуже задржавао на путу, третман се није морао понављати неколико пута, штедећи време и новац.[12]
У техничком погледу физичке хемије, најмања тачка смрзавања смеше воде-соли је −21,12 °C (−6,02 °F) за 23,31 теж.% соли. Замрзавање у близини ове концентрације је међутим тако споро да се еутектичка тачка од −22,4 °C (−8,3 °F) може достићи са око 25 теж.% соли.[13]
Утицаји на животну средину
[уреди | уреди извор]Друмска со завршава у слатководним масама и може наштетити воденим биљкама и животињама нарушавајући њихову способност осморегулације.[14] Свеприсутност соли представља проблем код било које обалске покровне примене, јер заробљене соли узрокују велике проблеме у адхезији. Поморске власти и градитељи бродова прате концентрацију соли на површинама током изградње. Максималне концентрације соли на површинама зависе од органа власти и типа примене. IMO регулација се углавном користи и поставља ниво соли на максимално 50 mg/m2 растворљивих соли мерених као натријум хлорид. Ова мерења се врше Бресловим тестом. Салинизација (повећавање салинитета, или синдром салинизације свеже воде) и накнадно повећано испирање метала, трајни су проблем широм северноамеричких и европских слатководних рута.[15]
При одлеђивању аутопутева, со је била повезана са корозијом мостовских површина, моторних возила, арматурних шипки и жица, и незаштићених челичних конструкција које се користе у изградњи путева. Површинско отицање, прскање возила и деловање наноса ветра такође утичу на тло, вегетацију дуж путева и локалне површинске и подземне воде. Иако су пронађени докази о оптерећењу околине током вршне употребе соли, пролећне кише и одмрзавања обично разблажују концентрације натријума у подручју где је со примењена.[12] Једна студија из 2009. године утврдила је да се око 70% друмске соли која се примењује у метро подручју Минеаполис-Сент Пол задржава на локалном сливу.[16]
Замене
[уреди | уреди извор]Неке агенције уместо цестовне соли су покушале примену пивског отпада, меласе и сока од цвекле.[17] Авио-компаније користе више гликола и шећера, него раствора на бази соли за одлеђивање.[18]
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г д ђ Haynes, 4.89
- ^ Haynes, 4.135
- ^ Haynes, 10.241
- ^ Haynes, 4.148
- ^ Haynes, 5.8
- ^ Sodium chloride. nlm.nih.gov.
- ^ Wells, John C. (2008), Longman Pronunciation Dictionary (3rd изд.), Longman, стр. 143 and 755, ISBN 9781405881180
- ^ а б Westphal, Gisbert; Kristen, Gerhard; Wegener, Wilhelm; Ambatiello, Peter; Geyer, Helmut; Epron, Bernard; Bonal, Christian; Steinhauser, Georg; Götzfried, Franz (2010). „Sodium Chloride”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH Verlag. ISBN 978-3527306732. doi:10.1002/14356007.a24_317.pub4.
- ^ а б в г Kostick, Dennis S. (October 2010) "Salt" in U.S. Geological Survey, 2008 Minerals Yearbook
- ^ Elvers, B. et al. (ed.) (1991) Ullmann's Encyclopedia of Industrial Chemistry, 5th ed. Vol. A24, Wiley. ISBN 978-3-527-20124-2. стр. 319.
- ^ Rastogi, Nina (16 February 2010) Does road salt harm the environment? slate.com.
- ^ „Saltier waterways are creating dangerous 'chemical cocktails'”. phys.org.
- ^ „Most Road Salt Is Making It into Lakes And Rivers”. www.sciencedaily.com. University of Minnesota. 20. 2. 2009. Приступљено 27. 9. 2015.
- ^ „Turning to beet juice and beer to address road salt danger”. phys.org.
- ^ „EASA Cautions on Organic Salt Deicing Fluid”. MRO Network. 9. 12. 2016.
Литература
[уреди | уреди извор]- Haynes, William M., ур. (2011). CRC Handbook of Chemistry and Physics (92nd изд.). CRC Press. ISBN 978-1439855119.
- „Using Salt and Sand for Winter Road Maintenance”. Road Management Journal. децембар 1997. Архивирано из оригинала 21. 09. 2016. г. Приступљено 26. 12. 2019.
Спољашње везе
[уреди | уреди извор]- Salt United States Geological Survey Statistics and Information
- Calculators: surface tensions, and densities, molarities and molalities of aqueous NaCl (and other salts)
- JtBaker MSDS

