Atom
| Atom | |
|---|---|
 Ilustracija atoma helijuma. Prikazan je nukleus (ljubičasto) i distribucija elektronskog oblaka (crno). Nukleus (gore desno) u helijumu-4 je u realnosti sferno simetričan i blisko je sličan elektronskom oblaku, mada kod komplikovanijih nukleusa to nije slučaj. Crna linja predstavlja jedan angstrem (10−10 m ili 100 pm). | |
| Klasifikacija | |
| Najmanja podela hemijskog elementa | |
| Svojstva | |
| Maseni opseg | 1,67×10−27 to 4,52×10−25 kg |
| Električno naelektrisanje | zero (neutral), or ion charge |
| Opseg dijametra | 62 pm (He) do 520 pm (Cs) |
| Komponente | Elektroni i kompaktni nukleus protona i neutrona |
Atom je najmanja jedinica materije koja definiše hemijske elemente.[1] Materija u čvrstom, tečnom, gasovitom stanju, ili u obliku plazme se sastoji od neutralnih ili jonizovanih atoma. Atomi su veoma mali: veličina atoma se meri u pikometrima — bilionitim delovima (10−12) metra.[2] Svaki atom se sastoji od jezgra i jednog ili više elektrona koji kruže oko nukleusa. Nukleus se sastoji od jednog ili više protona i tipično sličnog broja neutrona (vodonik-1 nema neutrona). Protoni i neutroni se nazivaju nukleonima. Preko 99,94% atomske mase je u jezgru.[3] Protoni imaju pozitivno električno naelektrisanje, elektroni imaju negativno električno naelektrisanje, a neutroni nisu naelektrisani. Ako je broj protona i elektrona jednak, taj atom je električno neutralan. Ako atom ima višak ili manjak elektrona u odnosu na protone, onda on ima sveukupno pozitivno ili negativno naelektrisanje, i naziva se jon.
Elektrone atoma privlače protoni atomskog nukleusa posredstvom elektromagnetne sile. Protoni i neutroni u nukleusu se međusobno privlače dejstvom različitih sila, nuklearnih sila, koje su obično jače od elektromagnetne sile međusobnog odbijanja pozitivno naelektrisanih protona. Pod određenim okolnostima odbijajuća elektromagnetna sila postaje jača od nuklearne sile, i nukleoni mogu da budu izbačeni iz jezgra, ostavljajući iza sebe različiti element: nuklearno raspadanje dovodi do nuklearne transmutacije.
Broj protona u jezgru definiše kojem hemijskom elementu atom pripada. Na primer, svi atomi bakra sadrže 29 protona. Broj neutrona definiše izotop elementa.[4] Broj elektrona utiče na magnetna svojstva atoma. Atomi se mogu vezati za jedan ili više drugih atoma putem hemijskih veza čime se formiraju hemijska jedinjenja kao što su molekuli. Sposobnost atoma da se asocira i disocira je odgovorna za većinu fizičkih promena primetnih u prirodi, i tema je nauke hemije.
Nisu sve mase u svemiru sastavljene od atoma. Tamna materija se sastoji od ne samo materije, već i od čestica koje su trenutno nepoznatog tipa. Takođe, klasična Njutnova fizika ne objašnjava mnoge od osobina i ponašanja atoma i subatomskih čestica: polje kvantne mehanike je razvijeno radi toga.
Istorija atomske teorije[uredi | uredi izvor]
Prve ideje o atomu su dali grčki filozof Leukip i njegov učenik Demokrit u 5. i 4. veku pre nove ere, koji su govorili da je svet građen od beskonačnog broja nevidljivih i nedeljivih čestica- atoma (άτομος- nedjeljiv).[5] Govorili su da su atomi vječni i da se razlikuju po obliku, težini, tvrdoći i veličini. Takođe, tvrdili su da se atomi kreću u praznom prostoru, pravolinijski - odozgo prema dole. Teži se brže kreću, sustižu lakše, grupišu i tako grade sve stvari. Demokrit je tvrdio da su prava svojstva atoma: oblik, veličina, težina, pokret i tvrdoća. Sekundarna svojstva su: boje, mirisi i ukusi.
Otkriće elektrona 1897. (J. J. Tompson) pokazalo je da se u atomima nalaze još fundamentalnije čestice. 14 godina kasnije, Rutherford je otkrio da se većina mase atoma nalazi u sićušnom jezgru (nukleus) čiji je radijus samo 1/100000 u odnosu na celi atom. U međuvremenu, Maks Plank (1858—1947) postavio je teoriju da se svetlost sastoji od fotona koji su ekvivalent česticama valnog gibanja.
U filozofiji[uredi | uredi izvor]
Osnovna ideja da se materija sastoji od sićušnih nedeljivih čestica je stara ideja koja se pojavila u mnogim drevnim kulturama. Reč atom potiče od starogrčke reči atomos,[a] što znači „nerezivi“. Ova drevna ideja bila je zasnovana na filozofskom rasuđivanju, a ne na naučnom rasuđivanju. Savremena atomska teorija nije zasnovana na ovim starim konceptima.[6][7] Početkom 19. veka, naučnik Džon Dalton primetio je da se hemijski elementi kombinuju jedni sa drugima u vidu diskretnih jedinica težine, i odlučio je da koristi reč „atom“ da se odnosi na ove jedinice, jer je mislio da su to osnovne jedinice materije.[8] Otprilike jedan vek kasnije otkriveno je da Daltonovi atomi zapravo nisu nedeljivi, ali se termin zadržao.
Daltonov zakon višestrukih proporcija[uredi | uredi izvor]

Početkom 1800-ih, engleski hemičar Džon Dalton je objedinio eksperimentalne podatke koje su prikupili on i drugi naučnici i otkrio obrazac koji je sada poznat kao „zakon umnoženih masenih odnosa”. Primetio je da se u hemijskim jedinjenjima koja sadrže određeni hemijski element sadržaj tog elementa razlikovati po težini u vidu odnosa malih celih brojeva. Ovaj obrazac je sugerisao da se svaki hemijski element kombinuje sa drugim elementima po osnovnoj jedinici težine, a Dalton je odlučio da te jedinice nazove „atomima“.
Na primer, postoje dve vrste kalajnog oksida: jedan je sivi prah koji sadrži 88,1% kalaja i 11,9% kiseonika, a drugi je beli prah koji sadrži 78,7% kalaja i 21,3% kiseonika. Prilagođavajući ove cifre, u sivom prahu ima oko 13,5 g kiseonika na svakih 100 g kalaja, a u belom prahu oko 27 g kiseonika na svakih 100 g kalaja. 13,5 i 27 čine odnos 1:2. Dalton je zaključio da u ovim oksidima za svaki atom kalaja postoje jedan ili dva atoma kiseonika (SnO i SnO2).[9][10]
Dalton je takođe analizirao okside gvožđa. Postoji jedna vrsta oksida gvožđa koji je crni prah koji sadrži 78,1% gvožđa i 21,9% kiseonika; a postoji još jedan oksid gvožđa koji je crveni prah koji sadrži 70,4% gvožđa i 29,6% kiseonika. Prilagođavajući ove brojke, u crnom prahu ima oko 28 g kiseonika na svakih 100 g gvožđa, a u crvenom prahu oko 42 g kiseonika na svakih 100 g gvožđa. 28 i 42 čine odnos 2:3. Dalton je zaključio da u ovim oksidima, na svaka dva atoma gvožđa, postoje dva, odnosno tri atoma kiseonika (Fe2O2 i Fe2O3).[b][11][12]
Kao finalni primer: azot-suboksid je 63,3% azota i 36,7% kiseonika, azot-monoksid je 44,05% azota i 55,95% kiseonika, a azot dioksid je 29,5% azota i 70,5% kiseonika. Prilagođavajući ove brojke, u azot-suboksidu je 80 g kiseonika na svakih 140 g azota, u azot-oksidu je oko 160 g kiseonika na svakih 140 g azota, a u azot-dioksidu je 320 g kiseonika na svakih 140 g azota. 80, 160 i 320 čine odnos 1:2:4. Odgovarajuće formule za ove okside su N2O, NO, i NO2.[13][14]
Izomerizam[uredi | uredi izvor]
Naučnici su otkrili da neke supstance imaju potpuno isti hemijski sadržaj, ali različita svojstva. Na primer, 1827. godine, Fridrih Veler je otkrio da srebro fulminat i srebro cijanat čine 107 delova srebra, 12 delova ugljenika, 14 delova azota i 12 delova kiseonika (sada je poznato da je njihova formula AgCNO). Godine 1830, Jons Jakob Bercelijus je uveo termin izomerizam da bi opisao ovaj fenomen. Godine 1860, Luj Paster je pretpostavio da molekuli izomera mogu imati isti skup atoma, ali u različitim rasporedima.[15]
Godine 1874, Jakobus Henrikus van't Hof je predložio da se atom ugljenika vežuje za druge atome u tetraedarskom rasporedu. Radeći na bazi ovoga, objasnio je strukture organskih molekula na takav način da je mogao da predvidi koliko izomera može imati jedinjenje. Razmotrite, na primer, pentan (C5H12). U van't Hofovom načinu modelovanja molekula, postoje tri moguće konfiguracije za pentan, i naučnici su otkrili tri i samo tri izomera pentana.[16][17]
Periodni sistem[uredi | uredi izvor]
Godine 1870, Dmitrij Mendeljejev je primetio da kada se rasporede elementi u nizu prema njihovoj atomskoj težini, postoji određena periodičnost njihovih svojstava.[18] Na primer, drugi element, litijum, imao je slična svojstva kao i deveti element, natrijum, i šesnaesti element, kalijum - perioda od sedam. Isto tako, berilijum, magnezijum i kalcijum su bili slični i svi su bili udaljeni sedam mesta jedno od drugog u Mendeljejevoj tabeli. Koristeći ove obrasce, Mendeljejev je predvideo postojanje i svojstva novih elemenata koji su kasnije otkriveni u prirodi: skandijuma, galijuma i germanijuma.[19] Štaviše, periodna tabela može predvideti sa koliko atoma drugih elemenata se atom može povezati - na primer, atom ugljenika i atom germanijuma se mogu kombinovati sa dva atoma kiseonika, i ovi elementi su u istoj grupi. Mendeljejev je otkrio da ovi obrasci potvrđuju atomsku teoriju, jer je pokazano da se elementi mogu kategorisati prema njihovoj atomskoj težini.
Otkriće elektrona[uredi | uredi izvor]
Godine 1897, Dž. Dž. Tomson je otkrio da katodni zraci nisu elektromagnetni talasi, već su napravljeni od čestica, jer se mogu odbiti električnim i magnetnim poljima. On je izmerio da su ove čestice 1800 puta lakše od vodonika (najlakšeg atoma). Tomson je zaključio da ove čestice potiču od atoma unutar katode - bile su subatomske čestice. Ove nove čestice je nazvao korpuskulama, ali su kasnije preimenovane u elektrone. Tomson je takođe pokazao da su elektroni identični česticama koje daju fotoelektrični i radioaktivni materijali.[20] Brzo je postalo poznato da su elektroni čestice koje nose električne struje u metalnim žicama.[21] Tomson je zaključio da su ti elektroni nastali iz samih atoma katode u njegovim instrumentima, što je značilo da atomi nisu nedeljivi kao što je Dalton mislio.
Otkriće jezgra[uredi | uredi izvor]

Levo: Očekivani rezultati: alfa čestice prolaze kroz model atoma pudinga od šljive sa zanemarljivim otklonom.
Desno: Uočeni rezultati: mali deo čestica je odbijen zbog koncentrisanog pozitivnog naelektrisanja jezgra.
Dž. Dž. Tomson je smatrao da su negativno naelektrisani elektroni raspoređeni po atomu u moru pozitivnog naelektrisanja koje je raspoređeno po celoj zapremini atoma.[22] Ovaj model se ponekad naziva model pudinga od šljiva.
Ernest Radrford i njegove kolege Hans Gajger i Ernest Marsden su posumnjali u Tomsonov model nakon što su naišli na poteškoće kada su pokušali da naprave instrument za merenje odnosa naelektrisanja i mase alfa čestica (ovo su pozitivno naelektrisane čestice koje emituju određene radioaktivne supstance kao što je radijum). Alfa čestice bivaju raspršene vazduhom u komori za detekciju, zbog čega su merenja bila nepouzdana. Tomson se suočio sa sličnim problemom u svom radu na katodnim zracima, koji je rešio stvaranjem skoro savršenog vakuuma u svojim instrumentima. Raderford nije mislio da će naići na isti problem jer su alfa čestice mnogo teže od elektrona. Prema Tomsonovom modelu atoma, pozitivno naelektrisanje u atomu nije dovoljno koncentrisano da proizvede električno polje dovoljno jako da odbije alfa česticu, a elektroni su toliko lagani da bi ih mnogo teže alfa čestice trebalo bez napora da odgurnu u stranu. Ipak, došlo je do rasejanja, ta su Raderford i njegove kolege odlučili da pažljivo istraže ovo rasipanje.[23]
Između 1908. i 1913. Raderford i njegove kolege su izveli niz eksperimenata u kojima su bombardovali tanke metalne folije alfa česticama. Primetili su da se alfa čestice odbijaju pod uglovima većim od 90°. Da bi ovo objasnio, Raderford je predložio da pozitivno naelektrisanje atoma nije raspoređeno po zapremini atoma kao što je Tomson verovao, već je koncentrisano u malom jezgru u centru. Samo tako intenzivna koncentracija naelektrisanja mogla bi da proizvede električno polje dovoljno jako da odbije alfa čestice kao što je primećeno.[23]
Otkriće izotopa[uredi | uredi izvor]
Dok je eksperimentisao sa proizvodima radioaktivnog raspada 1913. godine, radiohemičar Frederik Sodi je otkrio da izgleda da postoji više od jednog tipa atoma na svakoj poziciji u periodnom sistemu.[24] Ovi atomi su imali ista svojstva, ali različite atomske težine. Termin izotop je skovala Margaret Tod kao odgovarajući naziv za atome različite težine koji pripadaju istom elementu. Dž. Dž. Tomson je stvorio tehniku za odvajanje izotopa kroz svoj rad na jonizovanim gasovima, što je kasnije dovelo do otkrića stabilnih izotopa.[25]
Borov model[uredi | uredi izvor]

Godine 1913, fizičar Nils Bor je predložio model u kojem se pretpostavljalo da elektroni atoma kruže oko jezgra, i da to mogu da čine samo u konačnom skupu orbita, i da mogu da skaču između ovih orbita samo u diskretnim promenama energije koje odgovaraju apsorpciji ili radijaciji fotona.[26] Ova kvantizacija je korišćena da se objasni zašto su orbite elektrona stabilne (s obzirom da normalno, naelektrisanja pri ubrzanju, uključujući kružno kretanje, gube kinetičku energiju koja se emituje kao elektromagnetno zračenje, pogledajte sinhrotronsko zračenje) i zašto elementi apsorbuju i emituju elektromagnetno zračenje u diskretnim spektrima.[27]
Kasnije iste godine Henri Mozli je pružio dodatne eksperimentalne dokaze u korist teorije Nilsa Bora. Ovi rezultati su poboljšali model Ernsta Raderforda i Antonija van den Bruka, koji su predložili da atom u svom jezgru sadrži broj pozitivnih nuklearnih naelektrisanja koji je jednak njegovom (atomskom) broju u periodnoj tabeli. Do ovih eksperimenata nije se znalo da je atomski broj fizička i eksperimentalna veličina. Da je jednak atomskom nuklearnom naelektrisanju, ostaje prihvaćen atomski model do danas.[28]
Hemijske veze između atoma objasnio je Gilbert Njutn Luis 1916. godine, kao interakcije između njihovih sastavnih elektrona.[29] Kako se znalo da se hemijska svojstva elemenata u velikoj meri ponavljaju prema periodnom zakonu,[30] američki hemičar Irving Langmir je 1919. godine sugerisao da bi se to moglo objasniti ako su elektroni u atomu povezani ili grupisani na neki način. Smatralo se da grupe elektrona zauzimaju skup elektronskih omotača oko jezgra.[31]
Borov model atoma bio je prvi kompletan fizički model atoma. On je opisao ukupnu strukturu atoma, kako se atomi vezuju jedni za druge i predvideo spektralne linije vodonika. Borov model nije bio savršen i ubrzo ga je zamenio tačniji Šredingerov model, ali je bio dovoljan da ukloni sve preostale sumnje da se materija sastoji od atoma. Za hemičare je ideja atoma bila korisno heurističko oruđe, ali fizičari su sumnjali da se materija zaista sastoji od atoma, jer niko još nije bio razvio potpuni fizički model atoma.
Šredingerov model[uredi | uredi izvor]
Godine 1925, Verner Hajzenberg je objavio prvu doslednu matematičku formulaciju kvantne mehanike (matrična mehanika).[traži se izvor] Godinu dana ranije, Luj de Brolj je predložio da se sve čestice ponašaju kao talasi u određenoj meri,[32] a 1926. Ervin Šredinger je iskoristio ovu ideju da razvije Šredingerovu jednačinu, matematički model atoma koji opisuje elektrone kao trodimenzionalne talasne forme, a ne tačke u prostoru.[33]
Posledica korišćenja talasnih oblika za opisivanje čestica je da je matematički nemoguće istovremeno dobiti precizne vrednosti za položaj i za impuls čestice u datom trenutku. Ovo je postalo poznato kao princip neizvesnosti, koji je formulisao Verner Hajzenberg 1927. godine.[28] U ovom konceptu, za datu tačnost u merenju pozicije može se dobiti samo opseg verovatnih vrednosti za impuls, i obrnuto.[34] Ovaj model je bio u stanju da objasni posmatranja ponašanja atoma koja prethodni modeli nisu mogli, kao što su određeni strukturni i spektralni obrasci atoma većih od vodonika. Dakle, planetarni model atoma je odbačen u korist onog koji opisuje atomske orbitalne zone oko jezgra gde je najverovatnije da će dati elektron biti primećen.[35][36]
Otkriće neutrona[uredi | uredi izvor]
Razvoj masenog spektrometra je omogućio da se masa atoma meri sa povećanom tačnošću. Ovaj uređaj koristi magnet za savijanje putanje snopa jona, a količina otklona je određena odnosom mase atoma i njegovog naelektrisanja. Hemičar Fransis Vilijam Aston koristio je ovaj instrument da pokaže da izotopi imaju različite mase. Atomska masa izotopa varirala je za celobrojne umnoške, što se naziva pravilo celog broja.[37] Objašnjenje za ove različite izotope čekalo je otkriće neutrona, nenaelektrisane čestice sa masom sličnom protonu, od strane fizičara Džejmsa Čedvika 1932. Izotopi su tada objašnjeni kao elementi sa istim brojem protona, ali različitim brojem neutrona unutar jezgra.[38]
Fisija, fizika visokih energija i kondenzovana materija[uredi | uredi izvor]
Godine 1938, nemački hemičar Oto Han, učenik Raderforda, usmerio je neutrone na atome uranijuma očekujući da će dobiti transuranijumske elemente. Umesto toga, njegovi hemijski eksperimenti su pokazali barijum kao proizvod.[39][40] Godinu dana kasnije, Liza Majtner i njen nećak Oto Friš potvrdili su da je Hanov rezultat prva eksperimentalna nuklearna fisija.[41][42] Godine 1944, Han je dobio Nobelovu nagradu za hemiju. Uprkos Hanovim naporima, doprinosi Majtnove i Friša nisu nagrađeni.[43]
Tokom 1950-ih, razvoj poboljšanih akceleratora čestica i detektora čestica omogućio je naučnicima da proučavaju uticaje atoma koji se kreću pri visokim energijama.[44] Utvrđeno je da su neutroni i protoni hadroni, ili kompoziti manjih čestica zvanih kvarkovi. Razvijen je standardni model fizike čestica koji je do sada uspešno objasnio svojstva jezgra u smislu ovih subatomskih čestica i sila koje upravljaju njihovim interakcijama.[45]
Struktura[uredi | uredi izvor]
Atom je stabilna elektro-neutralna kompozicija jezgra i elektronskog omotača.
Sastoji se od jezgra i elektronskog omotača. Jezgro sadrži pozitivno naelektrisane protone i nenaelektrisane neutrone, a elektronski oblak je izgrađen od negativno naelektrisanih elektrona. Elektroni su raspoređeni u ljuskama odnosno orbitalama. Nisu sve orbitale jednako velike. U orbitalama bližim jezgru stane manji broj elektrona, a u onim daljim od jezgra stane veći broj elektrona. Svojstvo atoma da popuni posljednju (najudaljeniju) orbitalu naziva se afinitet prema elektronu.
Protoni i neutroni imaju podjednaku masu, te su oko 2000 puta teži od elektrona čiju masu zanemarujemo, pa zbog toga jezgro čini 99,95%[46] mase atoma. Masa elektrona me, masa protona mp i masa neutrona mn su fundamentalne konstante, i mogu se pronaći u periodnom sistemu elemenata. Teže čestice (protoni i neutroni) locirani su u atomskom jezgru (nukleusu), elektroni zauzimaju mnogo veću zapreminu oko jezgra (elektronski oblak).
Jezgro je definisano:
- Atomskim, protonskim ili rednim brojem Z = broj protona = broj elektrona, ili Z = N(p) = N(e)
- Masenim ili nukleonskim brojem A = broj protona + broj neutrona, ili A = N(p) + N(n)
Subatomske čestice[uredi | uredi izvor]
Mada je reč atom originalno označavala čestice koje se ne mogu podeliti u manje čestice, u modernoj naučnoj upotrebi atom se sastoji od raznih subatomskih čestica. Konstituentne čestice atoma su elektron, proton i neutron; sva tri su fermioni. Atom vodonika nema neutrona, dok hidronski jon nema elektrona.
Elektron je daleko najmanje masivna čestica među ovim česticama, 9,11×10−31 kg sa negativnim električnim naelektrisanjem i veličinom koja je suviše mala da bi se mogla izmeriti dostupnim tehnikama.[47] On je najlakša čestica. Pod normalnim okolnostima, elektroni su vezani za pozitivno naelektrisane jedra putem privlačenja suprotno naelektrisanih naboja. Ako atom ima više ili manje elektrona od svog atomskog broja, onda on postaje respektivno negativno ili pozitivno naelektrisan; naelektrisani atom se zove jon. Elektroni su poznati od kasnog 19-tog veka, uglavnom zahvaljujući radu Tomsona; pogledajte istoriju subatomske fizike za detalje.
Protoni imaju pozitivno naelektrisanje i masu koja je 1.836 puta veća od elektrona, 1,6726×10−27 kg. Broj protona u atomu se naziva atomskim brojem. Ernest Rutherford (1919) je uočio da kad se azot bombarduje alfa-česticama dolazi do izbacivanja jezgra vodonika. Do 1920. on je usvojio da je jezgro vodonika zasebna čestica unutar atoma i dao mu je ime proton.
Neutroni nemaju električno naelektrisanje i imaju slobodnu masu koja je 1.839 puta veća od mase elektrona,[48] ili 1,6929×10−27 kg, te su najteža od tri konstituentne čestice, mada njihova masa može da bude redukovana dejstvom nuklearne energije vezivanja. Neutroni i protoni (kolektivno poznati kao nukleoni) imaju slične dimenzije reda veličine 2,5×10−15 m, mada 'površina' tih čestica nije jasno definisana.[49] Neutron je otkrio engleski fizičar Džejms Čedvik 1932. godine.
U fizičkom standardnom modelu, elektroni su istinske elementarne čestice bez unutrašnje strukture. Protoni i neutroni su kompozitne čestice koje se sastoje od elementarnih čestica zvanih kvarkovi. Postoji dva tipa kvarkova u atomima, svaki od kojih ima frakciono električno naelektrisanje. Protoni se sastoje od dva gornja kvarka (svaki sa naelektrisanjem od +2⁄3) i jednog donjeg kvarka (sa naelektrisanjem od −1⁄3). Neutroni se sastoje od jednog gornjeg kvarka i dva donja kvarka. Ta razlika uzrokuje razliku u masi i naelektrisanju između dve čestice.[50][51]
Kvarkovi se održavaju zajedno dejstvom jake interakcije (ili jake sile), koja je posredovana gluonima. Protoni i neutroni se održavaju zajedno u jezgru dejstvom nuklearne sile, koja je ostatak jake sile koji ima donekle različite opsege - svojstva (vidite članak o nuklearnoj sili za dodatne informacije). Gluon je član familije baždarnih bozona, koji su elementarne čestice koje posreduju fizičke sile.[50][51]
Nukleus[uredi | uredi izvor]

Svi vezani protoni i neutroni u atomu sačinjavaju sićušno atomsko jezgro, i kolektivno se nazivaju nukleonima. Radijus nukleusa je približno jednak 1,07 3√A fm, gde je A totalni broj nukleona.[52] To je znatno manje od prečnika atoma, koji je reda veličine 105 fm. Nukleoni su vezani zajedno atraktivnim potencijalom kratkog raspona zvanim rezidualna jaka sila. Na rastojanjima manjim od 2,5 fm ta sila je daleko jača od elektrostatičke sile koja uzrokuje međusobno odbijanje pozitivno naelektrisanih protona.[53]
Atomi istog elementa imaju isti broj protona, koji se naziva atomskim brojem. Unutar jednog elementa, broj neutrona može da varira, određujući izotope tog elementa. Totalni broj protona i neutrona određuje nuklid. Broj neutrona relativno na broj protona određuje stabilnost jezgra. Pojedini izotopi podležu radioaktivnom raspadu.[54]
Proton, elektron, i neutron se klasifikuju kao fermioni. Fermioni podležu Paulijevom principu isključenja koji nalaže da identični fermioni, kao što su višestruki protoni, ne mogu da imaju isto kvantno stanje u isto vreme. Stoga svaki proton u nukleusu mora da ima kvantno stanje koje je različito od svih drugih protona, a isto pravilo važi i za sve neutrone u nukleusu i sve elektrone u elektronskom oblaku. Međutim, proton i neutron mogu da imaju isto kvantno stanje.[55]
Kod atoma sa niskim atomskim brojevima, nukleus koji ima više neutrona nego protona ima tendenciju zauzimanja nižeg energetskog stanja putem radioaktivnog raspada tako da se odnos neutrona i protona približava jedinici. Sa povećanjem atomskog broja veći udeo neutrona je neophodan da bi se umanjilo međusobno odbijanje protona. Stoga se ne javljaju stabilna jezgra sa jednakim brojem protona i neutrona iznad atomskog broja Z = 20 (kalcijum) i sa povećanjem atomskog broja odnos neutrona i protona stabilnih izotopa se povećava.[55] Stabilni izotop sa najvišim odnosom protona i neutrona je olovo-208 (oko 1,5).
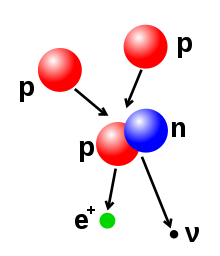
Broj protona i neutrona u atomskom jezgru se može promeniti, mada su za to potrebne velike energije zbog dejstava jake sile. Nuklearna fuzija se odvija kad se višestruke atomske čestice spoje i formiraju teže jezgro, na primer putem energetske kolizije dva nukleusa. U jezgru Sunca protonima su potrebne energije od 3–10 KeV da bi se prevazišlo njihovo prirodno odbijanje — Kulonova barijera — i da bi se spojili u zajedničko jezgro.[56] Nuklearna fisija je suprotni proces, koji uzrokuje cepanje jezgra u dva manja jezgra — obično putem radioaktivnog raspada. Jezgra se isto tako mogu modifikovati putem bombardovanja subatomskim česticama visoke energije ili fotonima. Ako se time promeni broj protona u jezgru, atom prelazi u različiti hemijski element.[57][58]
Ako je masa jezgra nakon reakcije fuzije manja od sume masa zasebnih čestica, onda razlika između tih vrednosti može da bude emitovana kao vid upotrebljive energije (kao što su gama zraci, ili kinetička energija beta čestica), u skladu sa Ajnštajnovom formulom ekvivalencije mase i energije, E = mc2, gde je m gubitak mase, a c je brzina svetlosti. Taj deficit je deo energije vezivanja novog jezgra, i predstavlja nepovratni gubitak energije koji uzrokuje da spojena jezgra ostanu zajedno u stanju kome je neophodna ta energiju da bi došlo do razdvajanja.[59]
Fuzija dva jezgra kojom se formira veće jezgro sa manjim atomskim brojevima od gvožđa i nikla — total broj nukleona od oko 60 — je obično egzotermni proces u kome se otpušta više energije nego što je potrebno za spajanje.[60] Taj proces otpuštanja energije čini nuklearnu fuziju u zvezdama samo održivom reakcijom. Za teža jezgra, energija vezivanja po nukleonu u jezgru počinje da opada. Konsekventno, fuzioni procesi kojima se formiraju jezgra sa atomskim brojem većim od oko 26, i atomskim masama većim od oko 60, su endotermni procesi. Ta masivnija jezgra ne podležu fuziji pri kojoj se otpušta energija tako da se može održati hidrostatička ravnoteža zvezde.[55]
Elektronski oblak[uredi | uredi izvor]


Elektrone u atomu privlače protoni u jezgru dejstvom elektromagnetske sile. Ta sila vezuje elektrone unutar elektrostatičke jame potencijala koja okružuje malo jezgro, što znači da je spoljašnji izvor energije neophodan da bi se odvojili elektroni. Što je elektron bliže jezgru, to je veća sila privlačenja. Otuda je elektronima vezanim u blizini centra jame potencijala potrebno više energije da se odvoje od onih na većim rastojanjima.
Elektroni, poput drugih čestica, imaju dvojna svojstva čestica i talasa. Elektronski oblak je region unutar jame potencijala, pri čemu svaki elektron formira tip trodimenzionog stajaćeg talasa — forme talasa koji se ne pokreće relativno na jezgro. Takvo ponašanje se definiše kao atomska orbitala, matematička funkcija koja opisuje verovatnoću da će elektron boraviti na datoj lokaciji kad se njegova pozicija meri.[61] Jedino diskretni (ili kvantizovani) set tih orbitala postoji oko jezgra, pošto drugi mogući talasni paterni brzo prelaze u stabilniju formu.[62] Orbitale mogu da imaju jedan ili više prstenova ili čvornih struktura, i one se međusobno razlikuju po veličini, obliku i orijentaciji.[63]
Svaka atomska orbitala odgovara specifičnom energetskom nivou elektrona. Elektron može da promeni svoje stanje do višeg energetskog nivoa putem apsorbovanja fotona sa dovoljnom energijom da omogući prelaz u novo kvantno stanje. Slično tome, putem spontane emisije, elektron u višem energetskom stanju može da se spusti na niže energetsko stanje uz emitovanje suvišne energije u obliku fotona. Te karakteristične energetske vrednosti, definisane razlikama energija kvantnih stanja, su odgovorne za atomske spektralne linije.[62]
Količina energija koja je neophodna za uklanjanje ili dodavanje elektrona — elektronska energija vezivanja — je daleko manja od energije vezivanja nukleona. Na primer, neophodno je samo 13,6 eV da bi se odvojio elektron u stacionarnom stanju iz atoma vodonika,[64] u poređenju sa 2,23 miliona eV za cepanje jezgra deuterijuma.[65] Atomi su električno neutralni, ako imaju jednak broj protona i elektrona. Atomi koji imaju bilo deficit ili suficit elektrona se nazivaju jonima. Elektroni koji su najudaljeniji od jezgra se mogu preneti na obližnje atome ili ih atomi mogu deliti. Putem tog mehanizma, atomi se mogu vezati u molekule i druge tipove hemijskih jedinjenja, kao što su jonske i kovalentne mreže kristala.[66]
Modeli atoma[uredi | uredi izvor]
- 1. Prvi model atoma pripisuje se Demokritu. Pošto u to doba nije bilo nikakvih saznanja o strukturi atoma (nisu postojali elektronski mikroskopi), atomi su zamišljani kao jako male nedeljive kuglice.
- 2. „Puding“-model - kad je otkriven elektron, formirana je teorija da su u središtu atoma elektroni, a svuda okolo je pozitivan naboj. To je metafora na suvo grožđe u pudingu (grožđe je malo dok je posuda pudinga velika).
- 3. Borov model je ustanovljen posle Ruterfordovih eksperimenata kojima je utvrđeno da je u centru atoma malo pozitivno naelektrisano jezgro (nukleus), a elektroni kruže u orbitalama oko jezgra poput planeta koje kruže oko Sunca. Da bi taj model bio prihvaćen, bilo je neophodno da se reši sledeći problem: pošto je jezgro pozitivno naelektrisano, a elektron negativno, zašto elektron uopšte kruži oko jezgra, i zašto se ne spoji s jezgrom.
- 1. Elektroni postoje u orbitalama koje poseduju diskretne (kvantizovane) energije. To znači da ne postoji kontinuirani mogući razmak između jezgra i orbitale, nego su mogući samo neki razmaci. Ti razmaci i njima odgovarajuće energije zavise od konkretnog atoma koji razmatramo.
- 2. Zakoni klasične mehanike ne vrede pri prelasku elektrona iz jedne orbitale u drugu.
- 3. Kad elektron pređe iz jedne orbitale u drugu energetska razlika se oslobađa (ili dobija) u vidu kvanta svetlosti (koji nazivamo foton) čija frekvencija direktno zavisi od energetske razlike između dve orbite.
- gde je f frekvencija fotona, E energetska razlika, a h je konstanta poznata kao Plankova konstanta. Ako definiramo da je možemo pisati
- gde je ω ugaona frekvencija fotona.
- 4. Dozvoljene orbitale zavise od kvantizovanih (diskretnih) vrednosti ugaonog momenta L prema jednačini:
- Gde je n = 1,2,3,… i zovemo ga kvantni broj ugaonog momenta.
- 4. Današnji model atoma nazivamo kvantno-mehanički model, jer je s vremenom utvrđeno da Bohrov model ne odgovara baš najbolje eksperimentima, da elektroni ne kruže baš po kružnicama, nego slike dostupne pomoću elektronskih mikroskopa prikazuju elektronske oblake.
Etimologija[uredi | uredi izvor]
Reč atom dolazi od starogrčke reči atomos - nedeljiv. Ime atom od starogrčkih filozofa Leukipa i Demokrita preuzeli su naučnici početkom 19. veka (Džon Dalton i drugi) verujući da postoje atomi hemijskih elemenata kao najmanji deljivi elementi materije.[67]
Napomene[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Mišić, Milan, ur. (2005). Enciklopedija Britanika. A-B. Beograd: Narodna knjiga : Politika. str. 80. ISBN 86-331-2075-5.
- ^ D. C. Ghosh & R. Biswas (2002). „Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii”. Int. J. Mol. Sci. 3 (2): 87—113. doi:10.3390/i3020087
 .
.
- ^ „Fatal Error”. Arhivirano iz originala 26. 3. 2017. g. Pristupljeno 25. 3. 2017.
- ^ Leigh, G. J., ur. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry – Recommendations 1990. Oxford: Blackwell Scientific Publications. str. 35. ISBN 978-0-08-022369-8. „An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements.”
- ^ Logos 2017, str. 219-220.
- ^ Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. str. 31—33. ISBN 978-0-19-515040-7. Arhivirano iz originala 5. 2. 2021. g. Pristupljeno 25. 10. 2020.
- ^ Melsen (1952). From Atomos to Atom, pp. 18–19
- ^ Pullman (1998). The Atom in the History of Human Thought, p. 198: "Dalton reaffirmed that atoms are indivisible and indestructible and are the ultimate constituents of matter."
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 36
- ^ Melsen (1952). From Atomos to Atom, p. 137
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 28
- ^ Millington (1906). John Dalton, p. 113
- ^ Dalton (1808). A New System of Chemical Philosophy vol. 1, pp. 316–319
- ^ Holbrow et al. (2010). Modern Introductory Physics, pp. 65–66
- ^ Pullman (1998). The Atom in the History of Human Thought, p. 230
- ^ Melsen (1952). From Atomos to Atom, pp. 147–148
- ^ Henry Enfield Roscoe, Carl Schorlemmer (1895). A Treatise on Chemistry, Volume 3, Part 1, pp. 121–122
- ^ Scerri (2020), p. 117
- ^ Scerri (2020), p. 118
- ^ Thomson, J.J. (avgust 1901). „On bodies smaller than atoms”. The Popular Science Monthly: 323—335. Arhivirano iz originala 1. 12. 2016. g. Pristupljeno 21. 6. 2009.
- ^ "The Mechanism Of Conduction In Metals" Arhivirano 25 oktobar 2012 na sajtu Wayback Machine, Think Quest.
- ^ Navarro (2012). A History of the Electron, p. 94
- ^ a b Heilbron (2003). Ernest Rutherford and the Explosion of Atoms, pp. 64–68
- ^ „Frederick Soddy, The Nobel Prize in Chemistry 1921”. Nobel Foundation. Arhivirano iz originala 9. 4. 2008. g. Pristupljeno 18. 1. 2008.
- ^ Thomson, Joseph John (1913). „Rays of positive electricity”. Proceedings of the Royal Society. 89 (607): 1—20. Bibcode:1913RSPSA..89....1T. doi:10.1098/rspa.1913.0057
 . Arhivirano iz originala 4. 11. 2016. g.
. Arhivirano iz originala 4. 11. 2016. g.
- ^ Stern, David P. (16. 5. 2005). „The Atomic Nucleus and Bohr's Early Model of the Atom”. NASA/Goddard Space Flight Center. Arhivirano iz originala 20. 8. 2007. g.
- ^ Bohr, Niels (11. 12. 1922). „Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture”. Nobel Foundation. Arhivirano iz originala 15. 4. 2008. g.
- ^ a b Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. str. 228–230. ISBN 978-0-19-851971-3.
- ^ Lewis, Gilbert N. (1916). „The Atom and the Molecule”. Journal of the American Chemical Society. 38 (4): 762—786. S2CID 95865413. doi:10.1021/ja02261a002. Arhivirano (PDF) iz originala 25. 8. 2019. g.
- ^ Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. str. 205–226. ISBN 978-0-19-530573-9.
- ^ Langmuir, Irving (1919). „The Arrangement of Electrons in Atoms and Molecules”. Journal of the American Chemical Society. 41 (6): 868—934. doi:10.1021/ja02227a002. Arhivirano iz originala 21. 6. 2019. g.
- ^ McEvoy, J. P.; Zarate, Oscar (2004). Introducing Quantum Theory. Totem Books. str. 110–114. ISBN 978-1-84046-577-8.
- ^ Kozłowski, Miroslaw (2019). „The Schrödinger equation A History”.
- ^ Chad Orzel (16. 9. 2014). „What is the Heisenberg Uncertainty Principle?”. TED-Ed. Arhivirano iz originala 13. 9. 2015. g. — preko YouTube.
- ^ Brown, Kevin (2007). „The Hydrogen Atom”. MathPages. Arhivirano iz originala 5. 9. 2012. g.
- ^ Harrison, David M. (2000). „The Development of Quantum Mechanics”. University of Toronto. Arhivirano iz originala 25. 12. 2007. g.
- ^ Aston, Francis W. (1920). „The constitution of atmospheric neon”. Philosophical Magazine. 39 (6): 449—455. doi:10.1080/14786440408636058. Arhivirano iz originala 27. 4. 2021. g. Pristupljeno 25. 10. 2020.
- ^ Chadwick, James (12. 12. 1935). „Nobel Lecture: The Neutron and Its Properties”. Nobel Foundation. Arhivirano iz originala 12. 10. 2007. g.
- ^ Bowden, Mary Ellen (1997). „Otto Hahn, Lise Meitner, and Fritz Strassmann”. Chemical achievers : the human face of the chemical sciences. Philadelphia, PA: Chemical Heritage Foundation. str. 76–80, 125. ISBN 978-0-941901-12-3.
- ^ „Otto Hahn, Lise Meitner, and Fritz Strassmann”. Science History Institute. jun 2016. Arhivirano iz originala 21. 3. 2018. g.
- ^ Meitner, Lise; Frisch, Otto Robert (1939). „Disintegration of uranium by neutrons: a new type of nuclear reaction”. Nature. 143 (3615): 239—240. Bibcode:1939Natur.143..239M. S2CID 4113262. doi:10.1038/143239a0.
- ^ Schroeder, M. „Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages” (na jeziku: nemački). Arhivirano iz originala 19. 7. 2011. g. Pristupljeno 4. 6. 2009.
- ^ Crawford, E.; Sime, Ruth Lewin; Walker, Mark (1997). „A Nobel tale of postwar injustice”. Physics Today. 50 (9): 26—32. Bibcode:1997PhT....50i..26C. doi:10.1063/1.881933.
- ^ Kullander, Sven (28. 8. 2001). „Accelerators and Nobel Laureates”. Nobel Foundation. Arhivirano iz originala 13. 4. 2008. g.
- ^ „The Nobel Prize in Physics 1990”. Nobel Foundation. 17. 10. 1990. Arhivirano iz originala 14. 5. 2008. g.
- ^ Grlić, Ljubiša (1992). Mali kemijski leksikon. Zagreb: Naprijed. str. 25. ISBN 978-86-349-0292-1.
- ^ Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st izd.). Springer. str. 39—42. ISBN 978-3-540-20631-6. OCLC 181435713.
- ^ Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. str. 8. ISBN 978-0-521-57507-2. OCLC 224032426.
- ^ MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. str. 33—37. ISBN 978-0-19-521833-6. OCLC 223372888.
- ^ a b Group, Particle Data (2002). „The Particle Adventure”. Lawrence Berkeley Laboratory. Arhivirano iz originala 4. 1. 2007. g. Pristupljeno 3. 1. 2007.
- ^ a b Schombert, James (18. 4. 2006). „Elementary Particles”. University of Oregon. Arhivirano iz originala 30. 08. 2011. g. Pristupljeno 3. 1. 2007.
- ^ Jevremovic 2005, str. 63.
- ^ Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. str. 330—336. ISBN 978-1-86094-250-1. OCLC 45900880.
- ^ Wenner, Jennifer M. (10. 10. 2007). „How Does Radioactive Decay Work?”. Carleton College. Pristupljeno 9. 1. 2008.
- ^ a b v Raymond, David (7. 4. 2006). „Nuclear Binding Energies”. New Mexico Tech. Arhivirano iz originala 11. 12. 2006. g. Pristupljeno 3. 1. 2007.
- ^ Mihos, Chris (23. 7. 2002). „Overcoming the Coulomb Barrier”. Case Western Reserve University. Pristupljeno 13. 2. 2008.
- ^ Staff (30. 3. 2007). „ABC's of Nuclear Science”. Lawrence Berkeley National Laboratory. Arhivirano iz originala 5. 12. 2006. g. Pristupljeno 3. 1. 2007.
- ^ Makhijani, Arjun; Saleska, Scott (2. 3. 2001). „Basics of Nuclear Physics and Fission”. Institute for Energy and Environmental Research. Arhivirano iz originala 16. 1. 2007. g. Pristupljeno 3. 1. 2007.
- ^ Shultis & Faw 2002, str. 10–17.
- ^ Fewell, M. P. (1995). „The atomic nuclide with the highest mean binding energy”. American Journal of Physics. 63 (7): 653—658. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ^ Mulliken, Robert S. (1967). „Spectroscopy, Molecular Orbitals, and Chemical Bonding”. Science. 157 (3784): 13—24. Bibcode:1967Sci...157...13M. PMID 5338306. doi:10.1126/science.157.3784.13.
- ^ a b Brucat, Philip J. (2008). „The Quantum Atom”. University of Florida. Arhivirano iz originala 7. 12. 2006. g. Pristupljeno 4. 1. 2007.
- ^ Manthey, David (2001). „Atomic Orbitals”. Orbital Central. Arhivirano iz originala 10. 1. 2008. g. Pristupljeno 21. 1. 2008.
- ^ Herter, Terry (2006). „Lecture 8: The Hydrogen Atom”. Cornell University. Pristupljeno 14. 2. 2008.
- ^ Bell, R. E.; Elliott, L. G. (1950). „Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron”. Physical Review. 79 (2): 282—285. Bibcode:1950PhRv...79..282B. doi:10.1103/PhysRev.79.282.
- ^ Smirnov 2003, str. 249-272
- ^ Logos 2017, str. 226-227.
Literatura[uredi | uredi izvor]
- Mišić, Milan, ur. (2005). Enciklopedija Britanika. A-B. Beograd: Narodna knjiga : Politika. str. 80. ISBN 86-331-2075-5.
- Leigh, G. J., ur. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry – Recommendations 1990. Oxford: Blackwell Scientific Publications. str. 35. ISBN 978-0-08-022369-8.
- Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. str. 249-272. ISBN 978-0-387-95550-6.
- Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. str. 63. ISBN 978-0-387-23284-3. OCLC 228384008.
- MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. str. 33—37. ISBN 978-0-19-521833-6. OCLC 223372888.
- Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. str. 10—17. ISBN 978-0-8247-0834-4. OCLC 123346507.
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st izd.). Springer. str. 39—42. ISBN 978-3-540-20631-6. OCLC 181435713.
- Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. str. 330—336. ISBN 978-1-86094-250-1. OCLC 45900880.
- Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. str. 8. ISBN 978-0-521-57507-2. OCLC 224032426.
- S. Macura, J. Radić-Perić, Atomistika, Fakultet za fizičku hemiju Univerziteta u Beogradu/Službeni list, Beograd, 2004.
- L'Annunziata Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. ISBN 978-0-12-436603-9. OCLC 16212955.
- Beyer, H. F.; Shevelko, V. P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. ISBN 978-0-7503-0481-8. OCLC 47150433.
- Choppin Gregory R.; Liljenzin Jan-Olov; Jan, Rydberg (2001). Radiochemistry and Nuclear Chemistry. Elsevier. ISBN 978-0-7506-7463-8. OCLC 162592180.
- Dalton, J. (1808). A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell.
- Richard, Feynman (1995). Six Easy Pieces. The Penguin Group. ISBN 978-0-14-027666-4. OCLC 40499574.
- Wolfgang, Demtröder (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st izd.). Springer. ISBN 978-3-540-20631-6. OCLC 181435713.
- Fowles Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. ISBN 978-0-486-65957-2. OCLC 18834711.
- Mrinalkanti, Gangopadhyaya (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 978-0-391-02177-8. OCLC 10916778.
- Goodstein David L. (2002). States of Matter. Courier Dover Publications. ISBN 978-0-13-843557-8.
- Pablo, Iannone A. (2001). Dictionary of World Philosophy. Routledge. ISBN 978-0-415-17995-9. OCLC 44541769.
- Robert, Harrison Edward (2003). Masks of the Universe: Changing Ideas on the Nature of the Cosmos. Cambridge University Press. ISBN 978-0-521-77351-5. OCLC 50441595.
- James, Lequeux (2005). The Interstellar Medium. Springer. ISBN 978-3-540-21326-0. OCLC 133157789.
- Richard, King (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. Edinburgh University Press. ISBN 978-0-7486-0954-3.
- Tatjana, Jevremovic (2005). Nuclear Principles in Engineering. Springer. ISBN 978-0-387-23284-3. OCLC 228384008.
- Levere Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. The Johns Hopkins University Press. ISBN 978-0-8018-6610-4.
- LiangZ.-P.; Haacke, E. M. (1999). Webster, J. G., ur. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging (PDF). vol. 2. John Wiley & Sons. str. 412—26. ISBN 978-0-471-13946-1. doi:10.1109/SSBI.2002.1233976. Pristupljeno 9. 1. 2008.
- Thomas, McEvilley (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. Allworth Press. ISBN 978-1-58115-203-6.
- MacGregor Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. ISBN 978-0-19-521833-6. OCLC 223372888.
- Oliver, Manuel (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 978-0-306-46562-8. OCLC 228374906.
- Mazo Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. ISBN 978-0-19-851567-8. OCLC 48753074.
- Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (2nd izd.). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. ISBN 978-0-632-03583-0. OCLC 27011505.
- Moran Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. Harvard University Press. ISBN 978-0-674-01495-4.
- Richard, Myers (2003). The Basics of Chemistry. Greenwood Press. ISBN 978-0-313-31664-7. OCLC 50164580.
- Padilla Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey USA: Prentice-Hall, Inc. ISBN 978-0-13-054091-1. OCLC 47925884.
- Abraham, Pais (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. ISBN 978-0198519713.
- Linus, Pauling (1960). The Nature of the Chemical Bond. Cornell University Press. ISBN 978-0-8014-0333-0. OCLC 17518275.
- Pfeffer Jeremy I.; Shlomo, Nir (2000). Modern Physics: An Introductory Text. Imperial College Press. ISBN 978-1-86094-250-1. OCLC 45900880.
- Enfield, Roscoe Henry (1895). John Dalton and the Rise of Modern Chemistry. Century science series. New York: Macmillan. Pristupljeno 3. 4. 2011.
- Kenneth, Shultis J., Faw Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. ISBN 978-0-8247-0834-4. OCLC 123346507.
- Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. CRC Press. ISBN 978-0-7503-0251-7. OCLC 26853108.
- Robert, Siegfried (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 978-0-87169-924-4. OCLC 186607849.
- Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. ISBN 978-0-19-530573-9.
- Sills Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. ISBN 978-0-7641-2146-3. OCLC 51543743.
- Smirnov Boris M. (2003). Physics of Atoms and Ions. Springer. ISBN 978-0-387-95550-6.
- Dick, Teresi (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. str. 213—214. ISBN 978-0-7432-4379-7.
- Various (2002). Lide, David R., ur. Handbook of Chemistry & Physics (88th izd.). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. Arhivirano iz originala 24. 07. 2017. g. Pristupljeno 23. 5. 2008.
- Adolphe, Wurtz Charles (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 978-0-559-43636-9.
- Graham, Woan (2000). The Cambridge Handbook of Physics. Cambridge University Press. ISBN 978-0-521-57507-2. OCLC 224032426.
- Marco, Zaider; Rossi Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. ISBN 978-0-306-46403-4. OCLC 44110319.
- Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (5th izd.). Houghton Mifflin. ISBN 978-0-618-34342-3. OCLC 173081482. Arhivirano iz originala 04. 03. 2008. g. Pristupljeno 5. 2. 2008.
- Logos, Aleksandar A. (2017). Putovanje misli : uvod u potragu za istinom. Beograd.
Spoljašnje veze[uredi | uredi izvor]
- Web courseware Povijest fizike
- "Quantum Mechanics and the Structure of Atoms" na sajtu YouTube
- Freudenrich, Craig C. „How Atoms Work”. How Stuff Works. Arhivirano iz originala 8. 1. 2007. g. Pristupljeno 9. 1. 2007.
- „The Atom”. Free High School Science Texts: Physics. Wikibooks. Pristupljeno 10. 7. 2010.
- Anonymous (2007). „The atom”. Science aid+. Arhivirano iz originala 22. 01. 2010. g. Pristupljeno 10. 7. 2010.—a guide to the atom for teens.
- Anonymous (3. 1. 2006). „Atoms and Atomic Structure”. BBC. Arhivirano iz originala 2. 1. 2007. g. Pristupljeno 11. 1. 2007.
- Various (3. 1. 2006). „Physics 2000, Table of Contents”. University of Colorado. Arhivirano iz originala 14. 1. 2008. g. Pristupljeno 11. 1. 2008.
- Various (3. 2. 2006). „What does an atom look like?”. University of Karlsruhe. Arhivirano iz originala 17. 04. 2010. g. Pristupljeno 12. 5. 2008.