Атом
| Атом | |
|---|---|
 Илустрација атома хелијума. Приказан је нуклеус (љубичасто) и дистрибуција електронског облака (црно). Нуклеус (горе десно) у хелијуму-4 је у реалности сферно симетричан и блиско је сличан електронском облаку, мада код компликованијих нуклеуса то није случај. Црна лиња представља један ангстрем (10−10 m или 100 pm). | |
| Класификација | |
| Најмања подела хемијског елемента | |
| Својства | |
| Масени опсег | 1,67×10−27 to 4,52×10−25 kg |
| Електрично наелектрисање | zero (neutral), or ion charge |
| Опсег дијаметра | 62 pm (He) до 520 pm (Cs) |
| Компоненте | Електрони и компактни нуклеус протона и неутрона |
Атом је најмања јединица материје која дефинише хемијске елементе.[1] Материја у чврстом, течном, гасовитом стању, или у облику плазме се састоји од неутралних или јонизованих атома. Атоми су веома мали: величина атома се мери у пикометрима — билионитим деловима (10−12) метра.[2] Сваки атом се састоји од језгра и једног или више електрона који круже око нуклеуса. Нуклеус се састоји од једног или више протона и типично сличног броја неутрона (водоник-1 нема неутрона). Протони и неутрони се називају нуклеонима. Преко 99,94% атомске масе је у језгру.[3] Протони имају позитивно електрично наелектрисање, електрони имају негативно електрично наелектрисање, а неутрони нису наелектрисани. Ако је број протона и електрона једнак, тај атом је електрично неутралан. Ако атом има вишак или мањак електрона у односу на протоне, онда он има свеукупно позитивно или негативно наелектрисање, и назива се јон.
Електроне атома привлаче протони атомског нуклеуса посредством електромагнетне силе. Протони и неутрони у нуклеусу се међусобно привлаче дејством различитих сила, нуклеарних сила, које су обично јаче од електромагнетне силе међусобног одбијања позитивно наелектрисаних протона. Под одређеним околностима одбијајућа електромагнетна сила постаје јача од нуклеарне силе, и нуклеони могу да буду избачени из језгра, остављајући иза себе различити елемент: нуклеарно распадање доводи до нуклеарне трансмутације.
Број протона у језгру дефинише којем хемијском елементу атом припада. На пример, сви атоми бакра садрже 29 протона. Број неутрона дефинише изотоп елемента.[4] Број електрона утиче на магнетна својства атома. Атоми се могу везати за један или више других атома путем хемијских веза чиме се формирају хемијска једињења као што су молекули. Способност атома да се асоцира и дисоцира је одговорна за већину физичких промена приметних у природи, и тема је науке хемије.
Нису све масе у свемиру састављене од атома. Тамна материја се састоји од не само материје, већ и од честица које су тренутно непознатог типа. Такође, класична Њутнова физика не објашњава многе од особина и понашања атома и субатомских честица: поље квантне механике је развијено ради тога.
Историја атомске теорије
[уреди | уреди извор]Прве идеје о атому су дали грчки филозоф Леукип и његов ученик Демокрит у 5. и 4. веку пре нове ере, који су говорили да је свет грађен од бесконачног броја невидљивих и недељивих честица- атома (άτομος- недјељив).[5] Говорили су да су атоми вјечни и да се разликују по облику, тежини, тврдоћи и величини. Такође, тврдили су да се атоми крећу у празном простору, праволинијски - одозго према доле. Тежи се брже крећу, сустижу лакше, групишу и тако граде све ствари. Демокрит је тврдио да су права својства атома: облик, величина, тежина, покрет и тврдоћа. Секундарна својства су: боје, мириси и укуси.
Откриће електрона 1897. (Ј. Ј. Томпсон) показало је да се у атомима налазе још фундаменталније честице. 14 година касније, Рутхерфорд је открио да се већина масе атома налази у сићушном језгру (нуклеус) чији је радијус само 1/100000 у односу на цели атом. У међувремену, Макс Планк (1858—1947) поставио је теорију да се светлост састоји од фотона који су еквивалент честицама валног гибања.
У филозофији
[уреди | уреди извор]Основна идеја да се материја састоји од сићушних недељивих честица је стара идеја која се појавила у многим древним културама. Реч атом потиче од старогрчке речи atomos,[а] што значи „нерезиви“. Ова древна идеја била је заснована на филозофском расуђивању, а не на научном расуђивању. Савремена атомска теорија није заснована на овим старим концептима.[6][7] Почетком 19. века, научник Џон Далтон приметио је да се хемијски елементи комбинују једни са другима у виду дискретних јединица тежине, и одлучио је да користи реч „атом“ да се односи на ове јединице, јер је мислио да су то основне јединице материје.[8] Отприлике један век касније откривено је да Далтонови атоми заправо нису недељиви, али се термин задржао.
Далтонов закон вишеструких пропорција
[уреди | уреди извор]
Почетком 1800-их, енглески хемичар Џон Далтон је објединио експерименталне податке које су прикупили он и други научници и открио образац који је сада познат као „закон умножених масених односа”. Приметио је да се у хемијским једињењима која садрже одређени хемијски елемент садржај тог елемента разликовати по тежини у виду односа малих целих бројева. Овај образац је сугерисао да се сваки хемијски елемент комбинује са другим елементима по основној јединици тежине, а Далтон је одлучио да те јединице назове „атомима“.
На пример, постоје две врсте калајног оксида: један је сиви прах који садржи 88,1% калаја и 11,9% кисеоника, а други је бели прах који садржи 78,7% калаја и 21,3% кисеоника. Прилагођавајући ове цифре, у сивом праху има око 13,5 g кисеоника на сваких 100 g калаја, а у белом праху око 27 g кисеоника на сваких 100 g калаја. 13,5 и 27 чине однос 1:2. Далтон је закључио да у овим оксидима за сваки атом калаја постоје један или два атома кисеоника (SnO и SnO2).[9][10]
Далтон је такође анализирао оксиде гвожђа. Постоји једна врста оксида гвожђа који је црни прах који садржи 78,1% гвожђа и 21,9% кисеоника; а постоји још један оксид гвожђа који је црвени прах који садржи 70,4% гвожђа и 29,6% кисеоника. Прилагођавајући ове бројке, у црном праху има око 28 g кисеоника на сваких 100 g гвожђа, а у црвеном праху око 42 g кисеоника на сваких 100 g гвожђа. 28 и 42 чине однос 2:3. Далтон је закључио да у овим оксидима, на свака два атома гвожђа, постоје два, односно три атома кисеоника (Fe2O2 и Fe2O3).[б][11][12]
Као финални пример: азот-субоксид је 63,3% азота и 36,7% кисеоника, азот-моноксид је 44,05% азота и 55,95% кисеоника, а азот диоксид је 29,5% азота и 70,5% кисеоника. Прилагођавајући ове бројке, у азот-субоксиду је 80 g кисеоника на сваких 140 g азота, у азот-оксиду је око 160 g кисеоника на сваких 140 g азота, а у азот-диоксиду је 320 g кисеоника на сваких 140 g азота. 80, 160 и 320 чине однос 1:2:4. Одговарајуће формуле за ове оксиде су N2O, NO, и NO2.[13][14]
Изомеризам
[уреди | уреди извор]Научници су открили да неке супстанце имају потпуно исти хемијски садржај, али различита својства. На пример, 1827. године, Фридрих Велер је открио да сребро фулминат и сребро цијанат чине 107 делова сребра, 12 делова угљеника, 14 делова азота и 12 делова кисеоника (сада је познато да је њихова формула AgCNO). Године 1830, Јонс Јакоб Берцелијус је увео термин изомеризам да би описао овај феномен. Године 1860, Луј Пастер је претпоставио да молекули изомера могу имати исти скуп атома, али у различитим распоредима.[15]
Године 1874, Јакобус Хенрикус ван'т Хоф је предложио да се атом угљеника вежује за друге атоме у тетраедарском распореду. Радећи на бази овога, објаснио је структуре органских молекула на такав начин да је могао да предвиди колико изомера може имати једињење. Размотрите, на пример, пентан (C5H12). У ван'т Хофовом начину моделовања молекула, постоје три могуће конфигурације за пентан, и научници су открили три и само три изомера пентана.[16][17]
Периодни систем
[уреди | уреди извор]Године 1870, Дмитриј Мендељејев је приметио да када се распореде елементи у низу према њиховој атомској тежини, постоји одређена периодичност њихових својстава.[18] На пример, други елемент, литијум, имао је слична својства као и девети елемент, натријум, и шеснаести елемент, калијум - периода од седам. Исто тако, берилијум, магнезијум и калцијум су били слични и сви су били удаљени седам места једно од другог у Мендељејевој табели. Користећи ове обрасце, Мендељејев је предвидео постојање и својства нових елемената који су касније откривени у природи: скандијума, галијума и германијума.[19] Штавише, периодна табела може предвидети са колико атома других елемената се атом може повезати - на пример, атом угљеника и атом германијума се могу комбиновати са два атома кисеоника, и ови елементи су у истој групи. Мендељејев је открио да ови обрасци потврђују атомску теорију, јер је показано да се елементи могу категорисати према њиховој атомској тежини.
Откриће електрона
[уреди | уреди извор]Године 1897, Џ. Џ. Томсон је открио да катодни зраци нису електромагнетни таласи, већ су направљени од честица, јер се могу одбити електричним и магнетним пољима. Он је измерио да су ове честице 1800 пута лакше од водоника (најлакшег атома). Томсон је закључио да ове честице потичу од атома унутар катоде - биле су субатомске честице. Ове нове честице је назвао корпускулама, али су касније преименоване у електроне. Томсон је такође показао да су електрони идентични честицама које дају фотоелектрични и радиоактивни материјали.[20] Брзо је постало познато да су електрони честице које носе електричне струје у металним жицама.[21] Томсон је закључио да су ти електрони настали из самих атома катоде у његовим инструментима, што је значило да атоми нису недељиви као што је Далтон мислио.
Откриће језгра
[уреди | уреди извор]
Лево: Очекивани резултати: алфа честице пролазе кроз модел атома пудинга од шљиве са занемарљивим отклоном.
Десно: Уочени резултати: мали део честица је одбијен због концентрисаног позитивног наелектрисања језгра.
Џ. Џ. Томсон је сматрао да су негативно наелектрисани електрони распоређени по атому у мору позитивног наелектрисања које је распоређено по целој запремини атома.[22] Овај модел се понекад назива модел пудинга од шљива.
Ернест Радрфорд и његове колеге Ханс Гајгер и Ернест Марсден су посумњали у Томсонов модел након што су наишли на потешкоће када су покушали да направе инструмент за мерење односа наелектрисања и масе алфа честица (ово су позитивно наелектрисане честице које емитују одређене радиоактивне супстанце као што је радијум). Алфа честице бивају распршене ваздухом у комори за детекцију, због чега су мерења била непоуздана. Томсон се суочио са сличним проблемом у свом раду на катодним зрацима, који је решио стварањем скоро савршеног вакуума у својим инструментима. Радерфорд није мислио да ће наићи на исти проблем јер су алфа честице много теже од електрона. Према Томсоновом моделу атома, позитивно наелектрисање у атому није довољно концентрисано да произведе електрично поље довољно јако да одбије алфа честицу, а електрони су толико лагани да би их много теже алфа честице требало без напора да одгурну у страну. Ипак, дошло је до расејања, та су Радерфорд и његове колеге одлучили да пажљиво истраже ово расипање.[23]
Између 1908. и 1913. Радерфорд и његове колеге су извели низ експеримената у којима су бомбардовали танке металне фолије алфа честицама. Приметили су да се алфа честице одбијају под угловима већим од 90°. Да би ово објаснио, Радерфорд је предложио да позитивно наелектрисање атома није распоређено по запремини атома као што је Томсон веровао, већ је концентрисано у малом језгру у центру. Само тако интензивна концентрација наелектрисања могла би да произведе електрично поље довољно јако да одбије алфа честице као што је примећено.[23]
Откриће изотопа
[уреди | уреди извор]Док је експериментисао са производима радиоактивног распада 1913. године, радиохемичар Фредерик Соди је открио да изгледа да постоји више од једног типа атома на свакој позицији у периодном систему.[24] Ови атоми су имали иста својства, али различите атомске тежине. Термин изотоп је сковала Маргарет Тод као одговарајући назив за атоме различите тежине који припадају истом елементу. Џ. Џ. Томсон је створио технику за одвајање изотопа кроз свој рад на јонизованим гасовима, што је касније довело до открића стабилних изотопа.[25]
Боров модел
[уреди | уреди извор]
Године 1913, физичар Нилс Бор је предложио модел у којем се претпостављало да електрони атома круже око језгра, и да то могу да чине само у коначном скупу орбита, и да могу да скачу између ових орбита само у дискретним променама енергије које одговарају апсорпцији или радијацији фотона.[26] Ова квантизација је коришћена да се објасни зашто су орбите електрона стабилне (с обзиром да нормално, наелектрисања при убрзању, укључујући кружно кретање, губе кинетичку енергију која се емитује као електромагнетно зрачење, погледајте синхротронско зрачење) и зашто елементи апсорбују и емитују електромагнетно зрачење у дискретним спектрима.[27]
Касније исте године Хенри Мозли је пружио додатне експерименталне доказе у корист теорије Нилса Бора. Ови резултати су побољшали модел Ернста Радерфорда и Антонија ван ден Брука, који су предложили да атом у свом језгру садржи број позитивних нуклеарних наелектрисања који је једнак његовом (атомском) броју у периодној табели. До ових експеримената није се знало да је атомски број физичка и експериментална величина. Да је једнак атомском нуклеарном наелектрисању, остаје прихваћен атомски модел до данас.[28]
Хемијске везе између атома објаснио је Гилберт Њутн Луис 1916. године, као интеракције између њихових саставних електрона.[29] Како се знало да се хемијска својства елемената у великој мери понављају према периодном закону,[30] амерички хемичар Ирвинг Лангмир је 1919. године сугерисао да би се то могло објаснити ако су електрони у атому повезани или груписани на неки начин. Сматрало се да групе електрона заузимају скуп електронских омотача око језгра.[31]
Боров модел атома био је први комплетан физички модел атома. Он је описао укупну структуру атома, како се атоми везују једни за друге и предвидео спектралне линије водоника. Боров модел није био савршен и убрзо га је заменио тачнији Шредингеров модел, али је био довољан да уклони све преостале сумње да се материја састоји од атома. За хемичаре је идеја атома била корисно хеуристичко оруђе, али физичари су сумњали да се материја заиста састоји од атома, јер нико још није био развио потпуни физички модел атома.
Шредингеров модел
[уреди | уреди извор]Године 1925, Вернер Хајзенберг је објавио прву доследну математичку формулацију квантне механике (матрична механика).[тражи се извор] Годину дана раније, Луј де Брољ је предложио да се све честице понашају као таласи у одређеној мери,[32] а 1926. Ервин Шредингер је искористио ову идеју да развије Шредингерову једначину, математички модел атома који описује електроне као тродимензионалне таласне форме, а не тачке у простору.[33]
Последица коришћења таласних облика за описивање честица је да је математички немогуће истовремено добити прецизне вредности за положај и за импулс честице у датом тренутку. Ово је постало познато као принцип неизвесности, који је формулисао Вернер Хајзенберг 1927. године.[28] У овом концепту, за дату тачност у мерењу позиције може се добити само опсег вероватних вредности за импулс, и обрнуто.[34] Овај модел је био у стању да објасни посматрања понашања атома која претходни модели нису могли, као што су одређени структурни и спектрални обрасци атома већих од водоника. Дакле, планетарни модел атома је одбачен у корист оног који описује атомске орбиталне зоне око језгра где је највероватније да ће дати електрон бити примећен.[35][36]
Откриће неутрона
[уреди | уреди извор]Развој масеног спектрометра је омогућио да се маса атома мери са повећаном тачношћу. Овај уређај користи магнет за савијање путање снопа јона, а количина отклона је одређена односом масе атома и његовог наелектрисања. Хемичар Франсис Вилијам Астон користио је овај инструмент да покаже да изотопи имају различите масе. Атомска маса изотопа варирала је за целобројне умношке, што се назива правило целог броја.[37] Објашњење за ове различите изотопе чекало је откриће неутрона, ненаелектрисане честице са масом сличном протону, од стране физичара Џејмса Чедвика 1932. Изотопи су тада објашњени као елементи са истим бројем протона, али различитим бројем неутрона унутар језгра.[38]
Фисија, физика високих енергија и кондензована материја
[уреди | уреди извор]Године 1938, немачки хемичар Ото Хан, ученик Радерфорда, усмерио је неутроне на атоме уранијума очекујући да ће добити трансуранијумске елементе. Уместо тога, његови хемијски експерименти су показали баријум као производ.[39][40] Годину дана касније, Лиза Мајтнер и њен нећак Ото Фриш потврдили су да је Ханов резултат прва експериментална нуклеарна фисија.[41][42] Године 1944, Хан је добио Нобелову награду за хемију. Упркос Хановим напорима, доприноси Мајтнове и Фриша нису награђени.[43]
Током 1950-их, развој побољшаних акцелератора честица и детектора честица омогућио је научницима да проучавају утицаје атома који се крећу при високим енергијама.[44] Утврђено је да су неутрони и протони хадрони, или композити мањих честица званих кваркови. Развијен је стандардни модел физике честица који је до сада успешно објаснио својства језгра у смислу ових субатомских честица и сила које управљају њиховим интеракцијама.[45]
Структура
[уреди | уреди извор]Атом је стабилна електро-неутрална композиција језгра и електронског омотача.
Састоји се од језгра и електронског омотача. Језгро садржи позитивно наелектрисане протоне и ненаелектрисане неутроне, а електронски облак је изграђен од негативно наелектрисаних електрона. Електрони су распоређени у љускама односно орбиталама. Нису све орбитале једнако велике. У орбиталама ближим језгру стане мањи број електрона, а у оним даљим од језгра стане већи број електрона. Својство атома да попуни посљедњу (најудаљенију) орбиталу назива се афинитет према електрону.
Протони и неутрони имају подједнаку масу, те су око 2000 пута тежи од електрона чију масу занемарујемо, па због тога језгро чини 99,95%[46] масе атома. Маса електрона ме, маса протона мп и маса неутрона мн су фундаменталне константе, и могу се пронаћи у периодном систему елемената. Теже честице (протони и неутрони) лоцирани су у атомском језгру (нуклеусу), електрони заузимају много већу запремину око језгра (електронски облак).
Језгро је дефинисано:
- Атомским, протонским или редним бројем Z = број протона = број електрона, или Z = N(p) = N(e)
- Масеним или нуклеонским бројем A = број протона + број неутрона, или A = N(p) + N(n)
Субатомске честице
[уреди | уреди извор]Мада је реч атом оригинално означавала честице које се не могу поделити у мање честице, у модерној научној употреби атом се састоји од разних субатомских честица. Конституентне честице атома су електрон, протон и неутрон; сва три су фермиони. Атом водоника нема неутрона, док хидронски јон нема електрона.
Електрон је далеко најмање масивна честица међу овим честицама, 9,11×10−31 kg са негативним електричним наелектрисањем и величином која је сувише мала да би се могла измерити доступним техникама.[47] Он је најлакша честица. Под нормалним околностима, електрони су везани за позитивно наелектрисане једра путем привлачења супротно наелектрисаних набоја. Ако атом има више или мање електрона од свог атомског броја, онда он постаје респективно негативно или позитивно наелектрисан; наелектрисани атом се зове јон. Електрони су познати од касног 19-тог века, углавном захваљујући раду Томсона; погледајте историју субатомске физике за детаље.
Протони имају позитивно наелектрисање и масу која је 1.836 пута већа од електрона, 1,6726×10−27 kg. Број протона у атому се назива атомским бројем. Ернест Рутхерфорд (1919) је уочио да кад се азот бомбардује алфа-честицама долази до избацивања језгра водоника. До 1920. он је усвојио да је језгро водоника засебна честица унутар атома и дао му је име протон.
Неутрони немају електрично наелектрисање и имају слободну масу која је 1.839 пута већа од масе електрона,[48] ili 1,6929×10−27 kg, те су најтежа од три конституентне честице, мада њихова маса може да буде редукована дејством нуклеарне енергије везивања. Неутрони и протони (колективно познати као нуклеони) имају сличне димензије реда величине 2,5×10−15 m, мада 'површина' тих честица није јасно дефинисана.[49] Неутрон је открио енглески физичар Џејмс Чедвик 1932. године.
У физичком стандардном моделу, електрони су истинске елементарне честице без унутрашње структуре. Протони и неутрони су композитне честице које се састоје од елементарних честица званих кваркови. Постоји два типа кваркова у атомима, сваки од којих има фракционо електрично наелектрисање. Протони се састоје од два горња кварка (сваки са наелектрисањем од +2⁄3) и једног доњег кварка (са наелектрисањем од −1⁄3). Неутрони се састоје од једног горњег кварка и два доња кварка. Та разлика узрокује разлику у маси и наелектрисању између две честице.[50][51]
Кваркови се одржавају заједно дејством јаке интеракције (или јаке силе), која је посредована глуонима. Протони и неутрони се одржавају заједно у језгру дејством нуклеарне силе, која је остатак јаке силе који има донекле различите опсеге - својства (видите чланак о нуклеарној сили за додатне информације). Глуон је члан фамилије баждарних бозона, који су елементарне честице које посредују физичке силе.[50][51]
Нуклеус
[уреди | уреди извор]
Сви везани протони и неутрони у атому сачињавају сићушно атомско језгро, и колективно се називају нуклеонима. Радијус нуклеуса је приближно једнак 1,07 3√A fm, где је A тотални број нуклеона.[52] То је знатно мање од пречника атома, који је реда величине 105 fm. Нуклеони су везани заједно атрактивним потенцијалом кратког распона званим резидуална јака сила. На растојањима мањим од 2,5 fm та сила је далеко јача од електростатичке силе која узрокује међусобно одбијање позитивно наелектрисаних протона.[53]
Атоми истог елемента имају исти број протона, који се назива атомским бројем. Унутар једног елемента, број неутрона може да варира, одређујући изотопе тог елемента. Тотални број протона и неутрона одређује нуклид. Број неутрона релативно на број протона одређује стабилност језгра. Поједини изотопи подлежу радиоактивном распаду.[54]
Протон, електрон, и неутрон се класификују као фермиони. Фермиони подлежу Паулијевом принципу искључења који налаже да идентични фермиони, као што су вишеструки протони, не могу да имају исто квантно стање у исто време. Стога сваки протон у нуклеусу мора да има квантно стање које је различито од свих других протона, а исто правило важи и за све неутроне у нуклеусу и све електроне у електронском облаку. Међутим, протон и неутрон могу да имају исто квантно стање.[55]
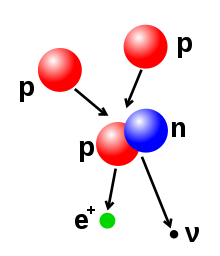
Код атома са ниским атомским бројевима, нуклеус који има више неутрона него протона има тенденцију заузимања нижег енергетског стања путем радиоактивног распада тако да се однос неутрона и протона приближава јединици. Са повећањем атомског броја већи удео неутрона је неопходан да би се умањило међусобно одбијање протона. Стога се не јављају стабилна језгра са једнаким бројем протона и неутрона изнад атомског броја Z = 20 (калцијум) и са повећањем атомског броја однос неутрона и протона стабилних изотопа се повећава.[55] Стабилни изотоп са највишим односом протона и неутрона је олово-208 (око 1,5).
Број протона и неутрона у атомском језгру се може променити, мада су за то потребне велике енергије због дејстава јаке силе. Нуклеарна фузија се одвија кад се вишеструке атомске честице споје и формирају теже језгро, на пример путем енергетске колизије два нуклеуса. У језгру Сунца протонима су потребне енергије од 3–10 KeV да би се превазишло њихово природно одбијање — Кулонова баријера — и да би се спојили у заједничко језгро.[56] Нуклеарна фисија је супротни процес, који узрокује цепање језгра у два мања језгра — обично путем радиоактивног распада. Језгра се исто тако могу модификовати путем бомбардовања субатомским честицама високе енергије или фотонима. Ако се тиме промени број протона у језгру, атом прелази у различити хемијски елемент.[57][58]
Ако је маса језгра након реакције фузије мања од суме маса засебних честица, онда разлика између тих вредности може да буде емитована као вид употребљиве енергије (као што су гама зраци, или кинетичка енергија бета честица), у складу са Ајнштајновом формулом еквиваленције масе и енергије, E = mc2, где је м губитак масе, а ц је брзина светлости. Тај дефицит је део енергије везивања новог језгра, и представља неповратни губитак енергије који узрокује да спојена језгра остану заједно у стању коме је неопходна та енергију да би дошло до раздвајања.[59]
Фузија два језгра којом се формира веће језгро са мањим атомским бројевима од гвожђа и никла — тотал број нуклеона од око 60 — је обично егзотермни процес у коме се отпушта више енергије него што је потребно за спајање.[60] Тај процес отпуштања енергије чини нуклеарну фузију у звездама само одрживом реакцијом. За тежа језгра, енергија везивања по нуклеону у језгру почиње да опада. Консеквентно, фузиони процеси којима се формирају језгра са атомским бројем већим од око 26, и атомским масама већим од око 60, су ендотермни процеси. Та масивнија језгра не подлежу фузији при којој се отпушта енергија тако да се може одржати хидростатичка равнотежа звезде.[55]
Електронски облак
[уреди | уреди извор]

Електроне у атому привлаче протони у језгру дејством електромагнетске силе. Та сила везује електроне унутар електростатичке јаме потенцијала која окружује мало језгро, што значи да је спољашњи извор енергије неопходан да би се одвојили електрони. Што је електрон ближе језгру, то је већа сила привлачења. Отуда је електронима везаним у близини центра јаме потенцијала потребно више енергије да се одвоје од оних на већим растојањима.
Електрони, попут других честица, имају двојна својства честица и таласа. Електронски облак је регион унутар јаме потенцијала, при чему сваки електрон формира тип тродимензионог стајаћег таласа — форме таласа који се не покреће релативно на језгро. Такво понашање се дефинише као атомска орбитала, математичка функција која описује вероватноћу да ће електрон боравити на датој локацији кад се његова позиција мери.[61] Једино дискретни (или квантизовани) сет тих орбитала постоји око језгра, пошто други могући таласни патерни брзо прелазе у стабилнију форму.[62] Орбитале могу да имају један или више прстенова или чворних структура, и оне се међусобно разликују по величини, облику и оријентацији.[63]
Свака атомска орбитала одговара специфичном енергетском нивоу електрона. Електрон може да промени своје стање до вишег енергетског нивоа путем апсорбовања фотона са довољном енергијом да омогући прелаз у ново квантно стање. Слично томе, путем спонтане емисије, електрон у вишем енергетском стању може да се спусти на ниже енергетско стање уз емитовање сувишне енергије у облику фотона. Те карактеристичне енергетске вредности, дефинисане разликама енергија квантних стања, су одговорне за атомске спектралне линије.[62]
Количина енергија која је неопходна за уклањање или додавање електрона — електронска енергија везивања — је далеко мања од енергије везивања нуклеона. На пример, неопходно је само 13,6 eV да би се одвојио електрон у стационарном стању из атома водоника,[64] у поређењу са 2,23 милиона eV за цепање језгра деутеријума.[65] Атоми су електрично неутрални, ако имају једнак број протона и електрона. Атоми који имају било дефицит или суфицит електрона се називају јонима. Електрони који су најудаљенији од језгра се могу пренети на оближње атоме или их атоми могу делити. Путем тог механизма, атоми се могу везати у молекуле и друге типове хемијских једињења, као што су јонске и ковалентне мреже кристала.[66]
Модели атома
[уреди | уреди извор]- 1. Први модел атома приписује се Демокриту. Пошто у то доба није било никаквих сазнања о структури атома (нису постојали електронски микроскопи), атоми су замишљани као јако мале недељиве куглице.
- 2. „Пудинг“-модел - кад је откривен електрон, формирана је теорија да су у средишту атома електрони, а свуда около је позитиван набој. То је метафора на суво грожђе у пудингу (грожђе је мало док је посуда пудинга велика).
- 3. Боров модел је установљен после Рутерфордових експеримената којима је утврђено да је у центру атома мало позитивно наелектрисано језгро (нуклеус), а електрони круже у орбиталама око језгра попут планета које круже око Сунца. Да би тај модел био прихваћен, било је неопходно да се реши следећи проблем: пошто је језгро позитивно наелектрисано, а електрон негативно, зашто електрон уопште кружи око језгра, и зашто се не споји с језгром.
- 1. Електрони постоје у орбиталама које поседују дискретне (квантизоване) енергије. То значи да не постоји континуирани могући размак између језгра и орбитале, него су могући само неки размаци. Ти размаци и њима одговарајуће енергије зависе од конкретног атома који разматрамо.
- 2. Закони класичне механике не вреде при преласку електрона из једне орбитале у другу.
- 3. Кад електрон пређе из једне орбитале у другу енергетска разлика се ослобађа (или добија) у виду кванта светлости (који називамо фотон) чија фреквенција директно зависи од енергетске разлике између две орбите.
- где је f фреквенција фотона, E енергетска разлика, а h је константа позната као Планкова константа. Ако дефинирамо да је можемо писати
- где је ω угаона фреквенција фотона.
- 4. Дозвољене орбитале зависе од квантизованих (дискретних) вредности угаоног момента L према једначини:
- Где је n = 1,2,3,… и зовемо га квантни број угаоног момента.
- 4. Данашњи модел атома називамо квантно-механички модел, јер је с временом утврђено да Бохров модел не одговара баш најбоље експериментима, да електрони не круже баш по кружницама, него слике доступне помоћу електронских микроскопа приказују електронске облаке.
Етимологија
[уреди | уреди извор]Реч атом долази од старогрчке речи atomos - недељив. Име атом од старогрчких филозофа Леукипа и Демокрита преузели су научници почетком 19. века (Џон Далтон и други) верујући да постоје атоми хемијских елемената као најмањи дељиви елементи материје.[67]
Напомене
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Мишић, Милан, ур. (2005). Енциклопедија Британика. А-Б. Београд: Народна књига : Политика. стр. 80. ISBN 86-331-2075-5.
- ^ D. C. Ghosh & R. Biswas (2002). „Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii”. Int. J. Mol. Sci. 3 (2): 87—113. doi:10.3390/i3020087
 .
.
- ^ „Fatal Error”. Архивирано из оригинала 26. 3. 2017. г. Приступљено 25. 3. 2017.
- ^ Leigh, G. J., ур. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry – Recommendations 1990. Oxford: Blackwell Scientific Publications. стр. 35. ISBN 978-0-08-022369-8. „An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements.”
- ^ Логос 2017, стр. 219-220.
- ^ Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. стр. 31—33. ISBN 978-0-19-515040-7. Архивирано из оригинала 5. 2. 2021. г. Приступљено 25. 10. 2020.
- ^ Melsen (1952). From Atomos to Atom, pp. 18–19
- ^ Pullman (1998). The Atom in the History of Human Thought, p. 198: "Dalton reaffirmed that atoms are indivisible and indestructible and are the ultimate constituents of matter."
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 36
- ^ Melsen (1952). From Atomos to Atom, p. 137
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 28
- ^ Millington (1906). John Dalton, p. 113
- ^ Dalton (1808). A New System of Chemical Philosophy vol. 1, pp. 316–319
- ^ Holbrow et al. (2010). Modern Introductory Physics, pp. 65–66
- ^ Pullman (1998). The Atom in the History of Human Thought, p. 230
- ^ Melsen (1952). From Atomos to Atom, pp. 147–148
- ^ Henry Enfield Roscoe, Carl Schorlemmer (1895). A Treatise on Chemistry, Volume 3, Part 1, pp. 121–122
- ^ Scerri 2020, стр. 117
- ^ Scerri 2020, стр. 118
- ^ Thomson, J.J. (август 1901). „On bodies smaller than atoms”. The Popular Science Monthly: 323—335. Архивирано из оригинала 1. 12. 2016. г. Приступљено 21. 6. 2009.
- ^ "The Mechanism Of Conduction In Metals" Архивирано 25 октобар 2012 на сајту Wayback Machine, Think Quest.
- ^ Navarro (2012). A History of the Electron, p. 94
- ^ а б Heilbron (2003). Ernest Rutherford and the Explosion of Atoms, pp. 64–68
- ^ „Frederick Soddy, The Nobel Prize in Chemistry 1921”. Nobel Foundation. Архивирано из оригинала 9. 4. 2008. г. Приступљено 18. 1. 2008.
- ^ Thomson, Joseph John (1913). „Rays of positive electricity”. Proceedings of the Royal Society. 89 (607): 1—20. Bibcode:1913RSPSA..89....1T. doi:10.1098/rspa.1913.0057
 . Архивирано из оригинала 4. 11. 2016. г.
. Архивирано из оригинала 4. 11. 2016. г.
- ^ Stern, David P. (16. 5. 2005). „The Atomic Nucleus and Bohr's Early Model of the Atom”. NASA/Goddard Space Flight Center. Архивирано из оригинала 20. 8. 2007. г.
- ^ Bohr, Niels (11. 12. 1922). „Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture”. Nobel Foundation. Архивирано из оригинала 15. 4. 2008. г.
- ^ а б Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. стр. 228–230. ISBN 978-0-19-851971-3.
- ^ Lewis, Gilbert N. (1916). „The Atom and the Molecule”. Journal of the American Chemical Society. 38 (4): 762—786. S2CID 95865413. doi:10.1021/ja02261a002. Архивирано (PDF) из оригинала 25. 8. 2019. г.
- ^ Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. стр. 205–226. ISBN 978-0-19-530573-9.
- ^ Langmuir, Irving (1919). „The Arrangement of Electrons in Atoms and Molecules”. Journal of the American Chemical Society. 41 (6): 868—934. doi:10.1021/ja02227a002. Архивирано из оригинала 21. 6. 2019. г.
- ^ McEvoy, J. P.; Zarate, Oscar (2004). Introducing Quantum Theory. Totem Books. стр. 110–114. ISBN 978-1-84046-577-8.
- ^ Kozłowski, Miroslaw (2019). „The Schrödinger equation A History”.
- ^ Chad Orzel (16. 9. 2014). „What is the Heisenberg Uncertainty Principle?”. TED-Ed. Архивирано из оригинала 13. 9. 2015. г. — преко YouTube.
- ^ Brown, Kevin (2007). „The Hydrogen Atom”. MathPages. Архивирано из оригинала 5. 9. 2012. г.
- ^ Harrison, David M. (2000). „The Development of Quantum Mechanics”. University of Toronto. Архивирано из оригинала 25. 12. 2007. г.
- ^ Aston, Francis W. (1920). „The constitution of atmospheric neon”. Philosophical Magazine. 39 (6): 449—455. doi:10.1080/14786440408636058. Архивирано из оригинала 27. 4. 2021. г. Приступљено 25. 10. 2020.
- ^ Chadwick, James (12. 12. 1935). „Nobel Lecture: The Neutron and Its Properties”. Nobel Foundation. Архивирано из оригинала 12. 10. 2007. г.
- ^ Bowden, Mary Ellen (1997). „Otto Hahn, Lise Meitner, and Fritz Strassmann”. Chemical achievers : the human face of the chemical sciences. Philadelphia, PA: Chemical Heritage Foundation. стр. 76–80, 125. ISBN 978-0-941901-12-3.
- ^ „Otto Hahn, Lise Meitner, and Fritz Strassmann”. Science History Institute. јун 2016. Архивирано из оригинала 21. 3. 2018. г.
- ^ Meitner, Lise; Frisch, Otto Robert (1939). „Disintegration of uranium by neutrons: a new type of nuclear reaction”. Nature. 143 (3615): 239—240. Bibcode:1939Natur.143..239M. S2CID 4113262. doi:10.1038/143239a0.
- ^ Schroeder, M. „Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages” (на језику: немачки). Архивирано из оригинала 19. 7. 2011. г. Приступљено 4. 6. 2009.
- ^ Crawford, E.; Sime, Ruth Lewin; Walker, Mark (1997). „A Nobel tale of postwar injustice”. Physics Today. 50 (9): 26—32. Bibcode:1997PhT....50i..26C. doi:10.1063/1.881933.
- ^ Kullander, Sven (28. 8. 2001). „Accelerators and Nobel Laureates”. Nobel Foundation. Архивирано из оригинала 13. 4. 2008. г.
- ^ „The Nobel Prize in Physics 1990”. Nobel Foundation. 17. 10. 1990. Архивирано из оригинала 14. 5. 2008. г.
- ^ Grlić, Ljubiša (1992). Mali kemijski leksikon. Zagreb: Naprijed. стр. 25. ISBN 978-86-349-0292-1.
- ^ Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st изд.). Springer. стр. 39—42. ISBN 978-3-540-20631-6. OCLC 181435713.
- ^ Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. стр. 8. ISBN 978-0-521-57507-2. OCLC 224032426.
- ^ MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. стр. 33—37. ISBN 978-0-19-521833-6. OCLC 223372888.
- ^ а б Group, Particle Data (2002). „The Particle Adventure”. Lawrence Berkeley Laboratory. Архивирано из оригинала 4. 1. 2007. г. Приступљено 3. 1. 2007.
- ^ а б Schombert, James (18. 4. 2006). „Elementary Particles”. University of Oregon. Архивирано из оригинала 30. 08. 2011. г. Приступљено 3. 1. 2007.
- ^ Jevremovic 2005, стр. 63.
- ^ Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. стр. 330—336. ISBN 978-1-86094-250-1. OCLC 45900880.
- ^ Wenner, Jennifer M. (10. 10. 2007). „How Does Radioactive Decay Work?”. Carleton College. Приступљено 9. 1. 2008.
- ^ а б в Raymond, David (7. 4. 2006). „Nuclear Binding Energies”. New Mexico Tech. Архивирано из оригинала 11. 12. 2006. г. Приступљено 3. 1. 2007.
- ^ Mihos, Chris (23. 7. 2002). „Overcoming the Coulomb Barrier”. Case Western Reserve University. Приступљено 13. 2. 2008.
- ^ Staff (30. 3. 2007). „ABC's of Nuclear Science”. Lawrence Berkeley National Laboratory. Архивирано из оригинала 5. 12. 2006. г. Приступљено 3. 1. 2007.
- ^ Makhijani, Arjun; Saleska, Scott (2. 3. 2001). „Basics of Nuclear Physics and Fission”. Institute for Energy and Environmental Research. Архивирано из оригинала 16. 1. 2007. г. Приступљено 3. 1. 2007.
- ^ Shultis & Faw 2002, стр. 10–17.
- ^ Fewell, M. P. (1995). „The atomic nuclide with the highest mean binding energy”. American Journal of Physics. 63 (7): 653—658. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ^ Mulliken, Robert S. (1967). „Spectroscopy, Molecular Orbitals, and Chemical Bonding”. Science. 157 (3784): 13—24. Bibcode:1967Sci...157...13M. PMID 5338306. doi:10.1126/science.157.3784.13.
- ^ а б Brucat, Philip J. (2008). „The Quantum Atom”. University of Florida. Архивирано из оригинала 7. 12. 2006. г. Приступљено 4. 1. 2007.
- ^ Manthey, David (2001). „Atomic Orbitals”. Orbital Central. Архивирано из оригинала 10. 1. 2008. г. Приступљено 21. 1. 2008.
- ^ Herter, Terry (2006). „Lecture 8: The Hydrogen Atom”. Cornell University. Приступљено 14. 2. 2008.
- ^ Bell, R. E.; Elliott, L. G. (1950). „Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron”. Physical Review. 79 (2): 282—285. Bibcode:1950PhRv...79..282B. doi:10.1103/PhysRev.79.282.
- ^ Smirnov 2003, стр. 249-272
- ^ Логос 2017, стр. 226-227.
Литература
[уреди | уреди извор]- Мишић, Милан, ур. (2005). Енциклопедија Британика. А-Б. Београд: Народна књига : Политика. стр. 80. ISBN 86-331-2075-5.
- Leigh, G. J., ур. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry – Recommendations 1990. Oxford: Blackwell Scientific Publications. стр. 35. ISBN 978-0-08-022369-8.
- Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. стр. 249-272. ISBN 978-0-387-95550-6.
- Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. стр. 63. ISBN 978-0-387-23284-3. OCLC 228384008.
- MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. стр. 33—37. ISBN 978-0-19-521833-6. OCLC 223372888.
- Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. стр. 10—17. ISBN 978-0-8247-0834-4. OCLC 123346507.
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st изд.). Springer. стр. 39—42. ISBN 978-3-540-20631-6. OCLC 181435713.
- Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. стр. 330—336. ISBN 978-1-86094-250-1. OCLC 45900880.
- Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. стр. 8. ISBN 978-0-521-57507-2. OCLC 224032426.
- С. Мацура, Ј. Радић-Перић, Атомистика, Факултет за физичку хемију Универзитета у Београду/Службени лист, Београд, 2004.
- L'Annunziata Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. ISBN 978-0-12-436603-9. OCLC 16212955.
- Beyer, H. F.; Shevelko, V. P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. ISBN 978-0-7503-0481-8. OCLC 47150433.
- Choppin Gregory R.; Liljenzin Jan-Olov; Jan, Rydberg (2001). Radiochemistry and Nuclear Chemistry. Elsevier. ISBN 978-0-7506-7463-8. OCLC 162592180.
- Dalton, J. (1808). A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell.
- Richard, Feynman (1995). Six Easy Pieces. The Penguin Group. ISBN 978-0-14-027666-4. OCLC 40499574.
- Wolfgang, Demtröder (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st изд.). Springer. ISBN 978-3-540-20631-6. OCLC 181435713.
- Fowles Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. ISBN 978-0-486-65957-2. OCLC 18834711.
- Mrinalkanti, Gangopadhyaya (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 978-0-391-02177-8. OCLC 10916778.
- Goodstein David L. (2002). States of Matter. Courier Dover Publications. ISBN 978-0-13-843557-8.
- Pablo, Iannone A. (2001). Dictionary of World Philosophy. Routledge. ISBN 978-0-415-17995-9. OCLC 44541769.
- Robert, Harrison Edward (2003). Masks of the Universe: Changing Ideas on the Nature of the Cosmos. Cambridge University Press. ISBN 978-0-521-77351-5. OCLC 50441595.
- James, Lequeux (2005). The Interstellar Medium. Springer. ISBN 978-3-540-21326-0. OCLC 133157789.
- Richard, King (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. Edinburgh University Press. ISBN 978-0-7486-0954-3.
- Tatjana, Jevremovic (2005). Nuclear Principles in Engineering. Springer. ISBN 978-0-387-23284-3. OCLC 228384008.
- Levere Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. The Johns Hopkins University Press. ISBN 978-0-8018-6610-4.
- LiangZ.-P.; Haacke, E. M. (1999). Webster, J. G., ур. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging (PDF). vol. 2. John Wiley & Sons. стр. 412—26. ISBN 978-0-471-13946-1. doi:10.1109/SSBI.2002.1233976. Приступљено 9. 1. 2008.
- Thomas, McEvilley (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. Allworth Press. ISBN 978-1-58115-203-6.
- MacGregor Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. ISBN 978-0-19-521833-6. OCLC 223372888.
- Oliver, Manuel (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 978-0-306-46562-8. OCLC 228374906.
- Mazo Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. ISBN 978-0-19-851567-8. OCLC 48753074.
- Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (2nd изд.). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. ISBN 978-0-632-03583-0. OCLC 27011505.
- Moran Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. Harvard University Press. ISBN 978-0-674-01495-4.
- Richard, Myers (2003). The Basics of Chemistry. Greenwood Press. ISBN 978-0-313-31664-7. OCLC 50164580.
- Padilla Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey USA: Prentice-Hall, Inc. ISBN 978-0-13-054091-1. OCLC 47925884.
- Abraham, Pais (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. ISBN 978-0198519713.
- Linus, Pauling (1960). The Nature of the Chemical Bond. Cornell University Press. ISBN 978-0-8014-0333-0. OCLC 17518275.
- Pfeffer Jeremy I.; Shlomo, Nir (2000). Modern Physics: An Introductory Text. Imperial College Press. ISBN 978-1-86094-250-1. OCLC 45900880.
- Enfield, Roscoe Henry (1895). John Dalton and the Rise of Modern Chemistry. Century science series. New York: Macmillan. Приступљено 3. 4. 2011.
- Kenneth, Shultis J., Faw Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. ISBN 978-0-8247-0834-4. OCLC 123346507.
- Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. CRC Press. ISBN 978-0-7503-0251-7. OCLC 26853108.
- Robert, Siegfried (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 978-0-87169-924-4. OCLC 186607849.
- Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. ISBN 978-0-19-530573-9.
- Sills Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. ISBN 978-0-7641-2146-3. OCLC 51543743.
- Smirnov Boris M. (2003). Physics of Atoms and Ions. Springer. ISBN 978-0-387-95550-6.
- Dick, Teresi (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. стр. 213—214. ISBN 978-0-7432-4379-7.
- Various (2002). Lide, David R., ур. Handbook of Chemistry & Physics (88th изд.). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. Архивирано из оригинала 24. 07. 2017. г. Приступљено 23. 5. 2008.
- Adolphe, Wurtz Charles (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 978-0-559-43636-9.
- Graham, Woan (2000). The Cambridge Handbook of Physics. Cambridge University Press. ISBN 978-0-521-57507-2. OCLC 224032426.
- Marco, Zaider; Rossi Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. ISBN 978-0-306-46403-4. OCLC 44110319.
- Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (5th изд.). Houghton Mifflin. ISBN 978-0-618-34342-3. OCLC 173081482. Архивирано из оригинала 04. 03. 2008. г. Приступљено 5. 2. 2008.
- Логос, Александар А. (2017). Путовање мисли : увод у потрагу за истином. Београд.
Спољашње везе
[уреди | уреди извор]- Web courseware Povijest fizike
- "Quantum Mechanics and the Structure of Atoms" на сајту YouTube
- Freudenrich, Craig C. „How Atoms Work”. How Stuff Works. Архивирано из оригинала 8. 1. 2007. г. Приступљено 9. 1. 2007.
- „The Atom”. Free High School Science Texts: Physics. Wikibooks. Приступљено 10. 7. 2010.
- Anonymous (2007). „The atom”. Science aid+. Архивирано из оригинала 22. 01. 2010. г. Приступљено 10. 7. 2010.—a guide to the atom for teens.
- Anonymous (3. 1. 2006). „Atoms and Atomic Structure”. BBC. Архивирано из оригинала 2. 1. 2007. г. Приступљено 11. 1. 2007.
- Various (3. 1. 2006). „Physics 2000, Table of Contents”. University of Colorado. Архивирано из оригинала 14. 1. 2008. г. Приступљено 11. 1. 2008.
- Various (3. 2. 2006). „What does an atom look like?”. University of Karlsruhe. Архивирано из оригинала 17. 04. 2010. г. Приступљено 12. 5. 2008.