Со




У хемији, со је општи термин који се користи за јонска једињења састављена од позитивно наелектрисаних катјона и негативно наелектрисаних анјона, тако да је производ неутралан и без наелектрисања.[1][2] Конститутивни јони се држе заједно електростатичким силама[3][4][5] које се називају јонске везе.[6][7][8] Ови јони могу бити неоргански (Cl-) као и органски (CH3-COO-), и једноатомски (F-) као и вишеатомски јони (SO42-).[9][10]
Појединачни јони унутар соли обично имају више блиских суседа, тако да се не сматрају делом молекула, већ делом непрекидне тродимензионалне мреже. Соли обично формирају кристалне структуре када су чврсте. Соли састављене од малих јона обично имају високе тачке топљења и кључања, и оне су тврде и ломљиве. Као чврсте материје, оне су скоро увек електрично изолујуће, али када се растопе или растворе постају високо проводљиви, јер јони постају покретни. Растопи и водени раствори соли се зову електролити. Неке соли имају велике катјоне, велике анјоне или обоје. По својим својствима, такве врсте су често сличније органским једињењима.
Цвитер јони су соли које садрже анјонски и катјонски центар у истом молекулу, као на пример амино киселине, многи метаболити, пептиди и протеини.[11][12]
Смеше више различитих јона у раствору као што је цитоплазма ћелије, у крви, урину, биљном соку и минералној води најчешће не стварају дефинисане соли после испаравања воде.
Историја открића
[уреди | уреди извор]
Године 1913, структуру натријум хлорида су одредили Вилијам Хенри Браг и Вилијам Лоренс Браг.[13][14][15] Ово је открило да постоји шест најближих суседа на једнакој удаљености за сваки атом, што показује да састојци нису распоређени у молекуле или коначне агрегате, већ као мрежа са кристалним редом дугог домета.[15] Такође је утврђено да многа друга неорганска једињења имају сличне структурне карактеристике.[15] Ова једињења су убрзо описана као састављена од јона, а не од неутралних атома, али доказ ове хипотезе није пронађен све до средине 1920-их, када су изведени експерименти рефлексије рендгенских зрака (који откривају густину електрона).[15][16]
Главни доприносиоци развоју теоријске обраде јонских кристалних структура били су Макс Борн, Фриц Хабер, Алфред Ланде, Ервин Маделунг, Пол Петер Евалд и Казимирз Фајанс.[17] Борн је предвидео кристалне енергије на основу претпоставке о јонским састојцима, што је показало добру кореспонденцију са термохемијским мерењима, што додатно поткрепљује претпоставку.[15]
Појављивање
[уреди | уреди извор]Учесталост
[уреди | уреди извор]Соли су најчешће чврсти кристали са релативно високом тачком топљења. Међутим, постоје соли које су течне на собној температури, такозване јонске течности. Неорганске соли обично имају малу тврдоћу и малу способност згушњавања, слично кухињској соли
Растворљивост
[уреди | уреди извор]Соли се могу добити на више начина, зависно од тога да ли су растворљиве или нерастворљиве у води. Растворљиве соли кристалишу из раствора соли (добијених на разне начине), а нерастворљиве соли се издвајају у облику талога.
Соли често имају добру растворљивост у води. Током растварања или процеса хидратације, молекули воде раздвајају јоне. Растворљиве соли су све алуминијумове, натријумове и калијумове соли, осим већине карбоната; сви хлориди, осим сребро-хлорида и олово-хлорида; сви нитрати; сви сулфати, осим баријум-сулфата, олово-сулфата, и калцијум-сулфата; и многи сулфиди метала.
Методе добијања растворљивих соли
[уреди | уреди извор]- 2NaOH(aq) + H2SO4(aq) → Na2SO4(aq) + 2H2O
- MgCO3(s) + 2HCl(aq) → MgCl2(aq) + H2O + CO2(g)
- Деловањем киселина на нерастворљиве базе (базне оксиде):
- CuO(s) + H2SO4(aq) → CuSO4(aq) + H2O
- Директна замена — реакција у којој се сви или неки од атома водоника у киселини замене атомима других елемената, обично метала. На овај начин добијају се растворљиве соли, осим соли натријума и калијума, јер они реагују превише бурно:
- Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
- Директна синтеза — хемијска реакција у којој со настаје директно из својих елемената. Овом методом добијају се соли које реагују са водом, па се не могу добити из раствора:
- Fe(s) + S(s) → FeS(s)
Боја
[уреди | уреди извор]Соли могу бити чисте и провидне (натријум-хлорид), непрозирне (титанијум-диоксид), па чак и металне и углачане (гвожђе-дисулфид).
Постоје соли у свим другим бојама, нпр. жута (натријум-хромат), наранџаста (натријум-дихромат), црвена (жива-сулфид), светлољубичаста (кобалт-дихлорид-хексахидрат), плава (гвожђе-сулфат, хексацијаноферат), зелена (никл-оксид), безбојна (магнезијум-сулфат), бела (титанијум-диоксид) и црна (манган-диоксид). Већина минерала и неорганских пигмената, као и већина синтетичких органских боја су соли.
Укус
[уреди | уреди извор]Различите соли показују свих пет основних укуса: слано (нпр. натријум-хлорид), слатко (олово-диацетат), кисело (калијум-битартарат), горко (магнезијум-сулфат) и љуто (мононатријум-глутамат).
Мирис
[уреди | уреди извор]Чисте соли су обично без мириса, док нечисте соли могу да миришу на киселину (нпр. ацетати као што је сирћетна киселина, цијаниди као што је цијановодонична киселина) или базу (нпр. амонијумове соли као што је амонијак).
Номенклатура
[уреди | уреди извор]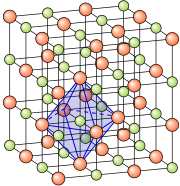
Назив соли почиње именом катјона (нпр. натријум или амонијум), кога прати име анјона (нпр. хлорид или ацетат). На соли се често односи само именом катјона (нпр. натријумове соли или амонијумове соли) или именом анјона (нпр. хлориди или ацетати).
Чести катјони који формирају соли су:
- амонијум NH4+
- калцијум Ca2+
- гвожђе Fe2+ и Fe3+
- магнезијум Mg2+
- калијум K+
- пиридинијум C5H5NH+
- кватернарни амонијум NR4+
- натријум Na+
Чести анјони који формирају соли (и називи одговарајућих киселина у загради) су:
- ацетат CH3-COO- (сирћетна киселина)
- карбонат CO32- (угљена киселина)
- хлорид Cl- (хлороводонична киселина)
- цитрат HO-C(COO-)(CH2-COO-)2 (лимунска киселина)
- цијанид C≡N- (цијановодонична киселина)
- хидроксид OH- (вода)
- нитрат NO3- (азотна киселина)
- нитрит NO2- (азотаста киселина)
- оксид O2- (вода)
- фосфат PO43- (фосфорна киселина)
- сулфат SO42- (сумпорна киселина)
Имена киселина и њихових соли
[уреди | уреди извор]| Киселине | Соли | ||
|---|---|---|---|
| Назив киселине | Хемијска формула | Заједнички назив | Пример |
| Хлороводонична | HCl | хлориди | NaCl натријум хлорид |
| CaCl2 калцијум хлорид | |||
| AlCl3 алуминијев хлорид | |||
| FeCl2 гвожђе(II) хлорид | |||
| Угљена | H2CO3 | карбонати | Na2CO3 натријев карбонат |
| CaCO3 калцијум карбонат | |||
| MgCO3 магнезијум карбонат | |||
| Сумпораста | H2SO3 | сулфити | Na2SO3 натријум сулфит |
| CaSO3 калцијум сулфит | |||
| ZnSO3 цинков сулфит | |||
| Сумпорна | H2SO4 | сулфати | Na2SO4 натријум сулфат |
| CaSO4 калцијум сулфат | |||
| ZnSO4 цинк сулфат | |||
| Азотна | HNO3 | нитрати | KNO3 калијум нитрат |
| NaNO3 натријум нитрат | |||
| Ca(NO3)2 калцијум нитрат | |||
| NH4NO3 амонијум нитрат | |||
| Фосфорна | H3PO4 | фосфати | Na3PO4 натријум фосфат |
| Ca3(PO4)2 калцијум фосфат | |||
Неорганске соли
[уреди | уреди извор]У најужем смислу, под појмом со мисли се на натријум-хлорид (NaCl, односно кухињска со). У много ширем смислу, соли су сви они спојеви, који су попут NaCl начињени од анјона и катјона. Као примјер таквих соли је калцијум-хлорид (CaCl2). Натријум-хлорид састављен је из катјона Na+ и анјона Cl−. Слично томе, калцијум-хлорид се изграђен из јона Ca2+ и Cl−. Формуле NaCl и CaCl2 су садржајне (сумарне) формуле једињења (однос Na:Cl=1:1, односно Ca:Cl=1:2). Јони могу бити једновалентни или поливалентни, тј. носити једно или више позитивних односно негативних наелектрисања. Сумарна формула неке соли одређена је бројем наелектрисања јона, јер се позитивна и негативна наелектрисања морају међусобно компензирати (поништити). Сумарне формуле соли су у јасној супротности с формулама једињења попут воде (H2O) или метана (CH4), који су молекуларна једињења.
Код неорганских соли између јона делују јонске везе. Следећи однос сумарне формуле, велики број јона гради јонску решетку одређене кристалне структуре. Прва слика десно приказује мали исечак грађе кристалне решетке натријум-хлорида. Пошто постоји велики број различитих катјона и анјона, познат је и веома велики број различитих соли. У доњој табели приказани су неки од јона. У солима, јони се могу састојати и из више од једног атома. Такви јони се називају комплексним јонима. Примери комплексних анјона су нитратни (NO3−) и сулфатни анјон (SO42−). Код таквих комплекса, један атом представља централни, за који су везани други атоми (и атомске групе), једним именом названи лиганди. У овим примерима, атоми N односно S су централни атоми, док су у оба случаја лиганди атоми кисеоника (оксокомплекси). Централни атоми и њихови лиганди су повезани један с другим ковалентном везом. јонске везе налазе се само између анјона и катјона. Међу нитратима познате соли су, на пример, натријум-нитрат (NaNO3), а међу сулфатима натријум-сулфат (Na2SO4).
Катјоне углавном граде метали, а њихове соли називају се соли метала ("металне соли"). Од неметала састоји се комплексни амонијум катјон амонијум (NH4+) са азотом као централним јоним и водоником као лигандом. Амонијум јони граде соли попут амонијум-сулфата ((NH4)2SO4). Поред амонијум једињења, постоје и њихова аналогна органска једињења (квартернерна амонијум једињења).
Код вишевалентних оксокомплекса могу се јавити и OH-групе као лиганди, као што је нпр. случај код соли натријум-хидрогенсулфата (NaHSO4). Аналоге соли су познате и међу фосфатима: поред натријум-фосфата постоје и соли динатријум-хидрогенфосфат и натријум-дихидрогенфосфат. Из уобичајеног формалног начина писања (формалних јединица) за ова једињења не могу се одмах препознати OH-групе као лиганди. Формалне јединице таквих соли се изводе из традиционалног начина писања за киселине попут сумпорне (H2SO4) и фосфатне киселине (H3PO4).

Прелазни метали не граде само катјоне, него и анјоне у виду оксокомплекса. Тако, на пример, хром може градити хромате ([CrO4]2−), који је анјон у калијум-хромату K2[CrO4]), а манган перманганате ([MnO4]−), који је анјон у калијум-перманганату (K[MnO4]).
Комплексни анјони могу имати и метале као централни атом. Код калијумхексацијаноферата(II) (K4[Fe(CN)6]), јон гвожђа Fe2+ гради стабилни анјон са четири негативна набоја заједно са шест цијанидних група (CN−). У солима, јонске везе се налазе између катјона калијума и анјона хексацијаноферата(II). Слично томе, јон гвожђа Fe3+ гради калијхексацијаноферат(III) (K3[Fe(CN)6]), такође једну комплексну со. Код K3[Fe(CN)6], јон гвожђа Fe3+ гради стабилни анјон са три негативна набоја заједно са шест цијанидних група (CN−).
Примери катјона и анјона
[уреди | уреди извор]
|
| |||||||||||||||||||||||||||||||||||||||
Особине соли
[уреди | уреди извор]
- Многе соли су на собној температури у чврстом стању са релативно високом тачком топљења. Нагризајуће соли су врло тврде и крте те имају глатке ивице при лому током механичке обраде. Ове особине су углавном типичне за чврсте супстанце, које су изграђене у виду јонске решетке те стога граде кристале. Међутим, свака кристална супстанце није уједно и со. Тако на пример шећер (сахароза) такође гради кристале, али нема јонску решетку и не убраја се у соли.
- Бројне соли су растворљиве у води а нису растворљиве у већини органских растварача. Код соли растворљивих у води, вода превазилази енергију јонске решетке помоћу хидратације. Ако је енергија хидратације приближно велика или већа од енергије решетке, со је релативно добро или врло добро растворљива. У растворима су појединачни јони врло чврсто и интензивно окружени молекулима воде. У виду реакције, ово се у хемији представља на следећи начин:
Слово (s) означава чврсту супстанцу док (aq) означава, да се јон налази у хидратизираном стању.
- Суви кристали соли су електрични изолатори. Растворене соли и водени раствори проводе електричну струју због својих слободно покретних јона као носилаца електричног набоја. Стога су они електролити.
- Растварање соли у води може променити pH вредност тог раствора. Ако се растварањем одређене соли не промени та вредност, онда се каже да је та со неутрална. Међу неутралне соли се убраја и натријум-хлорид. Осим ових, постоје и базне и киселе соли. Из састава соли врло тешко се може проценити како ће одређена со реаговати. Међутим, вреди опште правило: анјони (киселински остаци) јаких киселина углавном реагују неутрално. Киселински остаци слабих киселина углавном реагују базно. Пример особина соли, насталих од вишепротонских киселина, јесте понашање фосфата. Растварање соли у воденим растворима органских молекула, као нпр. биомолекула, може довести до денатурисања тих биомолекула, и имати утицаја на таложење макромолекула. Овакво деловање соли карактеризирано је такозваном Хофмејстеровом серијом.
Други катјони и анјони
[уреди | уреди извор]- Метални оксиди у великом постотку чине Земљину кору, али се они могу посматрати и као соли. Анјон O2− (оксидни јон) се јавља као такав само у чврстом или растопљеном стању, док у воденим растворима он није познат. Кисеоник у оксидном јону има оксидациони број −2. Стога, оксидациони број метала одређује сумарну формулу одређене соли односно једињења: MI2O, MIIO, MIII2O3. Ако је оксид растворљив у води, дешава се специфична хемијска реакција, на пример:
Натријум-оксид реагује с водом дајући хидроксидне јоне и соду (јоне натријума).
Слично реагује и калцијум-оксид (CaO), познат и као живи креч, дајући угашени креч односно калцијум-хидроксид (Ca(OH)2). Међутим, постоји велики број оксида који не реагују с водом. На пример, једињење гвожђе(III) оксид (Fe2O3) није растворљив у води.
- Сулфиди: минерали се у природи често могу наћи у облику сулфида (S2−), на пример пирит и халкозин. И сулфиди се могу сматрати солима. Натријум-сулфид (Na2S) је растворљива со, која је у води готово нерастворљива, слично као и већина сулфида попут цинк-сулфида (ZnS) и бакар(II) сулфида (CuS). У аналитичкој хемији се различита (слаба) растворљивост разних металних сулфида користи за раздвајање сличних хемијских елемената (у фази раздвајања сумпороводичне функционалне групе)
Кристална вода
[уреди | уреди извор]Многе соли, поред јона, садржавају и одређене количине молекула воде, такозвану кристалну воду.[18] Она се обично наводи у сумарној формули, као на пример у натријум-сулфат декахидрату: Na2SO4 · 10 H2O.
Двоструке соли
[уреди | уреди извор]Поред соли са само једном врстом катјона (M) познате су и соли са два различита катјона. Такве соли називају се двоструке соли, као што су соли са опћенитом сумарном формулом MIMIII(SO4)2. Пример такве соли је алуминијумкалијумсулфат-додекахидрат (KAl(SO4)2 · 12 H2O).
Обухват појма соли
[уреди | уреди извор]- Супстанце су соли, само ако су хемијске везе између њихових делова јонске. Да је заиста у неком једињењу присутна ова врста везе, није лако закључити. Док је код калцијум-оксида (CaO) присутна јонска веза, док хром(IV) оксида (CrO3) ради се о ковалентној вези између атома хрома и кисеоника, па ово једињење није со. У оваквим случајевима је због тога боље говорити о металним оксидима уместо соли.
- Историјски, соли су по правилу обухватале хемијска једињења, која имају дефинисани састав од различитих хемијских елемената. Међутим, познати су и мешани кристали састављени из две соли, а који нису стехиометријски грађени. Тако на пример калијум-перманганат (K[MnO4]) са баријум-сулфатом формира мешане кристале с готово произвољним односима смеше (чак и када се стави и одређена највећа количина баријум-сулфата), тако да компоненте у мешовитим кристалима и даље задржавају сличне кристалне структуре и удаљености унутар мреже. За добијање мешаних кристала није неопходна хемијска сличност укључених спојева нити њихова идентична валенција.
Органске соли
[уреди | уреди извор]Осим горе описаних неорганских соли, такође постоје и бројне соли органских једињења. Анјони ових соли настали су од органских киселина. Између осталих, једне од важнијих су соли карбоксилних киселина, као што је ацетатна киселина од које настају бројне соли, познате као ацетати (CH3COO−). Тако на пример ацетатна киселина са Na+ даје со натријум ацетат, док са Cu2+ гради бакар-ацетат. Сирћетна киселина је монокарбоксилна киселина (има само једну -COOH групу) па даје само једновалентне анјоне. Лимунска киселина (цитратна киселина) је трокарбоксилна киселина (има три -COOH групе) и може давати тровалентне анјоне; њене соли називају се цитрати. Међу познатијим солима цитратима су натријум цитрат и калцијум цитрат. Многи ацетати и цитрати граде кристале, али то није прави разлог за њихово уврштавање у соли. Прави разлог и основа лежи у постојању јонских веза између анјона и катјона. Унутар јона органских једињења налазе се ковалентне везе.
Практични значај имају соли карбоксилних киселина, које се убрајају у масне киселине. Натријумске и калијумске соли масних киселина називају се сапуни. У комерцијалним сапунима налази се мешавина различитих соли масних киселина. Практичан значај имају при производњи разних тврдих (натријумских) и меких (калцијумских) сапуна. Конкретни пример чине соли палмитинске киселине који се називају палмитати. Соли, који се базиране на тако великим органским молекулима, по правилу нису кристалисане.
Аналогно неорганским сулфатима (SO42−) постоје и органски сулфати (R-O-SO3−), попут натријум-лаурилсулфата, који су своју употребну вредност пронашли као тензиди у комерцијалним шампонима и геловима за туширање. Познати су и соли алкохола које се називају алкохолатима.[19] Алкохоли су изразито слабе киселине, али се готово никад не називају тако. Под агресивним реакционим условима могу се добити једињења облика R-O−M+ (где је M = метал). По аналогији са бројним неорганским оксидима (MO) алкохолати реагирају при контакту с водом (хидролиза) дајући одговарајуће алкохоле.
| Хидролиза оксидних соли | |
|---|---|
| Натријум-метанолат | |
| Натријум-оксид | |
Међу органским катјонима, једињења аналогна амонијум-катјонима (NH4+) имају велики значај. Она се називају квартернарним амонијачним једињењима. Код ових једињења, атом азота обично носи четири алкил групе (R-) и позитивно наелектрисање. Алкиламонијачно једињење цетилтриметиламонијумбромид, на пример, је органско једињење амонијака, код којег се атом брома налази као анјон. Практични значај имају једињења амонијака са три кратке и једном дугом алкил групом, јер такви катјони у воденим растворима показују особине тензида. Једињења ове врсте такође играју веома важну улогу у метаболизму живих бића, као што је нпр. холин.
У принципу, готово сваки органски амин путем примања једног протона (H+) може прећи у катјон. Слично као и реакција са амонијаком (NH3) који прелази у амонијачни јон (NH4+), реагује на пример и примарни амин (R-NH2; где је R = органски остатак) прелазећи у катјон R-NH3+. Пошто су таква једињења углавном поларна и стога лако растворљива у води, она су и почетне супстанце које преводе неке лекове на бази азота путем њиховог разлагања са хлороводичном киселином у соли, такозване хидрохлориде. Овај поступак олакшава њихову апсорпцију у организму. Насупрот амина, хидрохлориди се могу много лакше чистити помоћу прекристализације. Са бромоводиком амини граде хидробромиде, а са флуороводоником хидрофлуориде. Осим молекула, који могу носити неко позитивно или негативно наелектрисање, постоје такође и молекули, који поседују негативно и позитивно наелектрисање. Они се називају унутрашње соли или цвитерјони. Група једињења бетаина се убраја у такве соли, међу којима је најједноставније једињење бетаин.
Аминокиселине поседују једну карбоксилну (-COOH) и једно амино групу (-NH2) па због тога могу реаговати и кисело и базно. При унутрашњој неутрализацији стварају се анјонске (-COO−) и катјонске (-NH3+) односно један цвитерјон. Једна од најједноставнијих аминокиселина је глицин, који је врло добро растворљив у води. Насупрот других јона који су добро растворљиви у води, цвитерјони показују врло слабу (готово никакву) електричну проводљивост (амфолити).
Примери органских катјона и анјона
[уреди | уреди извор]| Анјони органских једињења | ||
|---|---|---|
| група једињења | пример | структура |
| Карбоксилне киселине | ацетати |  |
| палмитати |  | |
| цитрати |  | |
| органски сулфати | лаурилсулфати |  |
| алкохолати | етанолат | |
| Katјоni organskih једињења | ||
| група једињења | пример | структура |
| квартернарна амонијумска једињења |
Цетилтриметиламонијум |  |
| холин |  | |
| органска амонијумска једињења |
соли анилина, нпр. анилин-хидрохлорид |
 |
| Унутрашње соли: катјони и анјони у једном молекулу | ||
| група једињења | пример | структура |
| бетаини | бетаин |  |
| аминокиселине | аланин | 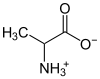 |
Добијање неорганских соли
[уреди | уреди извор]Реакције киселина и база
[уреди | уреди извор]Соли настају при реакцији киселина са базама (грч. basis; према Аренијусу: базе су основе ("базе") за соли). При томе се стварају оксонијум-јони киселина који са јонима хидроксида из база дају воду (неутрализирају се). Неке соли су врло тешко растворљиве у води те одмах при настанку стварају чврсти талог. Обично се соли налазе растворене у раствору те се кристализирају (прелазе у чврсто стање) испаравањем воде.
| киселина + база → со + вода |
|---|
хлороводична киселина + сода → натријум-хлорид + вода |
сумпорна киселина + баријум-хидроксид → баријум-сулфат + вода |
Из других соли
[уреди | уреди извор]Неке соли се могу добити из друге две соли. Ако се помешају водени раствори две соли, из раствора се може издвојити трећа со у чврстом облику. До тога долази само ако је трећа со, насупрот друге две, много теже растворљива.
| раствор соли А + раствор соли Б → со Ц + раствор соли Д |
|---|
натријум-хлорид + сребро нитрат → сребро-хлорид + натријум-нитрат |
калцијум-хлорид + натријум-карбонат → калцијум-карбонат + натријум-хлорид |
Реакције оксида
[уреди | уреди извор]Како је горе описано, многи оксиди метала имају афинитет да са водом граде хидроксиде. У киселим условима, такође реагују и многи оксиди метала, који су у чистој води нерастворљиви (стабилни). На овај начин могу се добити многе соли, као што је, на пример, бакар-сулфат.
| оксид метала + киселина → со + вода |
|---|
бакар(II) оксид + сумпорна киселина → бакар-сулфат + вода |
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ „IUPAC Compendium of Chemical Terminology (the “Gold Book”)”. doi:10.1351/goldbook.S05447. verzija: 2.2.
- ^ Hans-Dieter Jakubke, Ruth Karcher (izd.): Lexikon der Chemie. 2001. ISBN 978-3-8274-0552-4., 1. izd.; Spektrum Akademischer Verlag, Heidelberg .
- ^ Halliday, David; Resnick, Robert; Walker, Jearl (2013). Fundamentals of Physics. John Wiley & Sons. стр. 609, 611. ISBN 9781118230718.
- ^ Roller, Duane; Roller, D. H. D. (1954). The development of the concept of electric charge: Electricity from the Greeks to Coulomb
 . Cambridge, Massachusetts: Harvard University Press. стр. 79.
. Cambridge, Massachusetts: Harvard University Press. стр. 79.
- ^ Coulomb (1785). „Second mémoire sur l'électricité et le magnétisme” [Second dissertation on electricity and magnetism]. Histoire de l'Académie Royale des Sciences [History of the Royal Academy of Sciences] (на језику: француски). стр. 578—611. „Il résulte donc de ces trois essais, que l'action répulsive que les deux balles électrifées de la même nature d'électricité exercent l'une sur l'autre, suit la raison inverse du carré des distances.”
- ^ „Ionic bond”. IUPAC Compendium of Chemical Terminology. 2009. ISBN 978-0-9678550-9-7. doi:10.1351/goldbook.IT07058.
- ^ Seifert, Vanessa (27. 11. 2023). „Do bond classifications help or hinder chemistry?”. chemistryworld.com. Приступљено 22. 1. 2024.
- ^ Schneider, Hans-Jörg (2012). „Ionic Interactions in Supramolecular Complexes”. Ionic Interactions in Natural and Synthetic Macromolecules. стр. 35—47. ISBN 9781118165850. doi:10.1002/9781118165850.ch2.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ David L. Nelson; Michael M. Cox (2005). Principles of Biochemistry (IV изд.). New York: W. H. Freeman. ISBN 0-7167-4339-6.
- ^ Donald Voet; Judith G. Voet (2005). Biochemistry (3 изд.). Wiley. ISBN 9780471193500.
- ^ Bragg, W. H.; Bragg, W. L. (1. 7. 1913). „The Reflection of X-rays by Crystals”. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 88 (605): 428—438. Bibcode:1913RSPSA..88..428B. S2CID 13112732. doi:10.1098/rspa.1913.0040.
- ^ Bragg, W. H. (22. 9. 1913). „The Reflection of X-rays by Crystals. (II.)”. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 89 (610): 246—248. Bibcode:1913RSPSA..89..246B. doi:10.1098/rspa.1913.0082
 .
.
- ^ а б в г д Sherman, Jack (август 1932). „Crystal Energies of Ionic Compounds and Thermochemical Applications”. Chemical Reviews. 11 (1): 93—170. doi:10.1021/cr60038a002.
- ^ James, R. W.; Brindley, G. W. (1. 11. 1928). „A Quantitative Study of the Reflexion of X-Rays by Sylvine”. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 121 (787): 155—171. Bibcode:1928RSPSA.121..155J. doi:10.1098/rspa.1928.0188
 .
.
- ^ Pauling 1960, стр. 505.
- ^ water of crystallization, Архивирано на сајту Wayback Machine (31. мај 2016) Webster's NewWorld Dictionary. . John Wiley & Sons Inc. 1988.. Pristupljeno 28. april 2015.
- ^ Alkoholate, na stranici chemie.de, pristupljeno 29. aprila 2015. (језик: немачки)
Литература
[уреди | уреди извор]- Kurlansky, Mark (2002). Salt: A World History. Walker Publishing Company. ISBN 978-0-14-200161-5.
- Giričev G. V. (1999). Структура молекул солей кислородсодержащих кислот, Sorovskij obrazovateljnij žurnal, br. 11. стр. 40-44.
- Ivan Ljudvigovič Knunjanc; Nikolaj Serafimovič Zefirov (1995). Химическая энциклопедия. (4. tom), Pol - Tri, "Sovetskaja Ėnciklopedija". ISBN 978-5-85270-092-6.
- Wasserscheid P, Keim W (3. 11. 2000). „Ionic Liquids-New "Solutions" for Transition Metal Catalysis”. Angew Chem Int Ed Engl. 39 (21): 3772—3789. PMID 11091453. doi:10.1002/1521-3773(20001103)39:21<3772::AID-ANIE3772>3.0.CO;2-5.
- Лидин, А. Р..; Молочко, А. В..; Андреева, Л. Л..; Цветков, А. А. (1983). Под ред. Б. Д. Стёпина, ур. Основы номенклатуры неорганических веществ. М: Химия. стр. 112.
- Под ред. Н. С. Зефирова, ур. (1995). Химическая энциклопедия. 4. М: Большая российская энциклопедия. ISBN 978-5-85270-092-6.
- Ashcroft, Neil W.; Mermin, N. David (1977). Solid state physics (27th repr. изд.). New York: Holt, Rinehart and Winston. ISBN 978-0-03-083993-1.
- Atkins, Peter; de Paula, Julio (2006). Atkins' physical chemistry (8th изд.). Oxford: Oxford University Press. ISBN 978-0-19-870072-2.
- Barrow, Gordon M. (1988). Physical chemistry (5th изд.). New York: McGraw-Hill. ISBN 978-0-07-003905-6.
- Brown, Theodore L.; LeMay, H. Eugene Jr; Bursten, Bruce E.; Lanford, Steven; Sagatys, Dalius; Duffy, Neil (2009). Chemistry: the central science: a broad perspective (2nd изд.). Frenchs Forest, N.S.W.: Pearson Australia. ISBN 978-1-4425-1147-7.
- Freemantle, Michael (2009). An introduction to ionic liquids. Cambridge: Royal Society of Chemistry. ISBN 978-1-84755-161-0.
- International Union of Pure and Applied Chemistry, Division of Chemical Nomenclature (2005). Neil G. Connelly, ур. Nomenclature of inorganic chemistry: IUPAC recommendations 2005 (New изд.). Cambridge: RSC Publ. ISBN 978-0-85404-438-2. Архивирано из оригинала 2016-02-03. г. Приступљено 2023-02-05.
- Kittel, Charles (2005). Introduction to Solid State Physics (8th изд.). Hoboken, NJ: John Wiley & Sons. ISBN 978-0-471-41526-8.
- McQuarrie, Donald A.; Rock, Peter A. (1991). General chemistry (3rd изд.). New York: W.H. Freeman and Co. ISBN 978-0-7167-2169-7.
- Pauling, Linus (1960). The nature of the chemical bond and the structure of molecules and crystals: an introduction to modern structural chemistry
 (3rd изд.). Ithaca, N.Y.: Cornell University Press. ISBN 978-0-8014-0333-0.
(3rd изд.). Ithaca, N.Y.: Cornell University Press. ISBN 978-0-8014-0333-0. - Russell, Michael S. (2009). The chemistry of fireworks (2nd изд.). Cambridge, UK: RSC Pub. ISBN 978-0-85404-127-5.
- Wenk, Hans-Rudolph; Bulakh, Andrei (2004). Minerals: Their Constitution and Origin (1st изд.). New York: Cambridge University Press. ISBN 978-1-107-39390-5.
- Wold, Aaron; Dwight, Kirby (1993). Solid State Chemistry Synthesis, Structure, and Properties of Selected Oxides and Sulfides. Dordrecht: Springer Netherlands. ISBN 978-94-011-1476-9.
- Zumdahl, Steven S. (1989). Chemistry
 (2nd изд.). Lexington, Mass.: D.C. Heath. ISBN 978-0-669-16708-5.
(2nd изд.). Lexington, Mass.: D.C. Heath. ISBN 978-0-669-16708-5. - Zumdahl, Steven; Zumdahl, Susan (2015). Chemistry: An Atoms First Approach. Cengage Learning. ISBN 978-1-305-68804-9.
Спољашње везе
[уреди | уреди извор] Медији везани за чланак Со на Викимедијиној остави
Медији везани за чланак Со на Викимедијиној остави










