Askorbinska kiselina — разлика између измена
| Ред 117: | Ред 117: | ||
Askorbinska kiselina je kofaktor u oksidaciji [[tirozin]]a.<ref>{{cite web |url=http://www.jbc.org/content/196/2/761.full.pdf |title= }}</ref> |
Askorbinska kiselina je kofaktor u oksidaciji [[tirozin]]a.<ref>{{cite web |url=http://www.jbc.org/content/196/2/761.full.pdf |title= }}</ref> |
||
==Alternativna upotreba== |
|||
*Askorbinska kiselina se lako oksiduje, te se koristi kao reduktant u rastvorima za razvijanje fotografija (između ostalog) i kao [[prezervativ]]. |
|||
*U [[fluorescentni mikroskop|fluorescentnoj mikroskopiji]] i srodnim tehnikama zasnovanim na fluorescenciji, askorbinska kiselina se može koristiti koa [[antioksidans]] za uvećanje fluorescentnog signala i hemijsku retardaciju boje [[fotoizbeljavanje]].<ref>{{cite journal |author=Jerker Widengren, Andriy Chmyrov, Christian Eggeling, Per-Åke Löfdahl, and Claus A. M. Seidel |year=2007 |title=Strategies to Improve Photostabilities in Ultrasensitive Fluorescence Spectroscopy |journal=The Journal of Physical Chemistry A |volume=111 |issue=3 |pages=429–440 | doi=10.1021/jp0646325 | pmid=17228891 |postscript=. }}</ref> |
|||
*Ona se takođe koristi za uklanjanje metalnih mrlja, kao što je gvožđe sa površina fiberglas bazena za plivanje. |
|||
*Korisnici [[heroin]]a koriste askorbinsku kiselinu za rastvaranje heroina u vodi, da bi bio u obliku podesnom za unos injekcijom.<ref>{{cite journal |author=Beynon Caryl M, McVeigh Jim, Chandler Martin, Wareing Michelle, Bellis Mark A |title=The impact of citrate introduction at UK syringe exchange programmes: a retrospective cohort study in Cheshire and Merseyside, UK|journal=Harm Reduction Journal|date=1 January 2007 |volume=4 |issue=1 |pages=21 |doi=10.1186/1477-7517-4-21 |url=http://www.harmreductionjournal.com/content/4/1/21}}</ref> |
|||
==Reference== |
==Reference== |
||
Верзија на датум 10. фебруар 2012. у 09:18

| |

| |
| Nazivi | |
|---|---|
| IUPAC naziv
(5R)-[(1S)-1,2-dihidroksietil]-3,4-dihidroksifuran-2(5H)-on
| |
| Drugi nazivi
Vitamin C
| |
| Identifikacija | |
3D model (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| EC broj | 200-066-2 |
| E-brojevi | E300 (antioksidansi, ...) |
| KEGG[1] | |
| UNII | |
| |
| Svojstva | |
| C6H8O6 | |
| Molarna masa | 176,12 g·mol−1 |
| Agregatno stanje | Bela ili svetlo žuta čvrsta materija |
| Gustina | 1,65 g/cm3 |
| 33 g/100 mL | |
| Rastvorljivost u etanol | 2 g/100 mL |
| Rastvorljivost u glicerol | 1 g/100 mL |
| Rastvorljivost u propilen glikol | 5 g/100 mL |
| Rastvorljivost u [[{{{Solvent4}}}]] | nerastvorna u dietil etru, hloroformu, benzenu, petroleumskom etru, uljima, mastima |
| Kiselost (pKa) | 4.10 (prvi), 11.6 (drugi) |
| Opasnosti | |
| Letalna doza ili koncentracija (LD, LC): | |
LD50 (LD50)
|
11.9 g/kg (oralno, pacov)[4] |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Askorbinska kiselina je organsko jedinjenje koje se javlja u prirodi. Ona ima antioksidanske osobine. Ona je bela čvrsta materija. Uzorci koji sadrže nečistoće imaju svetlo žutu boju. Askorbinska kiselina se dobro rastvara u vodi, pri čemu formira blago kisele rastvore.
Askorbinska kiselina je jedan oblik vitamina C. Njeno ime je izvedeno iz a- (sa značenjem "ne") i scorbutus (skorbut), oboljenje izazvano nedostatkom vitamina C. Ona je derivat glukoze koji mnoge biljke i životinje proizvode, dok ljudi moraju da je unose putem ishrane. Drugi kičmenjaci koji nemaju sposobnost biosinteze askorbinske kiseline su primati, morsko prase, teleost ribe, slepi miševi, i ptice. Kod svih ovih vrsta askorbinska kiselina je dijetarni mikronutrijent (vitamin).[5]
Istorija
Od sredine 18-tog veka, bilo je poznato da limunov sok može da spreči pojavu skorbuta kod mornara. U početku se pretpostavljalo da do toga dolazi usled kiselosti, međutim uskoro je postalo jasno da druge prehrambene kiseline, na primer sirće, nemaju tu sposobnost. Dva norveška lekara su 1907. objavila pronalazak esencijalnog jedinjenja iz hrane koje sprečava bolest, i koje se razlikuje od jedinjenja koje sprečava beriberi. Oni is ispitivali bolesti dijetarnih deficijencija koristeći novi životinjski model na morskim prascima, koji su podložni skorbutu. Novo otkriveni prehrambeni faktor je vremenom nazvan vitamin C.
Mađarski istraživački tim predvođen Albert Sent Džerdžijem, kao i američki naučnik Čarls Glen King, su tokom 1928 do 1932 identifikovali antiskorbutski faktor kao specifičnu hemijsku supstancu. Na Majo klinici, Sent Derdži je izolovao heksuronsku kiselinu iz životinjske adrenalne žlezde. On je pretpostavljao da je to antiskorbutni faktor, ali nije mogao to da dokaže bez biološkoj testa. Taj test je konačno izveden na Univerzitetu Pitsburga u Kingovoj laboratoriji, koji je radio na tom problemu godinama, koristeći morske prasiće. Krajem 1931. Kingova laboratorija je dobila adrenalnu heksuronsku kiselinu indirektno od Sent Džerdžija i koristeći svoj životinjski model, dokazala da je to vitamin C početkom 1932.
Kasnije te godine, Sent Džerdžijeva grupa je otkrila da je paprika, uobičajeni začin u mađarskoj kuhinji, bogat izvor heksuronske kiseline. On je poslao uzorak ove sad daleko dostupnije hemikalije Volteru Normanu Hauortu, britanskom hemičaru specijalizovanom u šećerima.[6] Radeći sa tad asistentom direktora za istraživanja Edmundom Hirstom i njihovim istraživačkim timovima, Hauort je 1933 odredio korektnu strukturu i optički izomernu prirodu vitamina C i 1934 je objavio prvu sintezu vitamina.[7] Hauort i Sent Džerdži su predložili novo ime jedinjenja, „a-skorbinska kiselina“. Ime je postalo L-askorbinska kiselina kad su Hauort i Sent Džerdži dokazali strukturu putem njene sinteze.[8]
Nobelova nagrada za hemiju je dodeljena 1937. Normau Hauortu za njegov rad na određivanju strukture askorbinske kiseline (zajedno sa Polom Karerom, koji je dobio nagradu za rad na vitaminima), i nagrada za fiziologiju ili medicinu je te godine dodeljena Albertu Sent Džerdžiju ja njegove studije bioloških funkcija L-askorbinske kiseline. Američki lekar Fred R. Klener M.D. je promovisao vitamin C kao lek za mnoge bolesti tokom 1950-ih putem znatnog povećanja njegovog doziranja do desetina grama dnevno injekcijama. Nobelovac Lajnus Poling je takođe preporučivao visoke doze askorbinske kiseline (on je sam koristio 18 grama dnevno) kao preventinu meru protiv prehlade i kancera. Klenerovi rezultati su bili i ostali kontroverzni, pošto njegova ispitivanja ne zadovoljavaju moderne metodološke standarde.[9]
Reakcije
Struktura askorbinska kiselina podseća na šećer iz kog je izvedena. Njen prsten ima znatan broj funkcionalnih grupa koje sadrže kiseonik. Ovaj molekul se je u ravnoteži sa dva ketonska tautomera, koji su manje stabilni od enolne forme. U rastvorima, ovi oblici askorbinske kiseline se brzo pretvaraju jedan u drugi.

Antioksidansni mehanizam
Kao blag redukujući agens, askorbinska kiselina se razgrađuje pri izlaganju vazduhu, konvertujući kiseonik u vodu. Redoks reakciju ubrzava prisustvo metalnih jona i svetlost. Ona se može oksidovati elektronom do radikalnog stanja ili dvostruko oksidovati do stabilne forme pod imenom dehidroaskorbinska kiselina.
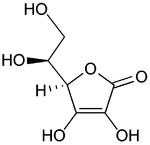
|
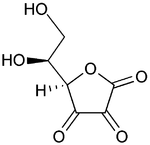
|
(redukovana forma vitamina C)
Dole: dehidroaskorbinska kiselina
(nominalno oksidovana forma vitamina C)
Askorbat obično deluje kao antioksidans. On tipično reaguje sa oksidansima reaktivnih vrsta kiseonika, kao što je hidroksil radikal koji se formira iz vodonik peroksida. Takvi radikali su štetni za životinje i biljke jer mogu da reaguju sa nukleinskim kiselinama, proteinima, i lipidima. Ponekad ti radikali iniciraju lančane reakcije. Askorbat može da prekine te lančane reakcije elektronskim transferom. Askorbinska kiselina je posebna po tome što može da prenese jedan elektron usled stabilnosti njenog radikalnog jona koji se naziva "semidehidroaskorbat", dehidroaskorbat. Neto reakcija je:
- RO• + C
6H
7O−
6 → ROH + C
6H
6O-•
6 .
Oksidovane forme askorbata su relativno nereaktivne, tako da ne uzrokuju ćelijsko oštećenje.
Međutim, pošto je ona dobar donor elektrona, višak askorbata u prisustvu slobodnih metalnih jona može ne samo da promoviše nego i da inicira reakcije slobodnih radikala. To je čini potencijalno opasnim pro-oksidativnim jedinjenjem u određenim metaboličkim kontekstima.
Kiselost
Askorbinska kiselina, redukton, se ponaša kao vinilogna karboksilna kiselina, kod koje elektroni dvostrukih veza, slobodni elektroni hidroksilnih grupa, i karbonilne dvostruke veze formiraju konjugovani sistem. Zato što dve glavne rezonantne strukture stabilizuju deprotonisanu konjugovanu bazu askorbinske kiseline, hidroksilna grupa askorbinske kiseline je znatno kiselija od tipičnih hidroksilnih grupa. Drugim rečima, askorbinska kiselina se može smatrati enolom kod koga je deprotonisani oblik stabilizovani enolat.

Prehrambena hemija
Askorbinska kiseline i njene natrijumske, kalijumske, i kalcijumske soli su u širokoj upotrebi kao antioksidansni prehrambeni aditivi. Ta jedinjenja su rastvorna u vodi te stoga ne mogu da zaštite masti od oksidacije. Za tu svrhu, u masnoći rastvorni estri askorbinske kiseline sa dugim lancima masnih kiselina (askorbil palmitat ili askorbil stearat) se mogu koristiti kao prehrambeni antioksidansi. Osamdeset procenata svetske ponude askorbinske kiseline se proizvodi u Kini.[10]
Relevantni evropski prehrambeni aditivi (E brojevi) su:
- E300 askorbinska kiselina (odobrena za upotrebu kao prehrambeni aditiv u Evropskoj Uniji,[11] SAD-u[12] i Australiji i Novom Zelandu)[13]
- E301 natrijum askorbat (odobren za upotrebu kao prehrambeni aditiv u Evropskoj Uniji,[11] SAD-u[14] i Australiji i Novom Zelandu)[13]
- E302 kalcijum askorbat (odobren za upotrebu kao prehrambeni aditiv u Evropskoj Uniji,[11] SAD-u[12] i Australiji i Novom Zelandu)[13]
- E303 kalijum askorbat
- E304 masno kiselinski estri askorbinske kiseline (i) askorbil palmitat (ii) askorbil stearat.
U proizvodnji plastike, askorbinska kiselina se može koristiti za ubrzavanje formiranja molekulskih lanaca i sa manje otpada nego tradicionalni sintetički metodi.[15]
Ona formira isparljiva jedinjenja kad se pomeša sa glukozom i aminokiselinama.[16]
Askorbinska kiselina je kofaktor u oksidaciji tirozina.[17]
Alternativna upotreba
- Askorbinska kiselina se lako oksiduje, te se koristi kao reduktant u rastvorima za razvijanje fotografija (između ostalog) i kao prezervativ.
- U fluorescentnoj mikroskopiji i srodnim tehnikama zasnovanim na fluorescenciji, askorbinska kiselina se može koristiti koa antioksidans za uvećanje fluorescentnog signala i hemijsku retardaciju boje fotoizbeljavanje.[18]
- Ona se takođe koristi za uklanjanje metalnih mrlja, kao što je gvožđe sa površina fiberglas bazena za plivanje.
- Korisnici heroina koriste askorbinsku kiselinu za rastvaranje heroina u vodi, da bi bio u obliku podesnom za unos injekcijom.[19]
Reference
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ „Safety (MSDS) data for ascorbic acid”. Oxford University. 2005-10-09. Приступљено 2007-02-21.
- ^ Lachapelle M. Y., Drouin G. (2010). „Inactivation dates of the human and guinea pig vitamin C genes”. Genetica. 139 (2): 199—207. PMID 21140195. doi:10.1007/s10709-010-9537-x.
- ^ „Story of Vitamin C's chemical discovery”. Приступљено 21. 1. 2010.
- ^ Davies Michael B, Austin John, Partridge David A (1991). Vitamin C: Its Chemistry and Biochemistry. The Royal Society of Chemistry. стр. 48. ISBN 0-85186-333-7.
- ^ Joseph Louis Svirbelf, Albert Szent-Györgyi (25. 4. 1932). The Chemical Nature Of Vitamin C (PDF)..Part of the National Library of Medicine collection. Accessed January 2007
- ^ The American physician Thomas E Levy, M.D. J.D. wrote a critical review about Klenner's work, Curing the Incurable, LiveOn Books 2002, 3rd edition 2009, ISBN 0-9779-5202-9.
- ^ Weiss, Rick (20. 5. 2007), „Tainted Chinese Imports Common”, Washington Post, Приступљено 2010-04-25.
- ^ а б в UK Food Standards Agency: „Current EU approved additives and their E Numbers”. Приступљено 2011-10-27.
- ^ а б US Food and Drug Administration: „Listing of Food Additives Status Part I”. Приступљено 2011-10-27.
- ^ а б в Australia New Zealand Food Standards Code„Standard 1.2.4 - Labelling of ingredients”. Приступљено 2011-10-27.
- ^ US Food and Drug Administration: „Listing of Food Additives Status Part II”. Приступљено 2011-10-27.
- ^ „Vitamin C, water have benefits for plastic manufacturing”. Reliable Plant Magazine. 2007. Архивирано из оригинала 2007-09-27. г. Приступљено 2007-06-25..
- ^ http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2621.1981.tb15349.x/abstract. Текст „title+ ” игнорисан (помоћ); Недостаје или је празан параметар
|title=(помоћ) - ^ (PDF) http://www.jbc.org/content/196/2/761.full.pdf. Недостаје или је празан параметар
|title=(помоћ) - ^ Jerker Widengren, Andriy Chmyrov, Christian Eggeling, Per-Åke Löfdahl, and Claus A. M. Seidel (2007). „Strategies to Improve Photostabilities in Ultrasensitive Fluorescence Spectroscopy”. The Journal of Physical Chemistry A. 111 (3): 429—440. PMID 17228891. doi:10.1021/jp0646325.
- ^ Beynon Caryl M, McVeigh Jim, Chandler Martin, Wareing Michelle, Bellis Mark A (1. 1. 2007). „The impact of citrate introduction at UK syringe exchange programmes: a retrospective cohort study in Cheshire and Merseyside, UK”. Harm Reduction Journal. 4 (1): 21. doi:10.1186/1477-7517-4-21.
Literatura
- Clayden; Greeves; Warren; Wothers (2001), Organic Chemistry, Oxford University Press, ISBN 0-19-850346-6.
- Davies, Michael B.; Austin, John; Partridge, David A., Vitamin C: Its Chemistry and Biochemistry, Royal Society of Chemistry, ISBN 0-85186-333-7.
- Coultate, T. P., Food: The Chemistry of Its Components (3rd изд.), Royal Society of Chemistry, ISBN 0-85404-513-9.
- Gruenwald, J.; Brendler, T.; Jaenicke, C., ур. (2004), PDR for Herbal Medicines (3rd изд.), Montvale, New Jersey: Thomson PDR.
- McMurry, John (2008), Organic Chemistry (7e изд.), Thomson Learning, ISBN 978-0-495-11628-8.
- British Pharmacopoeia Commission Secretariat. „Index, BP 2009” (PDF). Приступљено 4. 2. 2010.</ref>
- „Japanese Pharmacopoeia, Fifteenth Edition” (PDF). Приступљено 4 Februally 2010. Проверите вредност парамет(а)ра за датум:
|access-date=(помоћ)
Vidi još
- Agens zadržanja boje
- Eritorbna kiselina: dijastereoizomer askorbinske kiseline.
- Mineralni askorbati: soli askorbinske kiseline
- D-eritroaskorbinska kiselina: kvasac ne formira vitamin C (L-askorbinsku kiselinu) nego ovaj slični antioksidans
- Kiseline u vinu
Spoljašnje veze
- Internacionalna karta hemijske bezbednosti 0379
- SIDS Иницијални извештај о процени for L-Ascorbic acid Организације за економску сарадњу и развој (OECD)
- Monograf o otrovnosti
- Interaktivna 3D-struktura vitamina C
- D-eritroaskorbinska kiselina
