Alkohol


U hemiji, alkohol je organsko jedinjenje u kome je hidroksilna funkcionalna grupa (-O H) vezana za zasićeni atom ugljenika.[2][3] Opšta formula alkohola je R-O H, dakle hidroksilna grupa O H, vezana na alkan tj. lanac ugljovodonici. Sličnu strukturu imaju karboksilne kiseline koje se dobijaju oksidacijom alkohola. Hidroksilna grupa (funkciona grupa) se sastoji od jednog atoma vodonika i jednog atoma kiseonika, prema tome je jednovalentna. Zato i lanac na koji se grupa vezuje mora da bude jednovalentan. Tako će npr. sažeta strukturna formula etanola da bude CH3-CH2-OH. Termin alkohol se prvobitno odnosio na primarni alkohol etil alkohol (etanol), koji je preovlađujući alkohol u alkoholnim pićima.
Sufiks -ol se javlja u IUPAC hemijskim imenima[4] svih supstanci u kojima je hidroksilna grupa funkcionalna grupa sa najvišim prioritetom; u supstancama gde je prisutna grupa višeg prioriteta koristi se prefiks hidroksi- u IUPAC imenima. Sufiks -ol u nesistematskim imenima (kao što je paracetamol[5][6] ili holesterol[7]) takođe tipično ukazuje na prisustvo hidroksilne grupe u supstanci, i one se stoga mogu nazvati alkoholima. Međutim mnoge supstance, posebno šećeri (na primer glukoza[8] i saharoza[9]) sadrže hidroksilne funkcionalne grupe, a sufiks se ne koristi. Jedna važna klasa alkohola, čiji najjednostavniji članovi su metanol i etanol, su alkoholi sa zasićenim nerazgranatim lancom. Njihova opšta formula je CnH2n+1OH.
Podela alkohola[uredi | uredi izvor]
- Prema broju OH grupa
- Monohidroksilni (1 OH grupa)
- Dvohidroksilni (2 OH grupe)
- Polihidroksilni (3 ili više OH grupa)
- Prema načinu vezivanja ugljenikovih atoma
- Alifatične R-OH alkil grupa
- Aromatični AR-CN2OH aril grupa
- Prema položaju alkil grupe
- Primarni CH3-CH2-OH (10)
- Sekundarni CH3-CH-CH3 (20)
- Tercijarni
Osobine[uredi | uredi izvor]
U homolognom nizu primarnih alkohola niži su članovi (prva četiri) tečnosti, srednji (do 11 ugljikovih atoma), uljaste tečnosti, a viši su čvrste materije.
Niži alkoholi se mešaju se s vodom, viši se u vodi uopšte ne rastvaraju. S kiselinama daju estre, s alkalijskim rastvorima alkokside, a oksidacijom prelaze u aldehide, ketone i organske kiseline. Alkoholi koji u svojoj strukturi imaju veći broj C atoma su nerastvorni u vodi jer imaju duži deo molekulske nepolarne građe.
Alkoholi imaju vrlo sličnu strukturu kao voda. Tačka ključanja etanola i vode je viša nego što odgovara njihovoj relativnoj molekulskoj masi.
Neutralne tečnosti, mogu reagovati s alkalnim metalima, natrijumom ili kalijumom. U toj reakciji nastaju alkosidi. Reakcija alkohola s halogenovodičnom kiselinom nastaju alkil-halogenidi.
Alkoholi se s obzirom na položaj OH grupe dele na primarne, sekundarne i tercijarne alkohole. Primarni alkoholi su alkoholi čija je -OH grupa vezana za primarni atom ugljenika, tj. onaj koji je u strukturi vezan sa samo jednim drugim atomom ugljenika. Oksidacijom primarnih alkohola dobijaju se aldehidi, a oksidacijom sekundarnih alkohola nastaju ketoni.
Najpoznatiji alkohol koji se koristi u medicini i piću je obični alkohol. Hemijska reakcija za dobijanje etanola je alkoholno vrenje (fermentacija). To je prirodni proces kojim se šećer uz pomoć delovanja kvaščevih gljivica (enzima koji deluju kao katalizatori) pretvara u etanol i CO2.
Nomenklatura alkohola[uredi | uredi izvor]
Alkoholi se imenuju tako da se uz ime alkana doda nastavak -ol. Tako će npr. alkohol s tri ugljenikova atoma da bude propanol, jer se uz ime alkana propana dodao ol od alkohola.
Ukoliko neki alkohol ima dve ili više hidroksilnih grupa, onda se ispred nastavka 'ol' dodaje di, tri itd. Npr. propandiol, propantriol.
Napomena: U situacijama kada alkohol ima veći broj ugljenikovih atoma, mora se napomenuti na kom se ugljenikovom atomu nalazi hidroksilna grupa. Npr. 2-butanol, 3-pentanol itd.

Sistematska imena[uredi | uredi izvor]
IUPAC nomenklatura se koristi u naučnim publikacijama i kad god je precizna identifikacija supstance važna, posebno u slučajevima gde relativna kompleksnost molekula ne čini takva sistematska imena nepraktičnim. U IUPAC sistemu, pri imenovanju jednostavnih alkohola se na ime alkanskog lanca dodaje „ol“, npr., kao kod imena „metanol“ i „etanol“.[10] Kad je to neophodno, pozicija hidroksilne grupe se obeležava brojem između imena alkana i „ol“: propan-1-ol za CH3CH2CH2OH, propan-2-ol za CH3CH(OH)CH3. Ako je prisutna grupa višeg prioriteta (kao što je aldehidna, ketonska, ili karboksilna), koristi se prefiks „hidroksi“,[10] npr., kao u 1-hidroksi-2-propanon (CH3C(O)CH2OH).[11]
Nesistematska imena[uredi | uredi izvor]
U drugim manje formalnim kontekstima, alkohol se obično naziva imenom koje korespondira alkil grupi čemu sledi reč „alcohol“, npr., metil alkohol, etil alkohol. Propil alkohol može da bude n-propil alkohol ili izopropil alkohol, u zavisnosti od toga da li je hidroksilna grupa vezana na kraju ili u sredini linijskog propanskog lanca. Kao što je to opisano u sekciji o sistematskim imenima, ako druga grupa u molekulu ima prioritet, alkoholna grupa se obično označava prefiksom „hidroksi“-.
| Hemijska formula | IUPAC ime | Nesistemsko ime |
|---|---|---|
| Monohidroksilni alkoholi | ||
| CH3OH | Metanol | Drvni alkohol |
| C2H5OH | Etanol | Alkohol |
| C3H7OH | Izopropil alkohol | Dezinfekcioni alkohol |
| C4H9OH | Butil alkohol | Butanol |
| C5H11OH | Pentanol | Amil alkohol |
| C16H33OH | Heksadekan-1-ol | Cetil alkohol |
| Polihidroksilni alkoholi | ||
| C2H4(OH)2 | Etan-1,2-diol | Etilen glikol |
| C3H6(OH)2 | Propan-1,2-diol | Propilen glikol |
| C3H5(OH)3 | Propan-1,2,3-triol | Glicerol |
| C4H6(OH)4 | Butan-1,2,3,4-etraol | Eritritol, Treitol |
| C5H7(OH)5 | Pentan-1,2,3,4,5-pentol | Ksilitol |
| C6H8(OH)6 | Heksan-1,2,3,4,5,6-heksol | Manitol, Sorbitol |
| C7H9(OH)7 | Heptan-1,2,3,4,5,6,7-heptol | Volemitol |
| Nezasičeni alifatični alkoholi | ||
| C3H5OH | Prop-2-en-1-ol | Alil alkohol |
| C10H17OH | 3,7-Dimetilokta-2,6-dien-1-ol | Geraniol |
| C3H3OH | Prop-2-in-1-ol | Propargil alkohol |
| Aliciklični alkoholi | ||
| C6H6(OH)6 | Cikloheksan-1,2,3,4,5,6-heksol | Inozitol |
| C10H19OH | 2 - (2-propil)-5-metil-cikloheksan-1-ol | Mentol |
Alkoholi se grupišu u primarne, sekundarne (sec-, s-), i tercijarne (tert-, t-), po broju atoma ugljenika vezanih za atom ugljenika koji nosi hidroksilnu funkcionalnu grupu. (Odgovarajuće numeričke skraćenice 1°, 2°, i 3° se takođe koriste u neformalnim situacijama.[12]) Primarni alkoholi imaju opšte formule RCH2OH; metanol (CH3OH je najjednostavniji primarni alkohol (R=H), i nakon njega dolazi etanol (R=CH3). Sekundarni alkoholi se mogu skraćeno opisati formulom RR'CHOH; 2-propanol je najjednostavniji primer (R=R'=CH3). Tercijarni alkoholi se mogu opisati skraćenicom RR'R"COH; terc-butanol (2-metilpropan-2-ol) je najjednostavniji primer (R=R'=R"=CH3). U tim skraćenim zapisima, R, R', i R" predstavljaju supstituente, alkilne ili druge vezane, generalno organske grupe.
Varijacije alkil lanca u alkoholima[uredi | uredi izvor]
Kratkolančani alkoholi imaju alkil lance sa 1-3 ugljenika. Alkoholi srednjih dužina lanca imaju alkil grupe sa 4-7 ugljenika. Dugolančani alkoholi (takođe poznati kao masni alkoholi) imaju alkil lance sa 8-21 ugljenika, i alkoholi sa veoma dugim lancima imaju alkil grupe sa 22 ili više ugljenika.[13]
Jednostavni alkoholi[uredi | uredi izvor]
Termin "jednostavni alkoholi" nema jednoznačnu definiciju. Imena jednostavnih alkohola se obično formiraju dodavanjem reči „alkohol“ na ime odgovarajuće alkil grupe. Na primer, lanac koji sadrži jedan ugljenik (metil grupu, CH3) sa OH grupom vezanom za ugljenik se naziva „metil alkohol“, dok se lanac sa dva uljenika (etil grupom, CH2CH3) sa OH grupom vezanom za CH2 naziva „etil alkohol“. Za kompleksnije alkohole je neophodno koristiti IUPAC nomenklaturu.[14]
Jednostavni alkoholi, a posebno etanol i metanol, poseduju denaturaciona i dezinfekciona svojstva, te se koriste kao anti-mikrobni agensi u medicini, farmaciji, i industriji.
Viši alkoholi[uredi | uredi izvor]
Enciklopedija Britannica iznosi, „Viši alkoholi - oni koji sadrže 4 do 10 atoma ugljenika – su umereno viskozni, ili uljasti, i imaju voćne mirise. Neki od visoko razgranatih alkohola i mnogi alkoholi koji sadrže više od 12 atoma ugljenika su čvrste materije na sobnoj temperaturi.“[15]
Poput etanola, butanol se može proizvesti putem procesa fermentacije. Poznato je da kvasac Saccharomyces proizvodi više alkohole na temperaturama iznad 24 °C. Bakterija Clostridium acetobutylicum može da se hrani celulozom i da proizvodi butanol u industrijskim razmerama.
Vino i fermentacija[uredi | uredi izvor]

Vinogradarstvo je grana poljoprivrede koja postoji od davnina, a kultura proizvodnje vina održala se vekovima. Proces proizvodnje vina je sledeći: Ubrano grožđe iz vinograda se prvo gazi tako da se iscedi sok a docnije se ljuska deli od tečnosti (Ljuska može da se iskoristi za pravljenje rakije ili sl.). Tečnost - "mošt" (koja je većim postotkom šećer) se ostavlja u buradi gde na određenoj temperaturi uz dejstvovanje kvaščevih gljivica fermentuje (događa se alkoholno vrenje ili fermentacija). Tako se šećer pretvara u alkohol i tečnost postaje vino. Napomena: Nekoliko sedmica pre procesa traje period karence. U tom se periodu grožđe ne sme da se prska otrovima jer bi na taj način dospeli u vino.
Produkcija[uredi | uredi izvor]
Ciglerov i okso procesi[uredi | uredi izvor]
U Ciglerovom procesu, linearni alkoholi se proizvode iz etilena i trietilaluminijuma, čemu slede oksidacija i hidroliza.[16] Idealizovana sinteza 1-oktanola je:
- Al(C2H5)3 + 9 °Csub>2H4 → Al(C8H17)3
- Al(C8H17)3 + 3 O + 3 H2O → 3 HOC8H17 + Al(OH)3
Proces generiše opseg alkohola koji se razdvajaju destilacijom.
Mnogi viši alkoholi se proizvode putem hidroformilacije alkena, čemu sledi hidrogenacija. Kad se proces primeni na terminalne alkene, kao što je to najčešće slučaj, tipično se dobija linearni alkohol:[16]
- RCH=CH2 + H2 + CO → RCH2CH2CHO
- RCH2CH2CHO + 3 H2 → RCH2CH2CH2OH
Takvi procesi proizvode masne alkohole, koji su korisni pri formiranju deterdženata.
Hidracione reakcije[uredi | uredi izvor]
Industrijski važni alkoholi niske molekulske težine se proizvode adicijom vode u alkene. Etanol, izopropanol, 2-butanol, i tert-butanol se proizvode ovom opštom metodom. Koriste se dva pristupa: direktni i indirektni metodi. Direktni metod izbegava formiranje stabilnih intermedijera, tipično koristeći kisele katalizatore. U indirektnom metodu, alken se konvertuje do sulfatnog estra, koji se subsekventno hidrolizuje. Direktna hidracija koristi etilen (etilenska hidracija)[17] ili druge alkene iz frakcija krekovanja destilovane sirove nafte.
Hidracija se takođe industrijski koristi u produkciji diola etilen glikola iz etilen oksida.
Biološki pristupi[uredi | uredi izvor]
Etanol se dobija fermentacijom glukoze proizvedene hidrolizom skroba, u prisustvu kvasca na temperaturi ispod 37 °C. Na primer, takav proces se može odvijati putem konverzije saharoze enzimom invertaza do glukoze i fruktoze, i zatim konverzijom glukoze enzimom zimaza do etanola (i ugljen-dioksida).
Nekoliko benignih tipova bakterija u interstinalnom traktu koristi fermentaciju kao oblik anaerobnog metabolizma. Ova metabolička reakcija proizvodi etanol kao nusproizvod, kao što i aerobna respiracija proizvodi ugljen-dioksid i vodu. Stoga, ljudska tela sadrže izvesnu količinu alkohola koji endogeno proizvode ove bakterije. U retkim slučajevima, to može da bude dovoljno da uzrokuje "sindrom auto-vrenja" usled koga se proizvode intoksinirajuće količine alkohola.[18][19][20]
Laboratorijska sinteza[uredi | uredi izvor]
Postoji nekoliko metoda za laboratorijsku pripremu alkohola.
Supstitucija[uredi | uredi izvor]
Primarni alkil halidi reaguju sa vodenim rastvorom NaOH ili KOH uglavnom kao primarni alkoholi u nukleofilnoj alifatičnoj supstituciji. (Sekundarni i posebno tercijarni alkil halidi umesto toga proizvode eliminacione (alkenske) produkte). Grinjarovi reagensi reaguju sa karbonil grupama do sekundarnih i tercijarnih alkohola. Srodne reakcije su Barbijerova reakcija i Nozaki-Hijamina reakcija.
Redukcija[uredi | uredi izvor]
Aldehidi ili ketoni se redukuju sa natrijum borohidridom ili litijum aluminijum hidridom (nakon kiselinske pripreme). Redukcija se može obaviti aluminijumizopropilatima u Meerwein-Ponndorf-Verley redukciji. Nojorijeva asimetrična hidrogenacija je asimetrična redukcija β-keto-estera.
Hidroliza[uredi | uredi izvor]
Alkeni učestvuju u kiselinom katalizovanoj reakciji hidratacije koristeći koncentrovanu sumpornu kiselinu kao katalizator, koja obično daje sekundarne ili tercijarne alkohole. Hidroboracija-oksidacija i oksimerkuracija-redukcija alkena su pouzdaniji procesi organske sinteze. Alkeni reaguju sa NBS i vodom u reakciji formiranja halohidrina. Amini se mogu konvertovati do diazonijum soli, koje se zatim hidrolizuju.
Formiranje sekundarnog alkohola putem redukcije i hidracije:
Reakcije[uredi | uredi izvor]
Deprotonacija[uredi | uredi izvor]
Alkoholi se mogu ponašati kao slabe kiseline, pri čemu podležu deprotonaciji. Reakcija deprotonacije kojom se proizvode alkoksidne soli se izvodi bilo sa jakom bazom, kao što je natrijum hidrat ili n-butillitijum, ili sa metalom natrijum ili kalijum.
- 2 R-OH + 2 Na → 2 R-O−Na+ + H2
- 2 CH3CH2-OH + 2 Na → 2 CH3-CH2-O−Na+ + H2↑
Voda ima sličnu pKa vrednost sa mnogim alkoholima, tako da se sa natrijum hidroksidom ostvaruje ravnoteža, koja je obično pomerena nalevo:
- R-OH + NaOH ⇌ R-O−Na+ + H2O
Potrebno je napomenuti da su baze koje se koriste za deprotonaciju alkohola jake. Te baze i formirani alkoksidi su veoma senzitivni na vlagu.
Na kiselost alkohola takođe utiče sveukupna stabilnost alkoksidnog jona. Elektron-odvlačeće grupe vezane za ugljenik koji sadrži hidroksilnu grupu stabilizuju formirani alkoksid, što dovodi do povećane kiselosti. S druge strane, prisustvo elektron-donirajuće grupe dovodi do formiranja manje stabilnog alkoksidnog jona. To će rezultirati u scenariju gde formirani nestabilni alkoksidni jon teži da primi proton i da se pretvori u originalni alkohol.
Sa alkil halidima alkoksidi formiraju etre putem Vilijamsonove etarske sinteze.
Nukleofilna supstitucija[uredi | uredi izvor]
OH grupa nije dobra odlazeća grupa u reakcijama nukleofilne supstitucije, tako da neutralni alkoholi ne reaguju u takvim reakcijama. Međutim, ako se kiseonik prvo protonira i formira R−OH2+, odlazeća grupa (voda) je daleko stabilnija, i nukleofilna supstitucija se može odvijati. Na primer, tercijarni alkoholi reaguju sa hlorovodoničnom kiselinom i proizvode tercijarne alkil halide, pri čemu se hidroksilna grupa zamenjuje atomom hlora putem unimolekularne nukleofilne supstitucije. Da bi primarni i sekundarni alkoholi reagovali sa hlorovodoničnom kiselinom, potreban je aktivator kao što je cink hlorid. Alternativno, konverzija se može izvršiti direktno koristeći tionil hlorid.[21][22][23]
Slično tome, alkoholi se mogu konvertovati u alkil bromide koristeći bromovodoničnu kiselinu ili fosfor tribromid, na primer:
- 3 R-OH + PBr3 → 3 RBr + H3PO3
U Barton-Makombijevoj deoksigenaciji alkohol se deoksigeniše do alkana sa tributilkalaj hidridom ili kompleksom trimetilboran-vode u reakciji supstitucije radikala.
Dehidracija[uredi | uredi izvor]
Sami alkoholi su nukleofilni, tako da R−OH2+ može da reaguje ROH i da proizvede etre i vodu u reakciji dehidracije, mada se ta reakcija retko koristi izuzev u proizvodnji dietil etra.
Korisnija je E1 eliminaciona reakcija alkohola kojom se proizvode alkeni. Reakcija generalno podleže Zajcevljevom pravilu, po kome se najstabilniji (obično u najvećoj meri supstituisani) alken formira. Tercijarni alkoholi lako vrše eliminaciju na temperaturama neposredno iznad sobne, dok su primarnim alkoholima neophodne više temperature.
Ovo je dijagram kiselinom katalizovane dehidracije etanola kojom se proizvodi eten:
Bolje kontrolisana reakcija eliminacije je Čugajeva eliminacija sa ugljen disulfidom i jodometanom.
Esterifikacija[uredi | uredi izvor]
Estar se formira iz alkohola i karboksilne kiseline primenom Fišerove esterifikacije. Ona se obično izvodi putem refluksiranja sa koncentrovanom sumpornom kiselinom kao katalizatorom:
- R-OH + R'-COOH → R'-COOR + H2O
Da bi se ravnoteža pomerila nadesno i proizveli dobri prinosi estra, voda se obično uklanja, bilo putem viška H2SO4 ili koristeći Dean-Starkov aparat. Estri se takođe mogu pripremiti reakcijom alkohola sa kiselim hloridima u prisustvu baze kao što je piridin.
Drugi tipovi estara se pripremaju na sličan način – na primer, tozil (tozilatni) estri se formiraju reakcijom alkohola sa p-toluensulfonil hloridom u piridinu.
Oksidacija[uredi | uredi izvor]
Primarni alkoholi (R-CH2-OH) se mogu oksidovati bilo do aldehida (R-CHO) ili do karboksilnih kiselina (R-CO2H), dok se oksidacija sekundarnih alkohola (R1R2CH-OH) normalno završava na ketonima (R1R2C=O). Tercijarni alkoholi (R1R2R3C-OH) su otporni na oksidaciju.
Direktna oksidacija primarnih alkohola do karboksilnih kiselina se normalno odvija putem korespondirajućih aldehida, koji se transformišu preko aldehidnog hidrata (R-CH(OH)2) reakcijom sa vodom, pre dalje oksidacije do karboksilne kiseline.
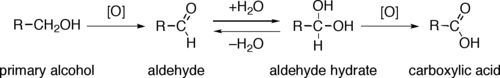
Reagensi koji su korisni pri transformaciji primarnih alkohola do aldehida su normalno podesni i za oksidaciju sekundarnih alkohola do ketona. To su Kolinsov reagens i Des–Martinov perjodinan. Direktna oksidacija primarnih alkohola do karboksilnih kiselina se može odvijati koristeći kalijum permanganat ili Džonsov reagens.
Vidi još[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ „alcohols”. IUPAC Gold Book. Pristupljeno 16. 12. 2013.
- ^ Mišić, Milan, ur. (2005). Enciklopedija Britanika. A-B. Beograd: Narodna knjiga : Politika. str. 35. ISBN 86-331-2075-5.
- ^ IUPAC. „Alcohols”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Nomenclature of Organic Chemistry, Oxford: Pergamon Press, 1979; A Guide to IUPAC Nomenclature of Organic Compounds, Recommendations 1993, Oxford: Blackwell Scientific Publications, 1993.
- ^ Aghababian 2010, str. 814
- ^ Ahmad 2010, str. 194
- ^ Behrman & Gopalan 2005, str. 1791.
- ^ Medical Biochemistry at a Glance @Google books, Blackwell Publishing, 2006, str. 52, ISBN 978-1-4051-1322-9
- ^ Miller, William Allen (1857). Elements of chemistry pt. 3 1857. J.W. Parker and Son. str. 52—54.
- ^ a b Reusch, William. „Alcohols”. VirtualText of Organic Chemistry. Arhivirano iz originala 19. 9. 2007. g. Pristupljeno 14. 9. 2007.
- ^ Organic chemistry IUPAC nomenclature. Alcohols Rule C-201.
- ^ Reusch, William (2. 10. 2013). „Nomenclature of Alcohols”. Pristupljeno 17. 3. 2015.
- ^ „MetaCyc Compound Class: a short-chain alcohol”. Pristupljeno 31. 12. 2013.
- ^ „Molecule Gallery - Alcohols”. Arhivirano iz originala 19. 04. 2015. g. Pristupljeno 31. 12. 2013.
- ^ „alcohol (chemical compound)”. Encyclopædia Britannica. Pristupljeno 31. 12. 2013.
- ^ a b Falbe, Jürgen; Bahrmann, Helmut; Lipps, Wolfgang; Mayer, Dieter (2000). „Alcohols, Aliphatic”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH Verlag. ISBN 3527306730. doi:10.1002/14356007.a01_279.
- ^ Lodgsdon J.E. (1994). „Ethanol”. Ur.: Kroschwitz J.I. Encyclopedia of Chemical Technology. 9 (4th izd.). New York: John Wiley & Sons. str. 820. ISBN 978-0-471-52677-3.
- ^ M, P.. D.. Geertinger; Bodenhoff, J.; K. Helweg-Larsen; Lund, A. (1. 9. 1982). „Endogenous alcohol production by intestinal fermentation in sudden infant death”. Zeitschrift für Rechtsmedizin. Springer-Verlag. 89 (3): 167—172. PMID 6760604. S2CID 29917601. doi:10.1007/BF01873798.
- ^ Logan BK, Jones AW (2000). „Endogenous ethanol 'auto-brewery syndrome' as a drunk-driving defence challenge”. Medicine, Science, and the Law. 40 (3): 206—15. PMID 10976182. S2CID 6926029. doi:10.1177/002580240004000304.
- ^ Adams, Cecil (20. 10. 2006). „Designated drunk: Can you get intoxicated without actually drinking alcohol?”. The Straight Dope. Pristupljeno 27. 2. 2013.
- ^ Lewis, E.S.; Boozer, C.E. J. Am. Chem. Soc. 1952, 74, 308.
- ^ Cram, D. J., J. Am. Chem. Soc. 1953, 75, 332-338.
- ^ Lee, C. C. ; Clayton, J. W.; Lee, D. G.; Finlayson, A. J. Tetrahedron, 1962, 18 1395-1402
Literatura[uredi | uredi izvor]
- Miller, William Allen (1857). Elements of chemistry pt. 3 1857. J.W. Parker and Son. str. 52—54.
- Ahmad, Jawad (2010). Hepatology and Transplant Hepatology: A Case Based Approach. Springer. str. 194. ISBN 978-1-4419-7085-5.
- Lodgsdon J.E. (1994). „Ethanol”. Ur.: Kroschwitz J.I. Encyclopedia of Chemical Technology. 9 (4th izd.). New York: John Wiley & Sons. str. 820. ISBN 978-0-471-52677-3.
- Aghababian, Richard V. (2010). Essentials of Emergency Medicine. Jones & Bartlett Publishers. str. 814. ISBN 978-1-4496-1846-9.
- Metcalf, Allan A. (1999). The World in So Many Words. Houghton Mifflin. ISBN 978-0-395-95920-6.
- Edited by Shelley Minteer, ur. (2006). Alcoholic Fuels. Boca Raton: CRC Press / Taylor & Francis. ISBN 978-0-8493-3944-8.
- Jonathan Clayden, ur. (2008). Alcohols; Science of Synthesis: Houben-Weyl Methods of Molecular Transformations. 36. Georg Thieme Verlag. ISBN 978-1-588-90527-7.
- Editor: Richard G. Herman, ur. (1984). Catalytic Conversions of Synthesis Gas and Alcohols to Chemicals. American Chemical Society, Middle Atlantic Regional Meeting. Plenum Press. ISBN 978-0-306-41614-9.
- Mellan, I. (1962). Polyhydric Alcohols. Spartan Books.
- Monick J. A. (1968). Alcohols: Their Chemistry, Properties, and Manufacture. Reinhold. ISBN 978-0-442-15601-5.
- Edward J. Wickson, ur. (1981). Monohydric Alcohols: Manufacture, Applications, and Chemistry: based on a symposium. ACS symposium series (volume 159). American Chemical Society. ISBN 978-0-8412-0637-3.
- Otera, J.; Nishikido, J. (2010). Esterification: Methods, Reactions, and Applications (Second izd.). Weinheim: Wiley-VCH. ISBN 978-3-527-32289-3.
- Tojo, G.; Fernández, M. (2006). Oxidation of Alcohols to Aldehydes and Ketones (First izd.). New York: Springer. ISBN 978-0-387-23607-0.
- Weissermel, K.; Arpe H-J. (2003). Alcohols - Industrial organic chemistry (4th izd.). Weinheim: Wiley-VCH. str. 193—266. ISBN 978-3-527-30578-0.
- S. M. Lokteva, ur. (1970). Vыsšie žirnыe spirtы (oblasti primeneniя, metodы proizvodstva, fiziko-himičeskie svoйstva). M.: «Himiя». str. 329.
- Kurc, L. A. G.; Brusova, P.; Demьяnovič, M. V. (1999). „Odno- i dvuhatomnыe spirtы, prostыe эfirы i ih sernistыe analogi”. Učebnыe materialы. Organičeskaя himiя. ChemNet. Himičeskiй fakulьtet MGU. Arhivirano iz originala 04. 03. 2016. g. Pristupljeno 10. 7. 2010.
- Markizova N. F.; Grebenюk, N. A..; Bašarin, A. V..; Bonitenko, Ю. E. (2004). Spirtы. Toksikologiя dlя vračeй. SPb.: «Foliant». str. 112. ISBN 978-5-93929-089-0.
- Reutov, A. O.; Kurc, L. A.; Butin, P. K. (2010). Organičeskaя himiя. 2 (3-e izd.). M: Binom. Laboratoriя znaniй. ISBN 978-5-94774-614-9 Proverite vrednost parametra
|isbn=: checksum (pomoć). - „Spirtы”. Эnciklopediя po ohrane i bezopasnosti truda. Tom IV. Razdel XVIII. Spravočniki. Obzor himičeskih soedineniй. Institut promыšlennoй bezopasnosti, ohranы truda i socialьnogo partnerstva. Arhivirano iz originala 04. 03. 2016. g. Pristupljeno 27. 12. 2010.
Članci[uredi | uredi izvor]
- Behrman, E. J.; Gopalan, Venkat (2005). William M. Scovell, ur. „Cholesterol and Plants” (PDF). Journal of Chemical Education. 82 (12): 1791. Bibcode:2005JChEd..82.1791B. doi:10.1021/ed082p1791. Arhivirano iz originala (PDF) 21. 10. 2012. g. Pristupljeno 13. 02. 2017.
Spoljašnje veze[uredi | uredi izvor]
- Alcohol (Ethanol) at The Periodic Table of Videos (University of Nottingham)
- Mitschnitte von Vorlesungen der Universität Tübingen, Experimentalchemie II, Organische Chemie.
- Schulversuche zum Thema Alkohole
- „Spirtы. Fenolы”. Organičeskaя himiя. Videoopыtы. Edinaя kollekciя cifrovыh obrazovatelьnыh resursov. Arhivirano iz originala 21. 8. 2011. g. Pristupljeno 06. 07. 2010.



