Метаболизам — разлика између измена
. |
. |
||
| Ред 243: | Ред 243: | ||
* [[Денитрификација]] |
* [[Денитрификација]] |
||
{{colend}} |
{{colend}} |
||
[[Aзотни циклус]] je [[Биогеохемијски процеси|биогеохемијски циклус]] путем кога се [[азот]] конвертује у вишеструке хемијске форме док циркулише између [[Атмосфера небеског тела|атмосфере]], [[terrestrial ecosystem|земљишта]] и [[Животне заједнице мора|морског екосистема]]. До конверзије азота може доћи путем биолошких и физичких процеса. Важни процеси у азотном циклусу су [[nitrogen fixation|фиксација]], [[ammonification|амонификација]], [[nitrification|нитрификација]], и [[denitrification|денитрификација]]. Већински део [[Zemljina atmosfera|земљине атмосфере]] (78%) се састоји од [[азот]]а,<ref name=CarrollSalt2004p93>{{Cite book|title=Ecology for gardeners|author1=Steven B. Carroll|author2=Steven D. Salt|publisher=Timber Press |year=2004|isbn=978-0-88192-611-8 |page=93 |url=https://books.google.com/books?id=aM4W9e5nmsoC&pg=PA93 }}</ref> те је она велики извор азота. Међутим, атмосферски азот има ограничену доступност за биолошке примене, што доводи до [[scarcity|недостатака]] употребљивог азота у многим типовима [[екосистем]]а. |
|||
Азотни циклус је посебно значајан за [[екологија|екологију]] је азотна доступност може да утиче на брзину процеса у екосистему, укључујући [[primary production|примарну продукцију]] и [[Decomposition|декомпозицију]]. Људске активности као што је сагоревање фосилних горива, употреба вештачих азотних ђубрива, и испуштање азота у водене токове су драматично [[Human impact on the nitrogen cycle|променили глобални азотни циклус]].<ref>{{cite journal |last1=Kuypers |first1= MMM |last2=Marchant |first2=HK |last3=Kartal |first3=B |title= The Microbial Nitrogen-Cycling Network |journal=Nature Reviews Microbiology |volume=1 |issue=1 |pages=1-14 |year=2011 |pmid=29398704 |doi=10.1038/nrmicro.2018.9 }}</ref><ref>{{cite journal|last1=Galloway|first1=J. N.|title=Nitrogen cycles: past, present, and future generations |journal=Biogeochemistry |volume=70 |pages=153–226 |year=2004 |doi=10.1007/s10533-004-0370-0|display-authors=etal}}</ref> |
|||
== Метаболизам лекова == |
== Метаболизам лекова == |
||
Верзија на датум 11. април 2018. у 04:16
| Биохемија |
|---|
 |
| Кључне компоненте |
| Историја и теме |
| Портали: Биологија, Хемија, MCB |
Метаболизам (грч. μεταβολήσμός што значи промена) је биохемијски процес у коме долази до модификације хемијских једињења у живим организмима и ћелијама. Метаболизам се дели на анаболизам односно биосинтезу (стварање) комплексних органских молекула и на катаболизам који је обрнути процес од анаболизма, а то је раздвајање комплексних органских једињења у једноставнија једињења. Свеукупни биохемијски процеси у једном организму се једном речју називају метаболизам. Без метаболизма ми не бисмо могли да преживимо.[1]
Метаболизам је сет хемијских трансформација којима се одржава живот у ћелијама. Ове реакције су катализоване ензимима. Оне омогућавају организмима да расту и да се репродукују, одрже своје структуре, и одговоре на стимулуст из околине. Реч метаболизам се исто тако може односити на све хемијске реакције које се одвијају у живим организмима, укључујућу варење и транспорт супстанци у и између различитх ћелија, у ком случају се сет реакција унутар ћелија назива интермедијерни метаболизам.
Хемијске реакције метаболизма су организоване у метаболичке путеве, у којима се једна хемикалија трансформише путем серије корака у другу хемикалију, посредством секвенце ензима. Ензими су од пресудног значаја за метаболизам, зато што они омогућавају организмима одвијање жељених реакција са високом енергијом активације које се не би спонтано одвијале. То се обично остварује путем спрезања тих реакција са спонтаним реакцијама у којима се отпушта енергија. Ензими делују као катализатори који омогућавају реакцијама да брже теку. Ензими исто тако омогућавају регулацију метаболичких путева у одговору на промене у ћелијском окружењу или на сигнале из других ћелија.
Метаболички систем датог организма одређује које супстанце ће бити хранљиве, а које ће бити отровне. На пример, неке прокариоте користе водоник сулфид као нутријент, док је тај гас отрован за животиње.[2] Брзина метаболизма, метаболичка стопа, утиче на количину хране која је неопходна организму, а исто тако утиче и на начин на који организам долази до хране.
Упадљива одлика метаболизма је сличност основних метаболичких путева и њихових компоненти, чак и између веома различитих врста.[3] На пример, група карбоксилних киселина које су најбоље познате као интермедиери циклуса лимунске киселине је присутна у свим познатим организмима, од једноћелијске бактерије Escherichia coli до огромних вишећелијских организама, као што су слонови.[4] Те упадљиве сличности метаболичких путева су вероватно последица њихове ране појаве током еволуционе историје, и задржавања звог њихове ефикасности.[5][6]
Кључне биохемикалије

Већина структура од којих се састоје животиње, биљке и микроби су направљене од три основне класе молекула: аминокиселина, угљени хидрати и липиди (који се често називају мастима). Пошто су ти молекули витални за живот, метаболичке реакције су усредсређене било на прављење тих молекула током конструкције ћелија и ткива, или на њихово разлагање, при чему се они користе као извори енергије, путем варења. Те биохемикалије могу да буду спојене у полимере као што су ДНК и протеини, есенцијални макромолекули живота.
| Type of molecule | Име мономерних форми | Име полимерних форми | Примери полимерних форми |
|---|---|---|---|
| Аминокиселине | Аминокиселине | Протеини (такође познати као полипептиди) | Фиброзни протеини и глобуларни протеини |
| Угљени хидрати | Моносахариди | Полисахариди | Скроб, гликоген и целулоза |
| Нуклеинске киселине | Нуклеотиди | Полинуклеотиди | ДНК и РНК |
Аминокиселине и протеини
Протеини се састоје од аминокиселина уређених у линеарне ланце спојене пептидним везама. Многи протеини су ензими који катализују хемијске реакције метаболизма. Други протеини имају структурне и механичке функције, као што су они који формирају цитоскелетон, систем којим се одржава ћелијски облик.[7] Протеини су исто тако важни у ћелијској сигнализацији, имунском респонсу, ћелијској адхезији, активном транспорту кроз мембране, и ћелијском циклусу.[8] Аминокиселине исто тако доприносе ћелијском енергетском метаболизму тако што служе као извор угљеника за улаз у цилус лимунске киселине (Кребсов циклус),[9] што је посебно значајно кад су примарни извори енергије, као што је глукоза оскудни, или кад ћелије подлежу метаболичком стресу.[10]
Липиди
Липиди су најразноврснија група биохемикалија. Њихова главна структурна улага је као компонента биолошких мембрана, унутрашњих и спољашњих, као што је ћелијска мембрана, или као извор енергије.[8] Липиди се обично дефинишу као хидрофобни или амфифилни биолошки молекули, мада се растварају у органским растварачима као што је бензен или хлороформ.[11] Масти су група великих једињења која садрже масне киселине и глицерол; молекул глицерола везан за три масне киселине је естар који се зове триацилглицерид.[12] Постоји неколико варијација ове базне структуре, укључујући алтернативне основе као што је сфингозин у сфинголипидима, и хидрофилне групе као што су фосфати у фосфолипидима. Стероиди као што је холестерол су још једна важна класа липида.[13]
Угљени хидрати

Угљени хидрати су алдехиду или кетони, са неколико везаних хидроксилних група, који могу да постоје као отворени ланци или прстенови. Угљени хидрати су најраспрострањенији биолошки молекули. Они врше бројне улоге, као што је складиштење и транспорт енергије (скроб, гликоген) и као структурне компоненте (целулоза у биљкама, хитин код животиња).[8] Основне угљено хидратне јединице се називају моносахаридима и обухватају галактозу, фруктозу, и глукозу. Моносахариди могу да буду повезани у полисахариде на скоро неограничен број начина.[14]
Нуклеотиди
Две нуклеинске киселине, ДНК и РНК, су полимери нуклеотида. Сваки нуклеотид се састоји од фосфата везаног за рибозну или дезоксирибозни шећерну групу, која је везана за азотну базу. Нуклеинске киселине су критичне за чување и употребу генетичке информације, и њену интерпретацију путем процеса транскрипције и биосинтезе протеина.[8] Та информација је заштићена путем механизма за поправку ДНК и пропагира се путем ДНК репликације. Многи вируси имају РНК геноме, на пример ХИВ. Они користе реверзну транскрипцију за креирање ДНК шаблона из свог виралног РНК генома.[15] РНК у рибозимима као што су сплајсеозоми и рибозоми је слична са ензимама у смислу тога да може да катализује хемијске реакције. Индивидуални нуклеотиди су формирани везивањем нуклеобазе за рибозни шећер. Те базе су хетероциклични прстенови који садрже азот, класиковани као пурини или пиримидини. Нуклеотиди исто тако делују као коензими у реакцијама трансфера метаболичких група.[16]
Коензими

Метаболизам обухвата широк низ хемијских реакција. Већина њих се може груписати у неколико основних типова реакција које обухватају трансфер функционалних група атома и њихових веза унутар молекула.[17] Та заједничка хемија омогућава ћелијама да користе малу групу метаболичких интермедијера да преносе хемијске групе између различитих реакција.[16] Ти интермедијери који преносе групе се називају коензимима. Свака класа реакција преноса група се изводи посредством специфичног коензима, који је супстрат за групу ензима који га производе, и за групу ензима који га конзумирају. Ти коензими се стога стално формирају, конзумирају и затим рециклирају.[18]
Један централни коензим је аденозин трифосфат (ATP), универзална енергијска валута у ћелијама. Тај нуклеотид се користи за трансфер хемијске енергије између различитих хемијских реакција. Постоји релативно мала количина ATP молекула у ћелијама, али се они константно регенеришу, људско тело може да употреби еквивалент своје тежине ATP молекула на дан.[18] ATP делује као мост између катаболизма и анаболизма. Катаболизмом се разлажу молекули, а анаболизмом се формирају. Катаболичке реакције генеришу ATP, а анаболичке реакције га конзумирају. ATP такође служи као преносник фосфатне групе у реакцијама фосфорилације.

Витамин је органско једињење које је неопходно у малим количинама и које се не може формирати у ћелијама датог организма. У људској исхрани, већина витамина функционишу као коензими накони модификације; на пример, сви у води растворни витамини су фосфорилисани или су спрегнути са нуклеотидима кад се користе у ћелијама.[19] Никотинамид аденин динуклеотид NAD+), дериват витамина B3 (ниацина), је важан коензим који делује као акцептор водоника. Стотине различитих типова дехидрогеназа уклањају електроне са својих субстрата и редукују NAD+ до NADH. Том редукцијом се формира коензим је затим супстрат за било коју од редуктаза у ћелији које редујукују своје супстрате.[20] Никотинамид аденин динуклеотид постоји у две сродне форме у ћелији, NADH и NADPH. NAD+/NADH форма је важнија у катаболичким реакцијама, док се NADP+/NADPH користи у анаболичким реакцијама.
Минерали и кофактори
Шаблон:Further2 Неоргански елементи играју критичне улоге у метаболизму; неки су изобилни (е.г. натријум и калијум), док други функционишу у веома малим концентрацијама. Око 99% масе сисара се састоји од елемената угљеник, азот, калцијум, натријум, хлор, калијум, водоник, фосфор, кисеоник и сумпор.[21] Органска једињења (протеини, липиди и угљени хидрати) садрже највећи део угљеника и азота; највећи део кисеоника и водоника је присутан у облику воде.[21]
Изобилни неоргански елементи делују као јонски електролити. Најважнији јони су натријум, калијум, калцијум, магнезијум, хлор, фосфор и органски јон бикарбонат. Одржавањем прецизних јонских градијената кроз ћелијске мембране одржава се осмотски притисак и pH.[22] Јони су такође критични за функцију нерва и мишића, пошто се акциони потенцијали у тим ткивима производе разменом електролита између екстрацелуларног флуида и ћелијског флуида, цитозола.[23] Електролити улазе и напуштају живе ћелије посредством протеина у ћелијској мембрани званих јонски канали. На пример, контракција мишића је зависна од кретања калцијума, натријума и калијума кроз јонске канале у ћелијској мембрани и Т-тубулама.[24]
Прелазни метали су обично присутни као микроелементи организмима, при чему су цинк и гвожђе најзаступљенији међу њима.[25][26] Ти метали се користе у појединим протеинима као кофактори и есенцијални су за активност ензима као што су каталазе и протеина који преносе кисеоник као што је хемоглобин.[27] Метални кофактори су снажно везани за специфична места у протеинима; мада ензимски кофактори могу да буду модификовани током катализе, они се увек враћају у своје почетно стање на крају каталитичке реакције. Метални микронутриенти се уносе у организме посредством специфичних транспортера и везују се за складишне протеине, као што је феритин или металотионеин, кад се не користе.[28][29]
Метаболички процеси
Метаболички процеси омогућују организму да расте, да се размножава, да одржава своју структуру и реагује на околину. Према метаболичким реакцијама, метаболизам се дели у две категорије:
- Катаболизам којим се разграђује органска материја (нпр. накупљање енергије ћелијским дисањем)
- Анаболизам који користи енергију за изградњу ћелијских делова (биосинтеза органске материје) као што су нпр. протеини и нуклеинске киселине.
Хемијске реакције метаболизма су подељене у метаболичке путеве у којима се одређено хемијско једињење претвара у нека друга уз помоћ ензима. Ензими су кључни у метаболизму зато што омогућују организму да брзо и ефикасно изводи биолошки пожељне, али термодинамички неповољне хемијске реакције, у којима ензими делују као катализатори. Ензими омогућују и контролу метаболичких путева, као одговор на промене у ћелијској околини или неки други подражај.
Неки од основних метаболичких путева у организму човека су:
- Метаболизам воде
- Метаболизам аминокиселина које се међусобно повезују пептидном везом и обликују полипептиде тј. протеине
- Метаболизам угљених хидрата
- Метаболизам масти
Метаболизам појединог организма одређује која ће се хемијска једињења користити као храњиве материја, а која као отрови. Тако на пример, неки прокариоти користе водоник сулфид, као хранљиву материју док је већини животиња отров. Изненађујућа је сличност основних метаболичких путева међу великим бројем врста. Тако на пример карбоксилна киселина, међупродукта у циклусу лимунске киселине, је присутна у свим организмима, од бактерија као што је Escherichia coli па до великих вишећелијских организама, нпр. слон.
Базални метаболизам је назив за количину енергије која је потребна за одржавање основних животних функција организма. У разговорима о дијетама и одржавању линије, стално се провлачи теза да постоје људи који имају „метаболизам да им се ништа не лепи колико год да једу“ и о онима „којима се лепи кад прођу поред хране“. Тачно је да индивидуалне разлике постоје, а постоје и промене које једна особа може сама на различите начине (свесно или несвесно) да индукује у свом телу. Колико је „брз метаболизам“, односно колико један организам троши у стању мировања у току дана изражава се БМР бројем, односно бројем калорија које троши базални метаболизам.[30]
Катаболизам
Катаболизам је група метаболичких процеса који разграђују велике сложене молекуле. Главна сврха разградње сложених молекула је добијање мањих молекула који касније служе као „материјал“ за изградњу сложених једињења за потребе организма (анаболичке реакције), као и добијање енергије. Катаболичке реакције се разликују од организма до организма, па се према начину на који организми добивају енергију и угљеник могу и поделити. Организми који користе органске молекуле као извор енергије називају се органотрофни организми, док литотрофни организми користе неорганска једињења, а фототрофни организми сунчеву светлост користе као потенцијални извор хемијске енергије.
- Целуларна респирација је процес стварање енергије (ATP и NADPH). Овај процес је такође активан и при варењу хране.
- Катаболизам угљених хидрата
- Гликогенолиза процес разградње гликогена до глукозе
- Гликолиза процес разградње глукозе до пирувата уз продукцију ATP, при чему кисеоник није потребан
- Ембден-Мејерхофов метаболизам, најчешћи метаболизам у процесу гликолизе
- Ентнер-Доудороф метаболизам споредни процес гликолизе који се јавља код неких бактерија
- Метаболизам Фосфатне Пентозе је процес у коме се синтетише NADPH из глукозе
- Катаболизам протеина је процес у коме се протеини хидролизом претварају у амино киселине
- Катаболизам угљених хидрата
- Аеробна респирација
- Анаеробна респирација
Сви ови различити облици метаболизма зависе од редокс реакција које обухватају пренос електрона с редукованог молекула донора (нпр. органски молекули, вода, амонијак, водоник сулфид или јон гвожђа), на молекул акцептора електрона (нпр. кисеоник, нитрат или сулфат).[31] Код животиња, ове реакције обухватају комплексне органске молекуле који се разлажу до једноставнијих молекула, као што су угљен диоксид и вода. Код фотосинтетичких организама, као што су биљке и модрозелене бактерије, ове реакције електронског трансфера не ослобађају енергију него се користе као начин складиштења енергије апсорбоване из сунчевог светла.[32]
- Класификација организама према њиховом метаболизму
| извор енергије | сунчева светлост | фото- | -троф | ||
| молекуле | хемо- | ||||
| донор електрона | органско једињење | органо- | |||
| неорганско једињење | лито- | ||||
| извор угљиеника | органско једињење | хетеро- | |||
| неорганско једињење | ауто- | ||||
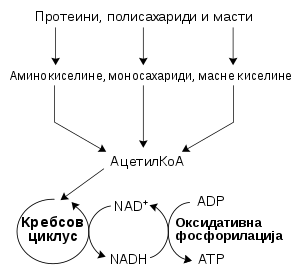
Најчешћи скуп катаболичких реакција код животиња може се раздвојити у три главне фазе. У првој фази се велики молекули, као што су протеини, полисахариди или липиди, варе до мањих компоненти изван ћелија. Затим те мање молекуле преузимају ћелије и конвертују их до малих молекула, обично ацетил коензима А (ацетил-КоА), чиме се ослобаћа део енергије. На крају се ацетил група на КоА оксидује до воде и угљен диоксида у циклусу лимунске киселине и ланцу електронског транспорта, чиме се ослобађа ускладиштена енергија путем редукције коензима никотинамид аденин динуклеотида (NAD+) до NADH.
Варење
Макромолекуле, као што су скроб, целулоза или протеини, ћелије не могу брзо да преузму и они морају да буду разложени у мање јединице пре него што се могу користиту у хелијском метаболизму. Неколико устаљених класа ензима вари ове полимере. Ови дигестивни ензими обухватају протеазе, које варе протеине до аминокиселина, као и гликозидне хидролазе које варе полисахариде до једноставних шећера познатих као моносахариди.
Микроби јеноставно излучују дигестивне ензиме у своје окружење,[33][34] док животиње једино излучују те ензиме из специјализованих ћелија у својим цревима, укључујући желудац и гуштерачу, и пљувачне жлезде.[35] Аминокиселине или шећери ослобођени помоћу тих екстрацелуларних ензима затим бивају упумпане у ћелије помоћу протеина активног транспорта.[36][37]
Енергија из органских једињења
Катаболизам угљених хидрата је разлагање угљених хидрата у мање јединице. Угљени хидрати обично бивају унети у ћелије након што су сварени до моносахарида.[38] Унутар ћелије, главни пут разлагања је гликолиза, при чему се шећери као што су глукоза и фруктоза конвертују у пируват и делом се формира ATP.[39] Пируват је интермедијер у неколико метаболичких путева, мада се највећи део конвертује у ацетил-КоА путем аеробне (кисеоничне) гликолизе и улази у циклус лимунске киселине. Извесна количина ATP формира у Кребсовом циклусу. Најважнији продукат је NADH, који настаје из NAD+ при оксидацији ацетил-КоА. Овом оксидацијом се ослобађа угљен диоксид као отпадни продукат. У анаеробним условима, гликолизом се производи лактат, путем ензима лактатна дехидрогеназа који поново оксидује NADH до NAD+ ради поновне употребе у гликолизи. Једна алтернативна рута за разлагање глукозе је пентозно фосфатни пут, којим се редукује коензим NADPH и формирају пентозни шећери као што је рибоза, шећерна компонента нуклеинских киселина.
Масти се катаболизују путем хидролизе до слободних масних киселина и глицерола. Глицерол даље подлеже гликолизи, а масне киселине се разлажу путем бета оксидације уз формирање ацетил-КоА, који затим улази у циклус лимунске киселине. Масне киселине ослобађају више енергије при оксидацији од угљених хидрата зато што угљени хидрати имаја већи садржај кисеоника у својим структури. Стероиде се исто тако разлажу неке бактерије у процесу који је сличан бета оксидацији, и при том процесу разлагања се ослобађају знатне количине ацетил-КоА, пропионил-КоА, и пирувата, сви од којих се могу користити у ћелији као извор енергије. M. tuberculosis може да расте на липиду холестерол као једином извору угљеника, и за гени који учествују у путевима употребе холестерола је утврђено да су важни током различитих фаза животног циклуса инфекције са M. tuberculosis.[40]
Аминокиселине се користе било за синтезу протеина и других биомолекула, или бивају оксидоване до урее и угљен диоксида као извор енергије.[41] Оксидациони пут почиње са уклањањем амино групе посредством трансаминазе. Амино група улази у циклус уреје, остављајући деаминовани угљенични костур у облику кетокиселина. Неке од тих кетокиселина су интермедијери у циклусу лимунске киселине, на пример деаминацијом глутамата се формира кетокиселина α-кетоглутарат.[42] Глукогене аминокиселине исто тако могу да буду конвертоване у глукозу, путем глуконеогенезе.[43]
Анаболизам
Анаболизам је процес стварања комплексних једињења од једноставних органских молекула:
- Гликогенеза
- Глуконеогенеза
- Синтеза порфирина
- HMG-CoA редукција, у којој се ствара холестерол и изопреноиди.
- Секундардни метаболизам, метаболизам који није неопходан за раст, преживљавање и репродукцију, али има еколошких функција.
- Фотосинтеза
- Светла фаза фотосинтезе (реакције које зависе од одређене количине светлости)
- Тамна фаза (не зависе од светлости)
Анаболизам је низ метаболичких процеса изградње сложених молекула, у којима се користе прекурсори и енергија настала катаболизмом. Сложени молекули који највећим делом чине ћелијске структуре, настају поступно, корак по корак из малих једноставних молекула. Анаболизам се одвија у три основна ступња. У првом ступњу настају прекурсори сложених молекула као што су аминокиселине, моносахариди, исопреноиди и нуклеотиди. У другом ступњу прекурсори се активирају, везањем енергије из ATP молекула, а у трећем ступњу се прекурсори спајају у сложена једињења као што су протеини, полисахариди, липиди и нуклеинске киселине.
Организми се међусобно разликују по томе колико молекула могу изградити у својим ћелијама. Аутотрофни организми као што су биљке могу изградити сложене молекуле као што су полисахариди и протеини из једноставних молекула попут угљен-диоксида и воде (фотосинтеза). За разлику од њих, хетеротрофним организмима су потребни извори сложенијих молекула, као што су аминокиселине и моносахариди, како би изградили своје сложене молекуле. Организми се могу даље поделити на фотоаутотрофне и фотохетеротрофне чији је извор енергије Сунце, и на хемоаутотрофне и хемохетеротрофне чији је извор енергије реакција оксидације неорганских материја.
Фиксација угљеника

Фотосинтеза је синтеза угљених хидрата из сунчеве светлости и угљен диоксида (CO2). У биљкама, модрозеленим бактеријама и алгама, кисеонична фотосинтеза разлаже воду, и при томе настаје кисеоник као отпадни продукат. Овај процес користи ATP и NADPH, који су формирани путем фотосинтетичких реакционих центара, за конвертовање CO2 у глицерат 3-фосфат, који се затим може конвертовати у глукозу. Ова реакција фиксације угљеника се изводи посредством ензима рибулоза-бисфосфатна карбоксилаза као део Калвин – Бенсоновог циклуса.[44] Три типа фотосинтезе се одвијају у биљкама, C3 угљенична фиксација, C4 угљенична фиксација и CAM фотосинтеза. Они се разликују по рути коју угљен диоксид узима у Калвиновом циклусу, при чему C3 биљке директно фиксирају CO2, док при C4 и CAM фотосинтези прво долази до инкорпорације CO2 у друга једињења, као адаптација на интензивну сунчеву светлост и сушне услове.[45]
Код фотосинтетичких прокариота механизми угљеничне фиксације су разноврснији. Овде, угљен диоксид може да буде фиксиран путем Калвин – Бенсоновог циклуса, реверзног Кребсог циклуса,[46] или карбоксилације ацетил-КоА.[47][48] Прокариотски хемоаутотрофи исто тако фиксирају CO2 путем Калвин – Бенсоновог циклуса, али користе енергију из неорганских једињења за вођење реакције.[49]
Угљени хидрати и гликани
У анаболизму угљених хидрата, једноставне органске киселине се могу конвертовати у моносахариде као што је глукоза, који се затим користе за формирање полисахарида, као што је скроб. Стварање глукозе из једињења као што је пируват, лактат, глицерол, глицерат 3-фосфат и аминокиселине се назива глуконеогенеза. Глуконеогенезом се конвертује пируват до глукоза 6-фосфата путем серије интермедијера, многи од којих су заједнички са гликолизом.[39] Међутим, овај метаболички пут није једноставно гликолиза која се одвија уназад, пошто је неколико корака катализовано негликолитичким ензимима. Ово је важно јер се тиме омогућава засебна регулација формирања и разлагања глукозе, и спречавају ситуације у којима се оба метаболичка пута симултано одвијају у супстратном (бескорисном) циклусу.[50][51]
Иако је маст уобичајени начин чувања енергије, код кичмењака као што су људи, масне киселине у тим оставама не могу да буду конвертоване до глукозе путем глуконеогенезе, пошто ти организми не могу да конвертују ацетил-КоА у пируват; биљке имају ту способност, док животиње немају неопходну ензиматску машинерију.[52] Консеквентно, након дуготрајног гладовања, кичмењаци морају да производе кетонска тела из масних киселина да би надокнадили глукозу у ткивима као што је мозак, која не могу да метаболизују масне киселине.[53] У другим организмима, као што су биљке и бактерије, овај метаболички проблем је решен користећи глиоксилатни циклус, којим се заобилази декарбоксилациони корак у циклусу лимунске киселине и омогућава трансформација ацетил-КоА до оксалоацетата, који се затим може користити за продукцију глукозе.[52][54]
Полисахариди и гликани настају секвенцијалним додавањем моносахарида посредством гликозилтрансферазе из реактивних шећерно-фосфатних донора, као што је уридин-дифосфат глукоза (UDP-глукоза), на акцепторску хидроксилну групу растућег полисахарида. Како било која хидроксилна група на прстену супстрата може да буде акцептор, формирани полисахариди могу да имају праволанчане или разгранате структуре.[55] Настали полисахариди могу да имају структурне и метаболичке функције, или могу да буду повезани са липидима и протеинима посредством ензима званих олигосахарилтрансферазе.[56][57]
Масне киселине, изопреноиди и стероиди
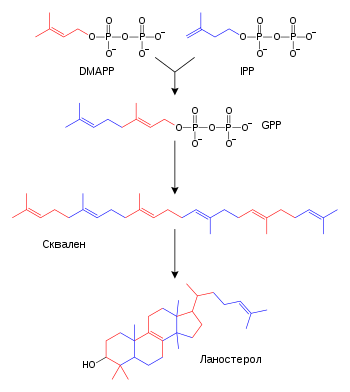
Масне киселине се формирају посредством масно киселинских синтаза којима се полимеризују и затим редукују ацетил-КоА јединице. Ацилни ланци у масним киселинама се продужују путем циклуса реакција којима се додаје ацил група, редукује до алкохола, дехидрира до алкенске групе и затим поново редукује до алканске групе. Ензими биосинтезе масних киселина се деле у две групе: код животиња и гљива све реакције синтезе масних киселина посредује један мултифункционални протеин типа I,[58] док у биљним пластидима и бактеријама засебни ензими типа II посредују сваки корак биохемијских путева.[59][60]
Терпени и изопреноиди су велика класа липида која обухвата каротеноиде и формира највећу класу биљних природних производа.[61] Ова једињења се формирају путем састављања и модификације изопренских јединица донираних из реактивних прекурзора изопентенил пирофосфата и диметилалил пирофосфата.[62] Ови прекурзори могу да буду формирани на различите начине. Код животиња и археја, мевалонатним путем се производе ова једињења из ацетил-КоА,[63] док у биљкама и бактеријама немевалонатни пут користи пируват и глицералдехид 3-фосфат као супстрате.[62][64] Једна важна реакција у којој се користе ови активирани изопренски донори је биосинтеза стероида. Овде се изопренске јединице спајају и формира се сквален који затим поприма конформацију подесну за формирање сета прстенова, која је прекурзор ланостерола.[65] Ланостерол затим може да буде конвертован у друге стероиде, као што су холестерол и ергостерол.[65][66]
Протеини
Организми варирају у погледу њихове способности да синтетишу 20 протеиногених аминокиселина. Већина бактерија и биљки може да синтетише свих двадесет, док животиње могу да синтетишу само једанаест неесенцијалних аминокиселина, а девет есенцијалних аминокиселина се морају уносити путем хране.[8] Неким једноставним паразитима, као што је бактерија Mycoplasma pneumoniae, недостаје способност синтезе свих аминокиселина и они морају да преузимају аминокиселине директно од њихових домаћина.[67] Све аминокиселине се синтетишу из интермедијера у биохемијском путу гликолизе, циклуса лимунске киселине, или пентозног фосфата. Као извор азота користи се глутамат и глутамин. Синтеза аминокиселина зависи од формирања подесне алфа-кето киселине, која затим бива трансаминисана до аминокиселине.[68]
Аминокиселине се користе као градивни блокови протеина. Оне се спајају у ланце путем пептидних веза. Сваки протеин има своју јединствену секвенцу аминокиселинских остатака: то је његова примарна структура. Као што се слова алфабета могу комбиновати и формирати скоро бескрајно мноштво различитих речи, аминокиселине се могу повезати у различитим секвенцама како би се формирало огромно мноштво различитих протеина. Протеини се праве од аминокиселина које су биле активиране везивањем за молекул транспортне РНК путем естарске везе. Овај аминоацил-тРНК прекурзор се формира реакцијом која је зависна од ATP и која се одвија посредством аминоацил тРНК синтетазе.[69] Молекул аминоацил-тРНк је затим супстрат за рибозом, који додаје аминокиселину на протеински ланац, користећи секвенциону информацију у информационој РНК.[70]
Нуклеотидна синтеза и спасавање
Нуклеотиди се формирају из аминокиселина, угљен диоксида и мравље киселине у биохемијском путу у коме се троши велика количина метаболичке енергије.[71] Консеквентно, већина организама има ефикасне системе за поновну употребу већ формираних нуклеотида.[71][72] Пурини се синтетишу као нуклеозиди (базе везане за рубозу).[73] Аденин и гванин се формирају из прекурзорног нуклеозида инозин монофосфата, који се синтетише користећи атоме из аминокиселина глицин, глутамин, и аспартинска киселина, као и формата пренесеног са коензима тетрахидрофолата. Пиримидини се, међутим, синтетишу из базе оротата, која се формира из глутамина и аспартата.[74]
Енергија
Оксидацијска фосфорилација

У процесу оксидативне фосфорилације електрони уклоњени са органских једињења у метаболичким путевима, као што је нпр. Кребсов циклус, преносе се на молекул кисеоника при чему се настала енергија користи за синтезу ATP молекула. Код еукариота пренос електрона обавља низ протеинских комплекса на унутрашњој мембрани митохондрија. Тај низ протеина користи енергију насталу преносом електрона за изпумпавање протона изван митохондрија и чини респираторни ланац. Протеински комплекси делују тако да преносе електрон из једног активног места у комплексу на друго, при чему у свакој реакцији електрон губи малу количину енергија, која се на тај начин врло ефикасно користи за испумпавање протона изван митохондрија. Изпумпавањем протона настаје на мембрани митохондрија електрохемијски градијент,[75] због разлике у концетрацији протона. Изпумпани протони се враћају унутар митохондрија помоћу ензима ATP синтаза који користи њихов проток низ градијент са синтезу ATP-а из АДП-а.[18] Тај проток се може користити и за друге процесе у ћелији.
Код прокариота, ови протеини се налазе на унутрашњој мембрани ћелија.[76] Ови протеини користе енергију ослобођену пролазом електрона са редукованих молекула као што је NADH на кисеоник за пумпање протона кроз мембрану.[77]
Енергија из неорганских једињења
Хемолитотрофни организми су одређени прокариоти који енергију добијају оксидацијом неорганских једињења. Ови организми могу да користе водоник,[78] једињења које садрже редуковани сумпор (сулфид, водоник сулфид, тиосулфат),[2] гвожђе(II)-оксид[79] или амонијак[80] као електронске доноре. Електрони се у респираторном ланцу искориштавају за добивање ATP-а, док су електрон акцептори молекули као нпр. кисеоник или нитрити.[81] Ови процеси који се одвијају у микроорганизмима могу бити од велике важности у глобалном биогеохемијским циклусима, као што су ацетогенеза, нитрификација тла и денитрификација, и они су од критични за плодност земљишта.[82][83]
Енергија сунчеве светлости
Енергију из сунчеве светлости биљке, одређене групе бактерија[84] (модрозелене бактерије, пурпурне бактерије,[85] зелене сумпорне бактерије[86][87]) и протиста. Овај процес је обично спрегнут са конверзијом угљен диоксида у органска једињења, што је део фотосинтезе. Системи за прихват енергије и фиксирање угљеника могу међутим засебно да делују код прокариота, будући да пурпурне бактерије и зелене сумпорне бактерије могу да користе сунчеву светлост као извор енергије, уз прелаз између фиксације угљеника и ферментације органских једињења.[88][89]
У многим организмима прихват соларне енергије је у принципу сличан са оксидативном фосфорилацијом, јер укључује складиштење енергије у виду градијента протонске концентрације. Ова сила протонског кретања затим покреће ATP синтезу.[18] Електрони потребни за вођење овог електронског транспортног ланца потичу од протеина за прикупљање светлости званих фотосинтетички реакциони центри или родопсини. Реакциони центери се класификују у два типа у зависности од типа присутно фотосинтетског пигмента, при чему већина фотосинтетичких бактерија поседује само један тип, док биљке и модрозелене бактерије имају два.[90]
У биљкама, алгама и модрозеленим бактеријама, фотосистем II користи светлосну енергију за уклањање електрона из воде, чиме се ослобађа кисеоник као отпадни продукат. Електрони затим теку до цитохром б6ф комплекса, који користи њихову енергију за пумпање протона кроз тилакоидну мембрану у хлоропластима.[32] Ови протони се враћају кроз мембрану и омогућавају дејство ATP синтазе. Електрони затим пролазе кроз фотосистем I и могу да буду кориштени за редуковање коензима NADP+, да буду употребљени у Калвиновом циклусу, или да буду рецикловани за даље ATP генерисање.[91]
Метаболизам азота
Азотни метаболизам подразумева процесе у којима се синтетише и у којима долази до испуштања азота из организама, као и биолошки процес азотног циклуса:
- Уреа циклус, важан процес у коме долази до испуштања азота из организма у облику урее
- Биолошка азотофиксација
- Азотна асимилација
- Нитрификација
- Денитрификација
Aзотни циклус je биогеохемијски циклус путем кога се азот конвертује у вишеструке хемијске форме док циркулише између атмосфере, земљишта и морског екосистема. До конверзије азота може доћи путем биолошких и физичких процеса. Важни процеси у азотном циклусу су фиксација, амонификација, нитрификација, и денитрификација. Већински део земљине атмосфере (78%) се састоји од азота,[92] те је она велики извор азота. Међутим, атмосферски азот има ограничену доступност за биолошке примене, што доводи до недостатака употребљивог азота у многим типовима екосистема.
Азотни циклус је посебно значајан за екологију је азотна доступност може да утиче на брзину процеса у екосистему, укључујући примарну продукцију и декомпозицију. Људске активности као што је сагоревање фосилних горива, употреба вештачих азотних ђубрива, и испуштање азота у водене токове су драматично променили глобални азотни циклус.[93][94]
Метаболизам лекова
Метаболизам лекова је модификација или деградација лекова и других ксенобиотичких једињења путем следећих система:
Сви организми су константно изложени једињењима која они не могу да користе за храну и која могу да буду штетна ако се акумулирају у ћелијама, јер немају метаболичке функције.Ове потенцијалне штетне материје се називају ксенобиотицима.[95] Ксенобиотици као што су синтетички лекови, природни отрови и антибиотици бивају детоксификовани посредством сета ксенобиотичких-метаболизирајућих ензима. Код људи, они обухватају цитохром П450 оксидазе,[96] UDP-глукуронозилтрансферазе,[97] и глутатион S-трансферазе.[98] Овај систем ензима делује у три ступња да прво оксидује ксенобиотик (фаза I) и затим конјугује у води растворне групе на молекул (фаза II). Модификовани у води растворни ксенобиотик затим може да буде испумпан из ћелије и у вишећелијским организмима може да буде даље метаболизован пре него што се излучи (фаза III). У екологији, те реакције су посебно важне при микробној биодеградацији загађивача и биоремедијацији контаминираног земљишта и нафтних изливања.[99] Многе од тих микробних реакција се одвијају и у вишећелијским организмима, али због невероватне разноликости врста микроба, ови организми су у стању да метаболизују далеко шири распон ксенобиотика од вишећелијских организама, и могу да деградирају чак и перзистентне органске загађиваче као што су органохлоридна једињења.[100]
Сродни проблем за аеробне организме је оксидативни стрес.[101] Овде, процеси који обухватају оксидативна фосфорилацију и формирање дисулфидних веза током протеинског савијања производе реактивне врсте кисеоника, као што је водоник пероксид.[102] Ови штетни оксиданси се уклањају помоћу антиоксидансних метаболита, као што је глутатион, и ензима, као што су каталазе и пероксидазе.[103][104]
Термодинамика живих организама
Живи организми морају да подлежу законима термодинамике, који описују трансфер топлоте и рада. Други принцип термодинамике налаже да у сваком затвореном систему, количина ентропије (нереда) не може да буде смањена. Мада изузетна комплексност живих организама наизглед стоји у контрадикцији са овим законом, живот је могућ јер су сви организми отворени системи који размењују материју и енергију са својим окружењем. Стога живући системи нису у еквилибријуму, већ су дисипативни системи који одржавају своје стање високе комплексности узрокујући велика повећања ентропије у својим окружењима.[105] Метаболизам ћелија остварује то спрезањем спонтаних процеса катаболизма са неспонтаним процесима анаболизма. У термодинамичком смислу, метаболизам одржава ред путем креирања нереда.[106]
Регулација и контрола
Како се окружења већине организама стално мењају, реакције метаболизма морају да буду деликатно регулисане да би се одржао константан сет услова унутар ћелија, стање које се назива хомеостаза.[107][108] Метаболичка регулација исто тако омогућава организмима да одговоре на сигнале и да формирају активне интеракције са својим окружењем.[109] Два блиско повезана концепта су важна за разумевање начина на који су метаболички путеви контролисани. Прво, регулација ензима у биохемијском пут је начин на који се његова активност повећава и умањује у респонсу на сигнале. Друго, контрола коју врши тај ензим је ефекат који те промене активности имају на свеукупну брзину пута (флукс кроз пут).[110] На пример, ензим може да испољи велике промене у активности (i.e. он је високо регулисан), али ако те промене имају мало утицаја на флукс метаболичког пута, онда тај ензим не учествује у контроли тог пута.[111]

Постоје вишеструки нивои метаболичке регулације. У унутрашњој регулацији, метаболички пут сам регулише одговоре на промене нивоа супстрата или продуката; на пример, смањење количине производа може повећати флукс кроз пут ради компензовања промене.[110] Овај тип регулације често обухвата алостерну регулацију активности вишеструких ензима на путу.[112] Спољашња контрола обухвата ћелију у вишећелијском организму која мења свој метаболизам као одговор на сигнале из других ћелија. Ти сигнали су обично у форми растворних гласника као што су хормони и фактори раста и њих детектују специфични рецептори на површини ћелије.[113] Ти сигнали се затим трансмитују унутар ћелије путем система секундарних гласника, што често обухвата фосфорилацију протеина.[114]
Врло добро разумљив пример екстерне контроле је регулација метаболизма глукозе помоћу хормона инсулина.[115] Инсулин се производи у респонсу на повећање у нивоу крвне глукозе. Везивање хормона за инсулинске рецепторе на ћелијама затим активира каскаду протеинских киназа, што узрокује да ћелија преузме глукозу и конвертује је у складишне молекуле као што су масне киселине и гликоген.[116] Метаболизам гликогена је контролисан активношћу фосфорилазе, ензима који разлаже гликоген, и гликогенске синтазе, ензима који посредује његово формирање. Ови ензими су регулисани у реципрочном маниру, при чему фосфорилација инхибира гликогенску синтазу, и активира фосфорилазу. Инсулин узрокује синтезу гликогена активирањем протеинске фосфатазе и производећи смањење фосфорилације тих ензима.[117]
Еволуција

Централни путеви метаболизма, који су описани горе, као што су гликолиза и циклус лимунске киселине, присутни су у сва три домена живих организама и били су присутни код задњег универзалног заједничког претка.[4][118] Та универзална предачка ћелија је била прокариотска и вероватно је била метаногена. Она је имала екстензивни аминокиселински, нуклеотидни, угљено хидратни и липидни метаболизам.[119][120] Задржавање ових древних путева током касније еволуције је вероватно последица тога да су ове реакције оптимално решење специфичног метаболичког проблема, при чему путеви као што су гликолиза и циклус лимунске киселине производе своје крајње производе веома ефикасно и у минималном броју корака.[5][6] Могуће је да су први путеви ензимски посредованог метаболизма били делови пуринског нуклеотидног метаболизма, док су претходни метаболички путеви били део древног РНК света.[121]
Многи модели су предложени за описивање механизама помоћу којих нови метаболички путеви еволуирају. Тиме је овухваћена секвенцијална адиција нових ензима на кратке предачке путеве, дупликација и затим дивергенција целокупних путева, као и регрутовање постојећих ензима и њихово састављање у нове реакционе путеве.[122] Релативна важност тих механизама није разјашњена, али су геномске студије показале да је за ензиме у путу вероватније да имају заједничко порекло, из чега произилази да су многи путеви еволуирали у корак-по-корак маниру, при чему су нове функције креиране из постојећих корака у путу.[123] Један алтернативни модел потиче из студије која прати еволуцију структура протеина у метаболичким мрежама. Тај модел сугерише да ензими у знатној мери бивају регрутовани или позајмљени да изводе сличне функције у различитим метаболичким путевима. Ово је евидентно у MANET бази података.[124] Ови процеси регрутовања доводе до еволуционог ензиматског мозаика.[125] Трећа могућност је да неки делови метаболизма могу да постоје као „модули” који се могу поново користити у различитим путевима и вршити сличне функције на различитим молекулима.[126]
Осим еволуције нових метаболичких путева, еволуција може изазвати и губитак метаболичких функција. На пример, у неким паразитима метаболички процеси који нису есенцијални за опстанак су изгубљени, и постојеће аминокиселине, нуклеотиди и угљени хидрати се уместо тога узимају од домаћина.[127] Сличне редуковане метаболичке способности су уочене код ендосимбиотских организама.[128]
Истраживања

Класично, метаболизам се проучаван користећи редукционистички приступ који је усредсрећен на појединачни метаболички пут. Посебно је вредна употреба радиоактивних обележивача на нивоима целог организма, ткива и ћелија, који дефинишу путеве од прекурзора до финалних продуката тако што идентификују радиоактивно обележне интермедијере и продукте.[129] Ензими који катализују ове хемијске реакције могу затим да буду пречишћени и њихова кинетика и респонси на инхибиторе истражени. Паралелни приступ је да се идентификују мали молекули у ћелијама или ткивима. Комплетан сет тих молекула се назива метаболом. Свеукупно, ове студије дају добар увид у структуру и функцију једноставних метаболичких путева, али су неадекватне кад се примене на комплексније системе као што је метаболизам комплетне ћелије.[130]
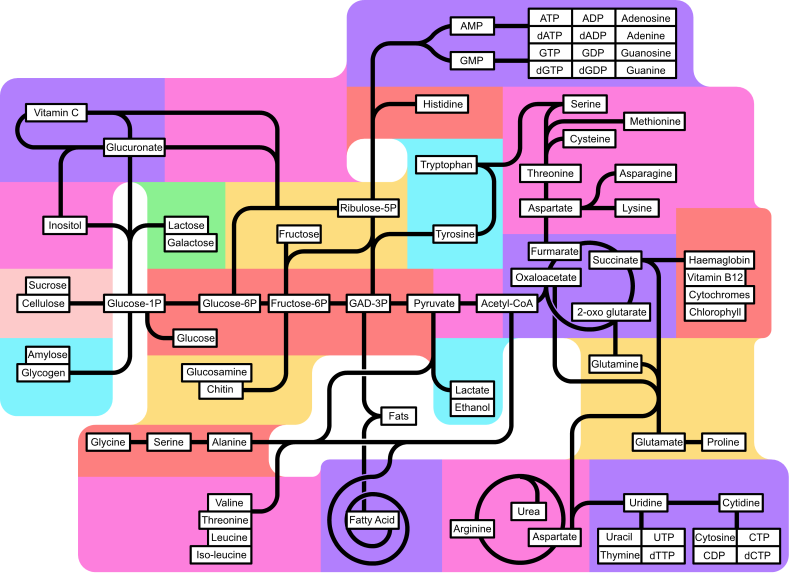
Идеја комплексности метаболичке мреже у ћелијама које садрже хиљаде различитих ензима је илустрована сликом на којој су приказане интеракције између само 43 протеина и 40 метаболита. Геномска секвенца садржи око 45.000 гена, знатан део којих бива изражен у специфичним ћелијским типовима.[131] У данашње време је могуће да се користе геномски подаци за реконструисање комплетних мрежа биохемијских реакција и да се формирају холистички математички модели, који боље објашњавају и предвиђају понашање метаболичких мрежа.[132] Ови модели су посебно корисни кад се користе при интеграцији биохемијских путева и метаболичких података прикупљених применом класичних метода са подацима о изражавањима гена из протеомских студија и из ДНК микрочипова.[133] Користећи те технике, произведен је модел људског метаболизма, који налази примену у усмеравању будућих активности на откривању лекова, као и у биохемијским истраживањима.[134] Ови математички модели се користе у анализи мрежа, за класификовање људских болести у групе са заједничким протеинима или метаболитима.[135][136]
Бактеријске метаболичке мреже су упечатљив пример такозване организације „лептир машне”[137][138][139], архитектуре која има способност уноса широког опсега нутријената и која производи мноштво разноврсних производа и сложених макромолекула користећи релативно мали број интермедијерних заједничких компоненти.
Главни вид технолошке примене ових информација је метаболички инжењеринг. Организми као што су квасац, биљке или бактерије се генетички модификују да би се учинили кориснијим у биотехнолошким применама и да би се омогућила продукција појединих лекова, као што су антибиотици, или индустријске хемикалије, као што су 1,3-пропандиол и шикиминска киселина.[140][141][142] Циљ генетичке модификације обично је да се редукују количина енергије која се користи при производњи производа, да се повећа принос и да се редукује настанак отпада.[143]
Историја
Историја истраживања метаболизма је пар миленијума дуга. Термин метаболизам је изведен из грчке речи Μεταβολισμός – Metabolismos са значењем „промена”, или „пребачај”.[144]


Аристотелов рад Делови животиња поставио је довољно детаља о његовом гледишту на метаболизам да се може формирати модел отвореног протока. Он је сматрао да у сваком ступњу процеса, материјали из хране бивају трансформисани, уз ослобађање топлоте као класичног елемента ватре, и уз излучивање резидуаланих материјала као што су урин, жуч, или фекалије.[145]
Један од раних концепата метаболизма сеже из 13. века од Ибн ал-Нафиса (1213-1288), који је установио да су тело и његови делови у сталном стању трошења енергије и храњења, па се стога у телу одвијају сталне промене.[146] Историја научног изучавања метаболизма обухвата неколико векова и прешла је са испитивања целих животиња у раним студијама, на испитивање индивидуалних метаболичких реакција у модерној биохемији. Први контролисани експеримент објавио је Санторио Санторио 1614. године у својој књизи Ars de statica medecina,[147] где је описао промене своје тежине пре и после јела, спавања, рада, полног односа, поста, пијења, напрезања. Открио је да већина поједене хране је изгубљена у процесу који је он назвао „инсензибилна перспирација“.
У тим раним студијама, механизам метаболичких процеса није био одређен, и сматрало се да витална сила анимира жива ткива.[148] У 19. веку је истраживањем алкохолног врења, претварања шећера у алкохол помоћу квасаца, Луј Пастер је закључио да врење катализује материја унутар гљивица, коју је назвао „фермент“.[149] Даље је закључио да је алкохолно врење процес повезан за животом ћелија гљивица, а не са смрћу ћелија. То откриће, заједно с радом Фридриха Велера из 1828. године о хемијској синтези урее,[150] доказало је да се органска једињења и хемијске реакције из ћелија не разликују у својим начелима од остале материје.
Откриће ензима на почетку 20. века (Едуард Бухнер) одвојило је истраживање хемијских реакција метаболизма од биолошког истраживања ћелије и означило настанак биохемије.[151] У бројним открићима на подручју биохемије у првој пловини 20. века, посебно се истиче оно Ханса Кребса, који је направио огромне доприносе изучавању метаболизма.[152] Он је открио циклус урее[153] и касније, радећи са Хансом Корнбергом, циклус лимунске киселине и циклус глиоксилата.[154][155][54] Модерна биохемијска истраживања су значајно напредовала употребом нових техника хроматографије, дифракције x-зрака, НМР спектроскопије, радиоизотопног означавања, електронске микроскопије и молекуларно динамичких симулација. Ове технике су омогућиле откриће и детаљну анализу многих молекула и метаболичких путева у ћелијама.
Види још
Референце
- ^ Voet D, Voet J (1995). Biochemistry (2 изд.). Wiley.
- ^ а б Friedrich, C. (1998). „Physiology and genetics of sulfur-oxidizing bacteria”. Adv Microb Physiol. Advances in Microbial Physiology. 39: 235—89. ISBN 9780120277391. PMID 9328649. doi:10.1016/S0065-2911(08)60018-1.
- ^ Pace, N. R. (2001). „The universal nature of biochemistry”. Proc. Natl. Acad. Sci. U.S.A. 98 (3): 805—8. Bibcode:2001PNAS...98..805P. PMC 33372
 . PMID 11158550. doi:10.1073/pnas.98.3.805.
. PMID 11158550. doi:10.1073/pnas.98.3.805.
- ^ а б Smith E, Morowitz H (2004). „Universality in intermediary metabolism”. Proc Natl Acad Sci USA. 101 (36): 13168—73. Bibcode:2004PNAS..10113168S. PMC 516543
 . PMID 15340153. doi:10.1073/pnas.0404922101.
. PMID 15340153. doi:10.1073/pnas.0404922101.
- ^ а б Ebenhöh O, Heinrich R (2001). „Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems”. Bull Math Biol. 63 (1): 21—55. PMID 11146883. doi:10.1006/bulm.2000.0197.
- ^ а б Meléndez-Hevia E, Waddell T, Cascante M (1996). „The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution”. J Mol Evol. 43 (3): 293—303. PMID 8703096. doi:10.1007/BF02338838.
- ^ Michie K, Löwe J (2006). „Dynamic filaments of the bacterial cytoskeleton”. Annu Rev Biochem. 75: 467—92. PMID 16756499. doi:10.1146/annurev.biochem.75.103004.142452.
- ^ а б в г д Nelson 2005, стр. 841
- ^ Kelleher J, Bryan 3rd B, Mallet R, Holleran A, Murphy A, Fiskum G (1987). „Analysis of tricarboxylic acid-cycle metabolism of hepatoma cells by comparison of 14CO2 ratios”. Biochem J. 246 (3): 633—639. PMC 346906
 . PMID 6752947.
. PMID 6752947.
- ^ Hothersall J, Ahmed A (2013). „Metabolic fate of the increased yeast amino acid uptake subsequent to catabolite derepression”. J Amino Acids. 2013: e461901. PMC 3575661
 . PMID 23431419. doi:10.1155/2013/461901.
. PMID 23431419. doi:10.1155/2013/461901.
- ^ Fahy E, Subramaniam S, Brown H, Glass C, Merrill A, Murphy R, Raetz C, Russell D, Seyama Y, Shaw W, Shimizu T, Spener F, van Meer G, VanNieuwenhze M, White S, Witztum J, Dennis E (2005). „A comprehensive classification system for lipids”. J Lipid Res. 46 (5): 839—61. PMID 15722563. doi:10.1194/jlr.E400004-JLR200.
- ^ „Nomenclature of Lipids”. IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Приступљено 8. 3. 2007.
- ^ Hegardt, F. (1999). „Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis”. Biochem J. 338 (Pt 3): 569—82. PMC 1220089
 . PMID 10051425. doi:10.1042/0264-6021:3380569.
. PMID 10051425. doi:10.1042/0264-6021:3380569.
- ^ Raman R, Raguram S, Venkataraman G, Paulson J, Sasisekharan R (2005). „Glycomics: an integrated systems approach to structure-function relationships of glycans”. Nat Methods. 2 (11): 817—24. PMID 16278650. doi:10.1038/nmeth807.
- ^ Sierra S, Kupfer B, Kaiser R (2005). „Basics of the virology of HIV-1 and its replication”. J Clin Virol. 34 (4): 233—44. PMID 16198625. doi:10.1016/j.jcv.2005.09.004.
- ^ а б Wimmer M, Rose I (1978). „Mechanisms of enzyme-catalyzed group transfer reactions”. Annu Rev Biochem. 47: 1031—78. PMID 354490. doi:10.1146/annurev.bi.47.070178.005123.
- ^ Mitchell, P. (1979). „The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems”. Eur J Biochem. 95 (1): 1—20. PMID 378655. doi:10.1111/j.1432-1033.1979.tb12934.x.
- ^ а б в г Dimroth P, von Ballmoos C, Meier T (2006). „Catalytic and mechanical cycles in F-ATP synthases: Fourth in the Cycles Review Series”. EMBO Rep. 7 (3): 276—82. PMC 1456893
 . PMID 16607397. doi:10.1038/sj.embor.7400646.
. PMID 16607397. doi:10.1038/sj.embor.7400646.
- ^ Coulston, Kerner & Hattner 2006
- ^ Pollak N, Dölle C, Ziegler M (2007). „The power to reduce: pyridine nucleotides – small molecules with a multitude of functions”. Biochem J. 402 (2): 205—18. PMC 1798440
 . PMID 17295611. doi:10.1042/BJ20061638.
. PMID 17295611. doi:10.1042/BJ20061638.
- ^ а б Heymsfield S, Waki M, Kehayias J, Lichtman S, Dilmanian F, Kamen Y, Wang J, Pierson R (1991). „Chemical and elemental analysis of humans in vivo using improved body composition models”. Am J Physiol. 261 (2 Pt 1): E190—8. PMID 1872381.
- ^ Sychrová, H. (2004). „Yeast as a model organism to study transport and homeostasis of alkali metal cations” (PDF). Physiol Res. 53 Suppl 1: S91—8. PMID 15119939.
- ^ Levitan, I. (1988). „Modulation of ion channels in neurons and other cells”. Annu Rev Neurosci. 11: 119—36. PMID 2452594. doi:10.1146/annurev.ne.11.030188.001003.
- ^ Dulhunty, A. (2006). „Excitation-contraction coupling from the 1950s into the new millennium”. Clin Exp Pharmacol Physiol. 33 (9): 763—72. PMID 16922804. doi:10.1111/j.1440-1681.2006.04441.x.
- ^ Mahan D, Shields R (1998). „Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight”. J Anim Sci. 76 (2): 506—12. PMID 9498359.
- ^ Husted S, Mikkelsen B, Jensen J, Nielsen N (2004). „Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics”. Anal Bioanal Chem. 378 (1): 171—82. PMID 14551660. doi:10.1007/s00216-003-2219-0.
- ^ Finney L, O'Halloran T (2003). „Transition metal speciation in the cell: insights from the chemistry of metal ion receptors”. Science. 300 (5621): 931—6. Bibcode:2003Sci...300..931F. PMID 12738850. doi:10.1126/science.1085049.
- ^ Cousins R, Liuzzi J, Lichten L (2006). „Mammalian zinc transport, trafficking, and signals”. J Biol Chem. 281 (34): 24085—9. PMID 16793761. doi:10.1074/jbc.R600011200.
- ^ Dunn L, Rahmanto Y, Richardson D (2007). „Iron uptake and metabolism in the new millennium”. Trends Cell Biol. 17 (2): 93—100. PMID 17194590. doi:10.1016/j.tcb.2006.12.003.
- ^ „Metabolizam i faktori koji utiču na brzinu metabolizma - Dijeta.net”. Dijeta.net (на језику: српски). 04. 09. 2016. Приступљено 01. 03. 2018.
- ^ Nealson K, Conrad P (1999). „Life: past, present and future”. Philos Trans R Soc Lond B Biol Sci. 354 (1392): 1923—39. PMC 1692713
 . PMID 10670014. doi:10.1098/rstb.1999.0532.
. PMID 10670014. doi:10.1098/rstb.1999.0532.
- ^ а б Nelson N, Ben-Shem A (2004). „The complex architecture of oxygenic photosynthesis”. Nat Rev Mol Cell Biol. 5 (12): 971—82. PMID 15573135. doi:10.1038/nrm1525.
- ^ Häse C, Finkelstein R (децембар 1993). „Bacterial extracellular zinc-containing metalloproteases”. Microbiol Rev. 57 (4): 823—37. PMC 372940
 . PMID 8302217.
. PMID 8302217.
- ^ Gupta R, Gupta N, Rathi P (2004). „Bacterial lipases: an overview of production, purification and biochemical properties”. Appl Microbiol Biotechnol. 64 (6): 763—81. PMID 14966663. doi:10.1007/s00253-004-1568-8.
- ^ Hoyle T (1997). „The digestive system: linking theory and practice”. Br J Nurs. 6 (22): 1285—91. PMID 9470654.
- ^ Souba W, Pacitti A (1992). „How amino acids get into cells: mechanisms, models, menus, and mediators”. JPEN J Parenter Enteral Nutr. 16 (6): 569—78. PMID 1494216. doi:10.1177/0148607192016006569.
- ^ Barrett M, Walmsley A, Gould G (1999). „Structure and function of facilitative sugar transporters”. Curr Opin Cell Biol. 11 (4): 496—502. PMID 10449337. doi:10.1016/S0955-0674(99)80072-6.
- ^ Bell G, Burant C, Takeda J, Gould G (1993). „Structure and function of mammalian facilitative sugar transporters”. J Biol Chem. 268 (26): 19161—4. PMID 8366068.
- ^ а б Bouché C, Serdy S, Kahn C, Goldfine A (2004). „The cellular fate of glucose and its relevance in type 2 diabetes”. Endocr Rev. 25 (5): 807—30. PMID 15466941. doi:10.1210/er.2003-0026.
- ^ Wipperman, Matthew, F.; Thomas, Suzanne, T.; Sampson, Nicole, S. (2014). „Pathogen roid rage: Cholesterol utilization by Mycobacterium tuberculosis”. Crit. Rev. Biochem. Mol. Biol. 49 (4): 269—93. PMC 4255906
 . PMID 24611808. doi:10.3109/10409238.2014.895700.
. PMID 24611808. doi:10.3109/10409238.2014.895700.
- ^ Sakami W, Harrington H (1963). „Amino acid metabolism”. Annu Rev Biochem. 32: 355—98. PMID 14144484. doi:10.1146/annurev.bi.32.070163.002035.
- ^ Brosnan J (2000). „Glutamate, at the interface between amino acid and carbohydrate metabolism”. J Nutr. 130 (4S Suppl): 988S—90S. PMID 10736367.
- ^ Young V, Ajami A (2001). „Glutamine: the emperor or his clothes?”. J Nutr. 131 (9 Suppl): 2449S—59S; discussion 2486S—7S. PMID 11533293.
- ^ Miziorko H, Lorimer G (1983). „Ribulose-1,5-bisphosphate carboxylase-oxygenase”. Annu Rev Biochem. 52: 507—35. PMID 6351728. doi:10.1146/annurev.bi.52.070183.002451.
- ^ Dodd A, Borland A, Haslam R, Griffiths H, Maxwell K (2002). „Crassulacean acid metabolism: plastic, fantastic”. J Exp Bot. 53 (369): 569—80. PMID 11886877. doi:10.1093/jexbot/53.369.569.
- ^ Hügler M, Wirsen C, Fuchs G, Taylor C, Sievert S (мај 2005). „Evidence for Autotrophic CO2 Fixation via the Reductive Tricarboxylic Acid Cycle by Members of the ɛ Subdivision of Proteobacteria”. J Bacteriol. 187 (9): 3020—7. PMC 1082812
 . PMID 15838028. doi:10.1128/JB.187.9.3020-3027.2005.
. PMID 15838028. doi:10.1128/JB.187.9.3020-3027.2005.
- ^ Strauss G, Fuchs G (1993). „Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle”. Eur J Biochem. 215 (3): 633—43. PMID 8354269. doi:10.1111/j.1432-1033.1993.tb18074.x.
- ^ Wood H (1991). „Life with CO or CO2 and H2 as a source of carbon and energy”. FASEB J. 5 (2): 156—63. PMID 1900793.
- ^ Shively J, van Keulen G, Meijer W (1998). „Something from almost nothing: carbon dioxide fixation in chemoautotrophs”. Annu Rev Microbiol. 52: 191—230. PMID 9891798. doi:10.1146/annurev.micro.52.1.191.
- ^ Boiteux A, Hess B (1981). „Design of glycolysis”. Philos Trans R Soc Lond B Biol Sci. 293 (1063): 5—22. Bibcode:1981RSPTB.293....5B. PMID 6115423. doi:10.1098/rstb.1981.0056.
- ^ Pilkis S, el-Maghrabi M, Claus T (1990). „Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics”. Diabetes Care. 13 (6): 582—99. PMID 2162755. doi:10.2337/diacare.13.6.582.
- ^ а б Ensign S (2006). „Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation”. Mol Microbiol. 61 (2): 274—6. PMID 16856935. doi:10.1111/j.1365-2958.2006.05247.x.
- ^ Finn P, Dice J (2006). „Proteolytic and lipolytic responses to starvation”. Nutrition. 22 (7–8): 830—44. PMID 16815497. doi:10.1016/j.nut.2006.04.008.
- ^ а б Kornberg H, Krebs H (1957). „Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle”. Nature. 179 (4568): 988—91. Bibcode:1957Natur.179..988K. PMID 13430766. doi:10.1038/179988a0.
- ^ Rademacher T, Parekh R, Dwek R (1988). „Glycobiology”. Annu Rev Biochem. 57: 785—838. PMID 3052290. doi:10.1146/annurev.bi.57.070188.004033.
- ^ Opdenakker G, Rudd P, Ponting C, Dwek R (1993). „Concepts and principles of glycobiology”. FASEB J. 7 (14): 1330—7. PMID 8224606.
- ^ McConville M, Menon A (2000). „Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review)”. Mol Membr Biol. 17 (1): 1—16. PMID 10824734. doi:10.1080/096876800294443.
- ^ Chirala S, Wakil S (2004). „Structure and function of animal fatty acid synthase”. Lipids. 39 (11): 1045—53. PMID 15726818. doi:10.1007/s11745-004-1329-9.
- ^ White S, Zheng J, Zhang Y (2005). „The structural biology of type II fatty acid biosynthesis”. Annu Rev Biochem. 74: 791—831. PMID 15952903. doi:10.1146/annurev.biochem.74.082803.133524.
- ^ Ohlrogge J, Jaworski J (1997). „Regulation of fatty acid synthesis”. Annu Rev Plant Physiol Plant Mol Biol. 48: 109—136. PMID 15012259. doi:10.1146/annurev.arplant.48.1.109.
- ^ Dubey V, Bhalla R, Luthra R (2003). „An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants” (PDF). J Biosci. 28 (5): 637—46. PMID 14517367. doi:10.1007/BF02703339. Архивирано из оригинала (PDF) 2007-04-15. г.
- ^ а б Kuzuyama T, Seto H (2003). „Diversity of the biosynthesis of the isoprene units”. Nat Prod Rep. 20 (2): 171—83. PMID 12735695. doi:10.1039/b109860h.
- ^ Grochowski L, Xu H, White R (мај 2006). „Methanocaldococcus jannaschii Uses a Modified Mevalonate Pathway for Biosynthesis of Isopentenyl Diphosphate”. J Bacteriol. 188 (9): 3192—8. PMC 1447442
 . PMID 16621811. doi:10.1128/JB.188.9.3192-3198.2006.
. PMID 16621811. doi:10.1128/JB.188.9.3192-3198.2006.
- ^ Lichtenthaler H (1999). „The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants”. Annu Rev Plant Physiol Plant Mol Biol. 50: 47—65. PMID 15012203. doi:10.1146/annurev.arplant.50.1.47.
- ^ а б Schroepfer G (1981). „Sterol biosynthesis”. Annu Rev Biochem. 50: 585—621. PMID 7023367. doi:10.1146/annurev.bi.50.070181.003101.
- ^ Lees N, Skaggs B, Kirsch D, Bard M (1995). „Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review”. Lipids. 30 (3): 221—6. PMID 7791529. doi:10.1007/BF02537824.
- ^ Himmelreich R, Hilbert H, Plagens H, Pirkl E, Li BC, Herrmann R (новембар 1996). „Complete sequence analysis of the genome of the bacterium Mycoplasma pneumoniae”. Nucleic Acids Res. 24 (22): 4420—49. PMC 146264
 . PMID 8948633. doi:10.1093/nar/24.22.4420.
. PMID 8948633. doi:10.1093/nar/24.22.4420.
- ^ Guyton, Arthur C.; John E. Hall (2006). Textbook of Medical Physiology. Philadelphia: Elsevier. стр. 855—6. ISBN 0-7216-0240-1.
- ^ Ibba M, Söll D (2001). „The renaissance of aminoacyl-tRNA synthesis”. EMBO Rep. 2 (5): 382—7. PMC 1083889
 . PMID 11375928. doi:10.1093/embo-reports/kve095. Архивирано из оригинала 2011-05-01. г.
. PMID 11375928. doi:10.1093/embo-reports/kve095. Архивирано из оригинала 2011-05-01. г.
- ^ Lengyel P, Söll D (1969). „Mechanism of protein biosynthesis”. Bacteriol Rev. 33 (2): 264—301. PMC 378322
 . PMID 4896351.
. PMID 4896351.
- ^ а б Rudolph F (1994). „The biochemistry and physiology of nucleotides”. J Nutr. 124 (1 Suppl): 124S—127S. PMID 8283301. Zrenner R, Stitt M, Sonnewald U, Boldt R (2006). „Pyrimidine and purine biosynthesis and degradation in plants”. Annu Rev Plant Biol. 57: 805—36. PMID 16669783. doi:10.1146/annurev.arplant.57.032905.105421.
- ^ Stasolla C, Katahira R, Thorpe T, Ashihara H (2003). „Purine and pyrimidine nucleotide metabolism in higher plants”. J Plant Physiol. 160 (11): 1271—95. PMID 14658380. doi:10.1078/0176-1617-01169.
- ^ Davies O, Mendes P, Smallbone K, Malys N (2012). „Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism”. BMB Reports. 45 (4): 259—64. PMID 22531138. doi:10.5483/BMBRep.2012.45.4.259.
- ^ Smith J (1995). „Enzymes of nucleotide synthesis”. Curr Opin Struct Biol. 5 (6): 752—7. PMID 8749362. doi:10.1016/0959-440X(95)80007-7.
- ^ Capaldi R, Aggeler R (2002). „Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor”. Trends Biochem Sci. 27 (3): 154—60. PMID 11893513. doi:10.1016/S0968-0004(01)02051-5.
- ^ Hosler J, Ferguson-Miller S, Mills D (2006). „Energy Transduction: Proton Transfer Through the Respiratory Complexes”. Annu Rev Biochem. 75: 165—87. PMC 2659341
 . PMID 16756489. doi:10.1146/annurev.biochem.75.062003.101730.
. PMID 16756489. doi:10.1146/annurev.biochem.75.062003.101730.
- ^ Schultz B, Chan S (2001). „Structures and proton-pumping strategies of mitochondrial respiratory enzymes”. Annu Rev Biophys Biomol Struct. 30: 23—65. PMID 11340051. doi:10.1146/annurev.biophys.30.1.23.
- ^ Friedrich B, Schwartz E (1993). „Molecular biology of hydrogen utilization in aerobic chemolithotrophs”. Annu Rev Microbiol. 47: 351—83. PMID 8257102. doi:10.1146/annurev.mi.47.100193.002031.
- ^ Weber K, Achenbach L, Coates J (2006). „Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction”. Nat Rev Microbiol. 4 (10): 752—64. PMID 16980937. doi:10.1038/nrmicro1490.
- ^ Jetten M, Strous M, van de Pas-Schoonen K, Schalk J, van Dongen U, van de Graaf A, Logemann S, Muyzer G, van Loosdrecht M, Kuenen J (1998). „The anaerobic oxidation of ammonium”. FEMS Microbiol Rev. 22 (5): 421—37. PMID 9990725. doi:10.1111/j.1574-6976.1998.tb00379.x.
- ^ Simon J (2002). „Enzymology and bioenergetics of respiratory nitrite ammonification”. FEMS Microbiol Rev. 26 (3): 285—309. PMID 12165429. doi:10.1111/j.1574-6976.2002.tb00616.x.
- ^ Conrad R (1996). „Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)”. Microbiol Rev. 60 (4): 609—40. PMC 239458
 . PMID 8987358.
. PMID 8987358.
- ^ Barea J, Pozo M, Azcón R, Azcón-Aguilar C (2005). „Microbial co-operation in the rhizosphere”. J Exp Bot. 56 (417): 1761—78. PMID 15911555. doi:10.1093/jxb/eri197.
- ^ D.A. Bryant & N.-U. Frigaard (новембар 2006). „Prokaryotic photosynthesis and phototrophy illuminated”. Trends Microbiol. 14 (11): 488—96. PMID 16997562. doi:10.1016/j.tim.2006.09.001.
- ^ A. A. Tsygankov; A. N. Khusnutdinova (јануар 2015). „Hydrogen in metabolism of purple bacteria and prospects of practical application”. Microbiology. 84 (1): 1—22. doi:10.1134/S0026261715010154. Приступљено 8. 10. 2017.
- ^ Green BR (2003). Light-Harvesting Antennas in Photosynthesis. стр. 8. ISBN 0792363353.
- ^ Sakurai H, Ogawa T, Shiga M, Inoue K (јун 2010). „Inorganic sulfur oxidizing system in green sulfur bacteria”. Photosynthesis Research. 104 (2–3): 163—76. PMID 20143161. doi:10.1007/s11120-010-9531-2.
- ^ van der Meer M, Schouten S, Bateson M, Nübel U, Wieland A, Kühl M, de Leeuw J, Sinninghe Damsté J, Ward D (јул 2005). „Diel Variations in Carbon Metabolism by Green Nonsulfur-Like Bacteria in Alkaline Siliceous Hot Spring Microbial Mats from Yellowstone National Park”. Appl Environ Microbiol. 71 (7): 3978—86. PMC 1168979
 . PMID 16000812. doi:10.1128/AEM.71.7.3978-3986.2005.
. PMID 16000812. doi:10.1128/AEM.71.7.3978-3986.2005.
- ^ Tichi M, Tabita F (2001). „Interactive Control of Rhodobacter capsulatus Redox-Balancing Systems during Phototrophic Metabolism”. J Bacteriol. 183 (21): 6344—54. PMC 100130
 . PMID 11591679. doi:10.1128/JB.183.21.6344-6354.2001.
. PMID 11591679. doi:10.1128/JB.183.21.6344-6354.2001.
- ^ Allen J, Williams J (1998). „Photosynthetic reaction centers”. FEBS Lett. 438 (1–2): 5—9. PMID 9821949. doi:10.1016/S0014-5793(98)01245-9.
- ^ Munekage Y, Hashimoto M, Miyake C, Tomizawa K, Endo T, Tasaka M, Shikanai T (2004). „Cyclic electron flow around photosystem I is essential for photosynthesis”. Nature. 429 (6991): 579—82. Bibcode:2004Natur.429..579M. PMID 15175756. doi:10.1038/nature02598.
- ^ Steven B. Carroll; Steven D. Salt (2004). Ecology for gardeners. Timber Press. стр. 93. ISBN 978-0-88192-611-8.
- ^ Kuypers, MMM; Marchant, HK; Kartal, B (2011). „The Microbial Nitrogen-Cycling Network”. Nature Reviews Microbiology. 1 (1): 1—14. PMID 29398704. doi:10.1038/nrmicro.2018.9.
- ^ Galloway, J. N.; et al. (2004). „Nitrogen cycles: past, present, and future generations”. Biogeochemistry. 70: 153—226. doi:10.1007/s10533-004-0370-0.
- ^ Testa B, Krämer S (2006). „The biochemistry of drug metabolism—an introduction: part 1. Principles and overview”. Chem Biodivers. 3 (10): 1053—101. PMID 17193224. doi:10.1002/cbdv.200690111.
- ^ Danielson P (2002). „The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans”. Curr Drug Metab. 3 (6): 561—97. PMID 12369887. doi:10.2174/1389200023337054.
- ^ King C, Rios G, Green M, Tephly T (2000). „UDP-glucuronosyltransferases”. Curr Drug Metab. 1 (2): 143—61. PMID 11465080. doi:10.2174/1389200003339171.
- ^ Sheehan D, Meade G, Foley V, Dowd C (новембар 2001). „Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily”. Biochem J. 360 (Pt 1): 1—16. PMC 1222196
 . PMID 11695986. doi:10.1042/0264-6021:3600001.
. PMID 11695986. doi:10.1042/0264-6021:3600001.
- ^ Galvão T, Mohn W, de Lorenzo V (2005). „Exploring the microbial biodegradation and biotransformation gene pool”. Trends Biotechnol. 23 (10): 497—506. PMID 16125262. doi:10.1016/j.tibtech.2005.08.002.
- ^ Janssen D, Dinkla I, Poelarends G, Terpstra P (2005). „Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities”. Environ Microbiol. 7 (12): 1868—82. PMID 16309386. doi:10.1111/j.1462-2920.2005.00966.x.
- ^ Davies K (1995). „Oxidative stress: the paradox of aerobic life”. Biochem Soc Symp. 61: 1—31. PMID 8660387. doi:10.1042/bss0610001.
- ^ Tu B, Weissman J (2004). „Oxidative protein folding in eukaryotes: mechanisms and consequences”. J Cell Biol. 164 (3): 341—6. PMC 2172237
 . PMID 14757749. doi:10.1083/jcb.200311055.
. PMID 14757749. doi:10.1083/jcb.200311055.
- ^ Sies H (1997). „Oxidative stress: oxidants and antioxidants” (PDF). Exp Physiol. 82 (2): 291—5. PMID 9129943. doi:10.1113/expphysiol.1997.sp004024.
- ^ Vertuani S, Angusti A, Manfredini S (2004). „The antioxidants and pro-antioxidants network: an overview”. Curr Pharm Des. 10 (14): 1677—94. PMID 15134565. doi:10.2174/1381612043384655.
- ^ von Stockar U, Liu J (1999). „Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth”. Biochim Biophys Acta. 1412 (3): 191—211. PMID 10482783. doi:10.1016/S0005-2728(99)00065-1.
- ^ Demirel Y, Sandler S (2002). „Thermodynamics and bioenergetics”. Biophys Chem. 97 (2–3): 87—111. PMID 12050002. doi:10.1016/S0301-4622(02)00069-8.
- ^ Albert R (2005). „Scale-free networks in cell biology”. J Cell Sci. 118 (Pt 21): 4947—57. PMID 16254242. doi:10.1242/jcs.02714.
- ^ Brand M (1997). „Regulation analysis of energy metabolism”. J Exp Biol. 200 (Pt 2): 193—202. PMID 9050227.
- ^ Soyer O, Salathé M, Bonhoeffer S (2006). „Signal transduction networks: topology, response and biochemical processes”. J Theor Biol. 238 (2): 416—25. PMID 16045939. doi:10.1016/j.jtbi.2005.05.030.
- ^ а б Salter M, Knowles R, Pogson C (1994). „Metabolic control”. Essays Biochem. 28: 1—12. PMID 7925313.
- ^ Westerhoff H, Groen A, Wanders R (1984). „Modern theories of metabolic control and their applications (review)”. Biosci Rep. 4 (1): 1—22. PMID 6365197. doi:10.1007/BF01120819.
- ^ Fell D, Thomas S (1995). „Physiological control of metabolic flux: the requirement for multisite modulation”. Biochem J. 311 (Pt 1): 35—9. PMC 1136115
 . PMID 7575476.
. PMID 7575476.
- ^ Hendrickson W (2005). „Transduction of biochemical signals across cell membranes”. Q Rev Biophys. 38 (4): 321—30. PMID 16600054. doi:10.1017/S0033583506004136.
- ^ Cohen P (2000). „The regulation of protein function by multisite phosphorylation—a 25 year update”. Trends Biochem Sci. 25 (12): 596—601. PMID 11116185. doi:10.1016/S0968-0004(00)01712-6.
- ^ Lienhard G, Slot J, James D, Mueckler M (1992). „How cells absorb glucose”. Sci Am. 266 (1): 86—91. PMID 1734513. doi:10.1038/scientificamerican0192-86.
- ^ Roach P (2002). „Glycogen and its metabolism”. Curr Mol Med. 2 (2): 101—20. PMID 11949930. doi:10.2174/1566524024605761.
- ^ Newgard C, Brady M, O'Doherty R, Saltiel A (2000). „Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1” (PDF). Diabetes. 49 (12): 1967—77. PMID 11117996. doi:10.2337/diabetes.49.12.1967.
- ^ Romano A, Conway T (1996). „Evolution of carbohydrate metabolic pathways”. Res Microbiol. 147 (6–7): 448—55. PMID 9084754. doi:10.1016/0923-2508(96)83998-2.
- ^ Koch A (1998). „How did bacteria come to be?”. Adv Microb Physiol. Advances in Microbial Physiology. 40: 353—99. ISBN 978-0-12-027740-7. PMID 9889982. doi:10.1016/S0065-2911(08)60135-6.
- ^ Ouzounis C, Kyrpides N (1996). „The emergence of major cellular processes in evolution”. FEBS Lett. 390 (2): 119—23. PMID 8706840. doi:10.1016/0014-5793(96)00631-X.
- ^ Caetano-Anolles G, Kim HS, Mittenthal JE (2007). „The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture”. Proc Natl Acad Sci USA. 104 (22): 9358—63. Bibcode:2007PNAS..104.9358C. PMC 1890499
 . PMID 17517598. doi:10.1073/pnas.0701214104.
. PMID 17517598. doi:10.1073/pnas.0701214104.
- ^ Schmidt S, Sunyaev S, Bork P, Dandekar T (2003). „Metabolites: a helping hand for pathway evolution?”. Trends Biochem Sci. 28 (6): 336—41. PMID 12826406. doi:10.1016/S0968-0004(03)00114-2.
- ^ Light S, Kraulis P (2004). „Network analysis of metabolic enzyme evolution in Escherichia coli”. BMC Bioinformatics. 5: 15. PMC 394313
 . PMID 15113413. doi:10.1186/1471-2105-5-15. Alves R, Chaleil R, Sternberg M (2002). „Evolution of enzymes in metabolism: a network perspective”. J Mol Biol. 320 (4): 751—70. PMID 12095253. doi:10.1016/S0022-2836(02)00546-6.
. PMID 15113413. doi:10.1186/1471-2105-5-15. Alves R, Chaleil R, Sternberg M (2002). „Evolution of enzymes in metabolism: a network perspective”. J Mol Biol. 320 (4): 751—70. PMID 12095253. doi:10.1016/S0022-2836(02)00546-6.
- ^ Kim HS, Mittenthal JE, Caetano-Anolles G (2006). „MANET: tracing evolution of protein architecture in metabolic networks”. BMC Bioinformatics. 7: 351. PMC 1559654
 . PMID 16854231. doi:10.1186/1471-2105-7-351.
. PMID 16854231. doi:10.1186/1471-2105-7-351.
- ^ Teichmann SA, Rison SC, Thornton JM, Riley M, Gough J, Chothia C (2001). „Small-molecule metabolsim: an enzyme mosaic”. Trends Biotechnol. 19 (12): 482—6. PMID 11711174. doi:10.1016/S0167-7799(01)01813-3.
- ^ Spirin V, Gelfand M, Mironov A, Mirny L (јун 2006). „A metabolic network in the evolutionary context: Multiscale structure and modularity”. Proc Natl Acad Sci USA. 103 (23): 8774—9. Bibcode:2006PNAS..103.8774S. PMC 1482654
 . PMID 16731630. doi:10.1073/pnas.0510258103.
. PMID 16731630. doi:10.1073/pnas.0510258103.
- ^ Lawrence J (2005). „Common themes in the genome strategies of pathogens”. Curr Opin Genet Dev. 15 (6): 584—8. PMID 16188434. doi:10.1016/j.gde.2005.09.007. Wernegreen J (2005). „For better or worse: genomic consequences of intracellular mutualism and parasitism”. Curr Opin Genet Dev. 15 (6): 572—83. PMID 16230003. doi:10.1016/j.gde.2005.09.013.
- ^ Pál C, Papp B, Lercher M, Csermely P, Oliver S, Hurst L (2006). „Chance and necessity in the evolution of minimal metabolic networks”. Nature. 440 (7084): 667—70. Bibcode:2006Natur.440..667P. PMID 16572170. doi:10.1038/nature04568.
- ^ Rennie M (1999). „An introduction to the use of tracers in nutrition and metabolism”. Proc Nutr Soc. 58 (4): 935—44. PMID 10817161. doi:10.1017/S002966519900124X.
- ^ Phair R (1997). „Development of kinetic models in the nonlinear world of molecular cell biology”. Metabolism. 46 (12): 1489—95. PMID 9439549. doi:10.1016/S0026-0495(97)90154-2.
- ^ Sterck L, Rombauts S, Vandepoele K, Rouzé P, Van de Peer Y (2007). „How many genes are there in plants (... and why are they there)?”. Curr Opin Plant Biol. 10 (2): 199—203. PMID 17289424. doi:10.1016/j.pbi.2007.01.004.
- ^ Borodina I, Nielsen J (2005). „From genomes to in silico cells via metabolic networks”. Curr Opin Biotechnol. 16 (3): 350—5. PMID 15961036. doi:10.1016/j.copbio.2005.04.008.
- ^ Gianchandani E, Brautigan D, Papin J (2006). „Systems analyses characterize integrated functions of biochemical networks”. Trends Biochem Sci. 31 (5): 284—91. PMID 16616498. doi:10.1016/j.tibs.2006.03.007.
- ^ Duarte NC, Becker SA, Jamshidi N, et al. (фебруар 2007). „Global reconstruction of the human metabolic network based on genomic and bibliomic data”. Proc. Natl. Acad. Sci. U.S.A. 104 (6): 1777—82. Bibcode:2007PNAS..104.1777D. PMC 1794290
 . PMID 17267599. doi:10.1073/pnas.0610772104.
. PMID 17267599. doi:10.1073/pnas.0610772104.
- ^ Goh KI, Cusick ME, Valle D, Childs B, Vidal M, Barabási AL (мај 2007). „The human disease network”. Proc. Natl. Acad. Sci. U.S.A. 104 (21): 8685—90. Bibcode:2007PNAS..104.8685G. PMC 1885563
 . PMID 17502601. doi:10.1073/pnas.0701361104.
. PMID 17502601. doi:10.1073/pnas.0701361104.
- ^ Lee DS, Park J, Kay KA, Christakis NA, Oltvai ZN, Barabási AL (јул 2008). „The implications of human metabolic network topology for disease comorbidity”. Proc. Natl. Acad. Sci. U.S.A. 105 (29): 9880—9885. Bibcode:2008PNAS..105.9880L. PMC 2481357
 . PMID 18599447. doi:10.1073/pnas.0802208105.
. PMID 18599447. doi:10.1073/pnas.0802208105.
- ^ Csete M, Doyle J (2004). „Bow ties, metabolism and disease”. Trends Biotechnol. 22 (9): 446—50. PMID 15331224. doi:10.1016/j.tibtech.2004.07.007.
- ^ Ma HW, Zeng AP (2003). „The connectivity structure, giant strong component and centrality of metabolic networks”. Bioinformatics. 19 (11): 1423—30. CiteSeerX 10.1.1.605.8964
 . PMID 12874056. doi:10.1093/bioinformatics/btg177.
. PMID 12874056. doi:10.1093/bioinformatics/btg177.
- ^ Zhao J, Yu H, Luo JH, Cao ZW, Li YX (2006). „Hierarchical modularity of nested bow-ties in metabolic networks”. BMC Bioinformatics. 7: 386. PMC 1560398
 . PMID 16916470. doi:10.1186/1471-2105-7-386.
. PMID 16916470. doi:10.1186/1471-2105-7-386.
- ^ Thykaer J, Nielsen J (2003). „Metabolic engineering of beta-lactam production”. Metab Eng. 5 (1): 56—69. PMID 12749845. doi:10.1016/S1096-7176(03)00003-X.
- ^ González-Pajuelo M, Meynial-Salles I, Mendes F, Andrade J, Vasconcelos I, Soucaille P (2005). „Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol”. Metab Eng. 7 (5–6): 329—36. PMID 16095939. doi:10.1016/j.ymben.2005.06.001.
- ^ Krämer M, Bongaerts J, Bovenberg R, Kremer S, Müller U, Orf S, Wubbolts M, Raeven L (2003). „Metabolic engineering for microbial production of shikimic acid”. Metab Eng. 5 (4): 277—83. PMID 14642355. doi:10.1016/j.ymben.2003.09.001.
- ^ Koffas M, Roberge C, Lee K, Stephanopoulos G (1999). „Metabolic engineering”. Annu Rev Biomed Eng. 1: 535—57. PMID 11701499. doi:10.1146/annurev.bioeng.1.1.535.
- ^ „Metabolism”. The Online Etymology Dictionary. Приступљено 2007-02-20.
- ^ Leroi, Armand Marie (2014). The Lagoon: How Aristotle Invented Science. Bloomsbury. стр. 400—401. ISBN 978-1-4088-3622-4.
- ^ Dr. Abu Shadi Al-Roubi (1982), "Ibn Al-Nafis as a philosopher", Symposium on Ibn al-Nafis, Second International Conference on Islamic Medicine: Islamic Medical Organization, Kuwait (cf. Ibn al-Nafis As a Philosopher, Encyclopedia of Islamic World [1])
- ^ Eknoyan G (1999). „Santorio Sanctorius (1561–1636) – founding father of metabolic balance studies”. Am J Nephrol. 19 (2): 226—33. PMID 10213823. doi:10.1159/000013455.
- ^ Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York) Retrieved on 2007-03-26
- ^ Dubos J. (1951). „Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)—chance and the prepared mind”. Trends Biotechnol. 13 (12): 511—515. PMID 8595136. doi:10.1016/S0167-7799(00)89014-9.
- ^ Kinne-Saffran E, Kinne R (1999). „Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs”. Am J Nephrol. 19 (2): 290—4. PMID 10213830. doi:10.1159/000013463.
- ^ Eduard Buchner's 1907 Nobel lecture at http://nobelprize.org Accessed 2007-03-20
- ^ Kornberg H (2000). „Krebs and his trinity of cycles”. Nat Rev Mol Cell Biol. 1 (3): 225—8. PMID 11252898. doi:10.1038/35043073.
- ^ M., Cox, Michael (2013-01-01). Lehninger principles of biochemistry. Freeman. ISBN 9781429234146. OCLC 901647690.
- ^ Krebs HA, Henseleit K (1932). „Untersuchungen über die Harnstoffbildung im tierkorper”. Z. Physiol. Chem. 210: 33—66. doi:10.1515/bchm2.1932.210.1-2.33.
- ^ Krebs H, Johnson W (април 1937). „Metabolism of ketonic acids in animal tissues”. Biochem J. 31 (4): 645—60. PMC 1266984
 . PMID 16746382. doi:10.1042/bj0310645.
. PMID 16746382. doi:10.1042/bj0310645.
Литература
- Nelson, David L.; Cox, Michael M. (2005). Lehninger Principles of Biochemistry. New York: W. H. Freeman and company. стр. 841. ISBN 978-0-7167-4339-2.
- Rose, S.; Mileusnic, R. (1999). The Chemistry of Life. (Penguin Press Science). ISBN 978-0-14-027273-4.
- Schneider, E. D.; Sagan, D. (2005). Into the Cool: Energy Flow, Thermodynamics, and Life. University Of Chicago Press. ISBN 978-0-226-73936-6.
- Lane, N. (2004). Oxygen: The Molecule that Made the World. (Oxford University Press. USA). ISBN 978-0-19-860783-0.
- Price, N.; Stevens, L. Fundamentals of Enzymology: Cell and Molecular Biology of Catalytic Proteins. (Oxford University Press. 1999). ISBN 978-0-19-850229-6.
- Berg, J.; Tymoczko, J.; Stryer, L. (2002). Biochemistry. (W. H. Freeman and Company). ISBN 978-0-7167-4955-4.
- Cox, M.; Nelson, D. L. (2004). Lehninger Principles of Biochemistry. (Palgrave Macmillan). ISBN 978-0-7167-4339-2.
- Brock, Thomas D.; Madigan, M. T.; Martinko, J.; Parker J. (2002). Brock's Biology of Microorganisms. (Benjamin Cummings). ISBN 978-0-13-066271-2.
- Da Silva, J.J.R.F.; Williams, R. J. P. The Biological Chemistry of the Elements: The Inorganic Chemistry of Life. (Clarendon Press. 1991). ISBN 978-0-19-855598-8.
- Nicholls, D. G.; Ferguson, S. J. (2002). Bioenergetics. (Academic Press Inc.). ISBN 978-0-12-518121-1.
Спољашње везе
- Sparknotes SAT biochemistry Overview of biochemistry. School level.
- MIT Biology Hypertextbook Undergraduate-level guide to molecular biology.
Људски метаболизам
- Topics in Medical Biochemistry Guide to human metabolic pathways. School level.
- The Medical Biochemistry Page - Comprehensive resource on human metabolism.
Базе података
Метаболички путеви