Биохемија — разлика између измена
| Ред 88: | Ред 88: | ||
=== Протеини === |
=== Протеини === |
||
{{Main article|Протеин|Аминокиселина}} |
{{Main article|Протеин|Аминокиселина}} |
||
[[Датотека:AminoAcidball.svg|thumbnail|250px|Општа стурктура α-аминокиселине, са [[ |
[[Датотека:AminoAcidball.svg|thumbnail|250px|Општа стурктура α-аминокиселине, са [[Amin (hemija)|амино]] групом лево и [[карбонил]]ом групом десно.]] |
||
[[Протеин]]и су веома велики молекули – макро-биополимери – направљени од мономера званих [[аминокиселина|аминокиселине]]. Аминокиселина се састоји од атома угљеника за који је везана једна [[Amin (hemija)|амино]] група, —-{NH}-<sub>2</sub>, једна [[карбоксилна киселина|карбоксилна]] група, —-{COOH}- (мада оне постоје као —-{NH}-<sub>3</sub><sup>+</sup> и —-{COO}-<sup>−</sup> под физиолошким условима), једног атома водоника, и једног бочног ланца, који се обично обележава са „—-{R}-”. Бочни ланац „-{R}-” је различит за сваку аминокиселину. Постоји двадесет [[Proteinogena aminokiselina|протеиногених]] (стандардних) аминокиселина. „-{R}-”-групе чине сваку аминокиселину особеном, и својства бочног ланца имају велики утицај на свеукупну [[Терцијарна структура протеина|тродимензионалну конформацију]] протеина. Неке аминокиселине имају функције као самостални молекули или у модикованим формама; на пример, [[Glutaminska kiselina|глутамат]] делује као важан [[неуротрансмитер]]. Аминокиселине се могу спојити путем [[peptide bond|пептидних веза]].<ref name=":0">{{Cite journal|date=1984|title=Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations 1983|url=https://febs.onlinelibrary.wiley.com/doi/abs/10.1111/j.1432-1033.1984.tb07877.x|journal=European Journal of Biochemistry|volume=138|issue=1|pages=9–37|doi=10.1111/j.1432-1033.1984.tb07877.x|issn=0014-2956}}</ref><ref>{{Cite journal|last=Muller|first=P|date=1994-01-01|title=Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)|url=https://www.degruyter.com/view/j/pac.1994.66.issue-5/pac199466051077/pac199466051077.xml|journal=Pure and Applied Chemistry|volume=66 |issue=5|pages=1077–1184 |doi=10.1351/pac199466051077|issn=1365-3075|via=}}</ref> У тој [[Dehydration reaction|дехидратационој]] синтези, молекул воде се уклања и пептидна веза повезује азот једне аминокиселине са угљеником карбоксилне групе друге аминокиселине. Резултирајући молекул се назива ''[[дипептид]]ом''. Кратки ланци аминокиселина (обично са мање од тридесет аминокиселинских отатака) се називају ''[[пептид]]има'' или [[полипептиди]]ма. Дужи ланци се називају ''протеинима''. На пример, важан протеин крвног [[Крвна плазма|серума]] је [[human serum albumin|албумин]] који се састоји од 585 аминокиселинских остатака.<ref name="Metzler 2001">[[#Metzler|Metzler]] (2001), p. 58.</ref><ref>{{UniProt Full|P02768|Serum albumin}}</ref> |
[[Протеин]]и су веома велики молекули – макро-биополимери – направљени од мономера званих [[аминокиселина|аминокиселине]]. Аминокиселина се састоји од атома угљеника за који је везана једна [[Amin (hemija)|амино]] група, —-{NH}-<sub>2</sub>, једна [[карбоксилна киселина|карбоксилна]] група, —-{COOH}- (мада оне постоје као —-{NH}-<sub>3</sub><sup>+</sup> и —-{COO}-<sup>−</sup> под физиолошким условима), једног атома водоника, и једног бочног ланца, који се обично обележава са „—-{R}-”. Бочни ланац „-{R}-” је различит за сваку аминокиселину. Постоји двадесет [[Proteinogena aminokiselina|протеиногених]] (стандардних) аминокиселина. „-{R}-”-групе чине сваку аминокиселину особеном, и својства бочног ланца имају велики утицај на свеукупну [[Терцијарна структура протеина|тродимензионалну конформацију]] протеина. Неке аминокиселине имају функције као самостални молекули или у модикованим формама; на пример, [[Glutaminska kiselina|глутамат]] делује као важан [[неуротрансмитер]]. Аминокиселине се могу спојити путем [[peptide bond|пептидних веза]].<ref name=":0">{{Cite journal|date=1984|title=Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations 1983|url=https://febs.onlinelibrary.wiley.com/doi/abs/10.1111/j.1432-1033.1984.tb07877.x|journal=European Journal of Biochemistry|volume=138|issue=1|pages=9–37|doi=10.1111/j.1432-1033.1984.tb07877.x|issn=0014-2956}}</ref><ref>{{Cite journal|last=Muller|first=P|date=1994-01-01|title=Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)|url=https://www.degruyter.com/view/j/pac.1994.66.issue-5/pac199466051077/pac199466051077.xml|journal=Pure and Applied Chemistry|volume=66 |issue=5|pages=1077–1184 |doi=10.1351/pac199466051077|issn=1365-3075|via=}}</ref> У тој [[Dehydration reaction|дехидратационој]] синтези, молекул воде се уклања и пептидна веза повезује азот једне аминокиселине са угљеником карбоксилне групе друге аминокиселине. Резултирајући молекул се назива ''[[дипептид]]ом''. Кратки ланци аминокиселина (обично са мање од тридесет аминокиселинских отатака) се називају ''[[пептид]]има'' или [[полипептиди]]ма. Дужи ланци се називају ''протеинима''. На пример, важан протеин крвног [[Крвна плазма|серума]] је [[human serum albumin|албумин]] који се састоји од 585 аминокиселинских остатака.<ref name="Metzler 2001">[[#Metzler|Metzler]] (2001), p. 58.</ref><ref>{{UniProt Full|P02768|Serum albumin}}</ref> |
||
[[Датотека:Amino acids 1.png|thumb|left|390px|Генеричке аминокиселине (1) у неутралној форми, (2) како оне постоје у [[Физиолошки раствор|физиолошком раствору]], и (3) спојене заједно у [[дипептид]]у.]] |
[[Датотека:Amino acids 1.png|thumb|left|390px|Генеричке аминокиселине (1) у неутралној форми, (2) како оне постоје у [[Физиолошки раствор|физиолошком раствору]], и (3) спојене заједно у [[дипептид]]у.]] |
||
[[Датотека:1GZX Haemoglobin.png|thumb|right|250px|Шематски приказ структуре [[хемоглобин]]а.<ref name = "Steinberg_2001_95">{{Cite book | last1 = Steinberg | first1 = MH | year = 2001 | title = Disorders of Hemoglobin: Genetics, Pathophysiology, and Clinical Management | publisher = Cambridge University Press | url = https://books.google.com/books?vid=ISBN0521632668 | isbn = 978-0521632669|page=95}}</ref><ref name = "Hardison_1996_1">{{cite journal | last1 = Hardison | first1 = RC | title = A brief history of hemoglobins: plant, animal, protist, and bacteria | periodical = Proc Natl Acad Sci USA | year = 1996 | pmid = 8650150 | volume = 93 | issue = 12 | pages = 5675–79 | pmc = 39118 | doi = 10.1073/pnas.93.12.5675| bibcode = 1996PNAS...93.5675H }}</ref><ref>{{cite book | last = Maton | first = Anthea |author2=Jean Hopkins |author3=Charles William McLaughlin |author4=Susan Johnson |author5=Maryanna Quon Warner |author6=David LaHart |author7=Jill D. Wright | title = Human Biology and Health | publisher = Prentice Hall | year = 1993 | location = Englewood Cliffs, New Jersey, US | isbn = 978-0139811760}}</ref> Црвене и плаве траке представљају притен [[глобин]]; зелене структуре су [[хем]] групе.<ref>{{cite journal |author1=Weed, Robert I. |author2=Reed, Claude F. |author3=Berg, George |title=Is hemoglobin an essential structural component of human erythrocyte membranes? |pmc=289318|journal=J Clin Invest|pmid=13999462 |volume=42 |issue=4 |pages=581–88 |year=1963 |doi=10.1172/JCI104747}}</ref>]] |
|||
[[Датотека:1GZX Haemoglobin.png|thumb|right|250px|Шематски приказ структуре [[хемоглобин]]а. Црвене и плаве траке представљају притен [[глобин]]; зелене структуре су [[хем]] групе.]] |
|||
Протеини могу да имају стурктурне и/или функционалне улоге. На пример, кретања протеина [[актин]]а и [[миозин]]а су ултиматно одговорна за контракције скелеталних мишића. Једно својство које многи протеини имају је њихово специфично везивање за извесне класе молекула—они могу да буду ''екстремно'' селективни у погледу тога за шта се везују. [[Антитело|Антитела]] су један пример протеина који се везује за један специфичан тип молекула. Антитела се састоје од тешких и лаких ланаца. Два тешка ланца могу да буду повезана са два лака ланца путем [[Disulfidna veza|дисулфидних веза]] између њихових аминокиселина. Антитела остварују специфичност путем варијација базираних на разлика у [[N-terminus|-{N}--терминалним]] доменима.<ref>{{cite journal |doi=10.1016/j.tibs.2009.11.005 |pmid=20022755 |pmc=4716677 |title=How antibodies fold |journal=Trends in Biochemical Sciences |volume=35 |issue=4 |pages=189–198 |year=2010 |last1=Feige |first1=Matthias J. |last2=Hendershot |first2=Linda M. |last3=Buchner |first3=Johannes }}</ref> |
Протеини могу да имају стурктурне и/или функционалне улоге. На пример, кретања протеина [[актин]]а и [[миозин]]а су ултиматно одговорна за контракције скелеталних мишића. Једно својство које многи протеини имају је њихово специфично везивање за извесне класе молекула—они могу да буду ''екстремно'' селективни у погледу тога за шта се везују. [[Антитело|Антитела]] су један пример протеина који се везује за један специфичан тип молекула. Антитела се састоје од тешких и лаких ланаца. Два тешка ланца могу да буду повезана са два лака ланца путем [[Disulfidna veza|дисулфидних веза]] између њихових аминокиселина. Антитела остварују специфичност путем варијација базираних на разлика у [[N-terminus|-{N}--терминалним]] доменима.<ref name=brsphys>{{cite book |author=Costanzo, Linda S. |title=Physiology |publisher=Lippincott Williams & Wilkins |location=Hagerstwon, MD |year=2007 |isbn=978-0781773119}}</ref><ref>{{cite journal |doi=10.1016/j.tibs.2009.11.005 |pmid=20022755 |pmc=4716677 |title=How antibodies fold |journal=Trends in Biochemical Sciences |volume=35 |issue=4 |pages=189–198 |year=2010 |last1=Feige |first1=Matthias J. |last2=Hendershot |first2=Linda M. |last3=Buchner |first3=Johannes }}</ref> |
||
Заправо, [[enzyme-linked immunosorbent assay|имуносорбентни тест повезан са ензимом]] (-{ELISA}-),<ref>{{Cite journal|last=Weiland|first=G.|date=1978-11-03|title=[The enzyme-linked immunosorbent assay (ELISA)--a new serodiagnostic method for the detection of parasitic infections (author's transl)]|journal=MMW, Munchener Medizinische Wochenschrift|volume=120|issue=44|pages=1457–1460|issn=0341-3098|pmid=100702}}</ref><ref>{{cite journal |last1=Lequin |first1=R. M. |title=Enzyme Immunoassay (EIA)/Enzyme-Linked Immunosorbent Assay (ELISA) |journal=Clinical Chemistry |volume=51 |issue=12 |pages=2415–8 |year=2005 |pmid=16179424 |doi=10.1373/clinchem.2005.051532 }}</ref> који користи антитела, је један од најсензитивнијих тестова које модерна медицина користи за детектовање разних [[биомолекул]]а. Вероватно најважнији протеини, међутим, су [[ензим]]и. Виртуално све реакције у живим ћелијама захтевају посредовање ензима ради снижавања енергије активације реакције. Ти молекули препознају специфичне молекуле реактаната који се називају ''[[substrate (biochemistry)|супстратима]]''; они затим [[Catalysis|катализују]] реакцију између њих. Путем снижавања [[activation energy|енергије активације]],<ref name="Fersht_1985">{{cite book | author = Fersht A | title = Enzyme Structure and Mechanism | publisher = W.H. Freeman | location = San Francisco | year = 1985 | pages = 50–2 | isbn = 978-0-7167-1615-0}}</ref> ензим може да убрза стопу одвијања реакције и за 10<sup>11</sup> или више пута; реакције којима би требало преко 3.000 година да се спонтано окончају могу да се одвију за секунду у присуству ензима.<ref name="radzicka">{{cite journal | vauthors = Radzicka A, Wolfenden R | title = A proficient enzyme | journal = Science | volume = 267 | issue = 5194 | pages = 90–931 | date = January 1995 | pmid = 7809611 | doi=10.1126/science.7809611| bibcode = 1995Sci...267...90R }}</ref><ref name="pmid17889251">{{cite journal | vauthors = Callahan BP, Miller BG | title = OMP decarboxylase—An enigma persists | journal = Bioorganic Chemistry | volume = 35 | issue = 6 | pages = 465–9 | date = December 2007 | pmid = 17889251 | doi = 10.1016/j.bioorg.2007.07.004 }}</ref> Сам ензим се при томе не уграђује у реакционе продукте, већ је остаје слободан да катализује исту реакцију са новим сетом супстрата. Користећи разне модификаторе, активност ензима може да буде регулисана, чиме се омогућава контрола биохемијских процеса у ћелији као целини.<ref>{{cite book | author = Krauss G | title = Biochemistry of Signal Transduction and Regulation | date = 2003 | publisher = Wiley-VCH | location = Weinheim | isbn = 9783527605767 | edition = 3rd | pages = 89–114 | chapter = The Regulations of Enzyme Activity | chapterurl = https://books.google.com/books?id=iAvu2XRLnfYC&pg=PA91&dq=enzyme+metabolic+pathways+feedback+regulation&hl=en&redir_esc=y}}</ref><ref>{{cite journal | vauthors = Changeux JP, Edelstein SJ | title = Allosteric mechanisms of signal transduction | journal = Science | volume = 308 | issue = 5727 | pages = 1424–8 | date = June 2005 | pmid = 15933191 | doi = 10.1126/science.1108595 | bibcode = 2005Sci...308.1424C }}</ref> |
Заправо, [[enzyme-linked immunosorbent assay|имуносорбентни тест повезан са ензимом]] (-{ELISA}-),<ref>{{Cite journal|last=Weiland|first=G.|date=1978-11-03|title=[The enzyme-linked immunosorbent assay (ELISA)--a new serodiagnostic method for the detection of parasitic infections (author's transl)]|journal=MMW, Munchener Medizinische Wochenschrift|volume=120|issue=44|pages=1457–1460|issn=0341-3098|pmid=100702}}</ref><ref>{{cite journal |last1=Lequin |first1=R. M. |title=Enzyme Immunoassay (EIA)/Enzyme-Linked Immunosorbent Assay (ELISA) |journal=Clinical Chemistry |volume=51 |issue=12 |pages=2415–8 |year=2005 |pmid=16179424 |doi=10.1373/clinchem.2005.051532 }}</ref> који користи антитела, је један од најсензитивнијих тестова које модерна медицина користи за детектовање разних [[биомолекул]]а. Вероватно најважнији протеини, међутим, су [[ензим]]и. Виртуално све реакције у живим ћелијама захтевају посредовање ензима ради снижавања енергије активације реакције. Ти молекули препознају специфичне молекуле реактаната који се називају ''[[substrate (biochemistry)|супстратима]]''; они затим [[Catalysis|катализују]] реакцију између њих. Путем снижавања [[activation energy|енергије активације]],<ref name="Fersht_1985">{{cite book | author = Fersht A | title = Enzyme Structure and Mechanism | publisher = W.H. Freeman | location = San Francisco | year = 1985 | pages = 50–2 | isbn = 978-0-7167-1615-0}}</ref> ензим може да убрза стопу одвијања реакције и за 10<sup>11</sup> или више пута; реакције којима би требало преко 3.000 година да се спонтано окончају могу да се одвију за секунду у присуству ензима.<ref name="radzicka">{{cite journal | vauthors = Radzicka A, Wolfenden R | title = A proficient enzyme | journal = Science | volume = 267 | issue = 5194 | pages = 90–931 | date = January 1995 | pmid = 7809611 | doi=10.1126/science.7809611| bibcode = 1995Sci...267...90R }}</ref><ref name="pmid17889251">{{cite journal | vauthors = Callahan BP, Miller BG | title = OMP decarboxylase—An enigma persists | journal = Bioorganic Chemistry | volume = 35 | issue = 6 | pages = 465–9 | date = December 2007 | pmid = 17889251 | doi = 10.1016/j.bioorg.2007.07.004 }}</ref> Сам ензим се при томе не уграђује у реакционе продукте, већ је остаје слободан да катализује исту реакцију са новим сетом супстрата. Користећи разне модификаторе, активност ензима може да буде регулисана, чиме се омогућава контрола биохемијских процеса у ћелији као целини.<ref>{{cite book | author = Krauss G | title = Biochemistry of Signal Transduction and Regulation | date = 2003 | publisher = Wiley-VCH | location = Weinheim | isbn = 9783527605767 | edition = 3rd | pages = 89–114 | chapter = The Regulations of Enzyme Activity | chapterurl = https://books.google.com/books?id=iAvu2XRLnfYC&pg=PA91&dq=enzyme+metabolic+pathways+feedback+regulation&hl=en&redir_esc=y}}</ref><ref>{{cite journal | vauthors = Changeux JP, Edelstein SJ | title = Allosteric mechanisms of signal transduction | journal = Science | volume = 308 | issue = 5727 | pages = 1424–8 | date = June 2005 | pmid = 15933191 | doi = 10.1126/science.1108595 | bibcode = 2005Sci...308.1424C }}</ref> |
||
| Ред 102: | Ред 102: | ||
[[Датотека:Protein structure examples.png|thumb|800px|center|Пример протеинских структура из [[Proteinska banka podataka|Протеинске банке података]]<ref name = "Historical">{{cite journal | first = H. M. | last = Berman|date=January 2008 | title = The Protein Data Bank: a historical perspective | pmid = 18156675| journal = Acta Crystallographica Section A | volume = A64 | issue = 1 | pages = 88–95| doi = 10.1107/S0108767307035623| url = http://journals.iucr.org/a/issues/2008/01/00/sc5004/sc5004.pdf}}</ref><ref name="pmid9433130">{{cite journal |vauthors=Laskowski RA, Hutchinson EG, Michie AD, Wallace AC, Jones ML, Thornton JM | title = PDBsum: a Web-based database of summaries and analyses of all PDB structures | journal = Trends Biochem. Sci. | volume = 22 | issue = 12 | pages = 488–90 | date = December 1997 | pmid = 9433130 | doi = 10.1016/S0968-0004(97)01140-7 | url = }}</ref>]] |
[[Датотека:Protein structure examples.png|thumb|800px|center|Пример протеинских структура из [[Proteinska banka podataka|Протеинске банке података]]<ref name = "Historical">{{cite journal | first = H. M. | last = Berman|date=January 2008 | title = The Protein Data Bank: a historical perspective | pmid = 18156675| journal = Acta Crystallographica Section A | volume = A64 | issue = 1 | pages = 88–95| doi = 10.1107/S0108767307035623| url = http://journals.iucr.org/a/issues/2008/01/00/sc5004/sc5004.pdf}}</ref><ref name="pmid9433130">{{cite journal |vauthors=Laskowski RA, Hutchinson EG, Michie AD, Wallace AC, Jones ML, Thornton JM | title = PDBsum: a Web-based database of summaries and analyses of all PDB structures | journal = Trends Biochem. Sci. | volume = 22 | issue = 12 | pages = 488–90 | date = December 1997 | pmid = 9433130 | doi = 10.1016/S0968-0004(97)01140-7 | url = }}</ref>]] |
||
[[Датотека:Structural coverage of the human cyclophilin family.png|thumb|350px|right|Чланови протеинске фамилије представљени структурама [[isomerase|изомеразних]]<ref>{{cite book|title=Enzyme nomenclature, 1978 recommendations of the Nomenclature Committee of the International Union of Biochemistry on the nomenclature and classification of enzymes.|year=1979|publisher=Academic Press|location=New York|isbn=9780323144605}}</ref><ref name=gold>{{cite book | last = McNaught | first = A. D. | name-list-format = vanc | title = Compendium of Chemical Terminology | edition = 2nd | year = 1997 | publisher = Blackwell Scientific Publications | location = Oxford | isbn = 0-9678550-9-8 | url = http://goldbook.iupac.org }}</ref> [[protein domain|домена]]]] |
[[Датотека:Structural coverage of the human cyclophilin family.png|thumb|350px|right|Чланови протеинске фамилије представљени структурама [[isomerase|изомеразних]]<ref>{{cite book|title=Enzyme nomenclature, 1978 recommendations of the Nomenclature Committee of the International Union of Biochemistry on the nomenclature and classification of enzymes.|year=1979|publisher=Academic Press|location=New York|isbn=9780323144605}}</ref><ref name=gold>{{cite book | last = McNaught | first = A. D. | name-list-format = vanc | title = Compendium of Chemical Terminology | edition = 2nd | year = 1997 | publisher = Blackwell Scientific Publications | location = Oxford | isbn = 0-9678550-9-8 | url = http://goldbook.iupac.org }}</ref> [[protein domain|домена]]]] |
||
Протеини који се уносе као храна обично прво бивају разложени до појединачних аминокиселина и дипептида у [[small intestine|танком цреву]], и затим апсорбовани. Они могу да буду поново састављени чиме се формирају нови протеини. Интермедијерни призводи [[Гликолиза|гликолизе]], [[Кребсов циклус|циклуса лимунске киселине]], и [[Put pentoza fosfata|пута пензоног фосфата]] могу да буду кориштени за формирање свих двадесет аминокиселина, и већина [[бактерија]] и [[Биљка|биљки]] поседује све неопходне ензиме за синтезу свих протеиногених аминокиселина. [[Човек|Људи]] и други [[сисари]], међутим, могу да синтетишу сам око половине њих. Они не могу да синтетишу [[изолеуцин]], [[леуцин]], [[лизин]], [[метионин]], [[фенилаланин]], [[треонин]], [[триптофан]], и [[валин]]. Оне су [[Esencijalna aminokiselina|есенцијалне аминокиселине]], јер је есенцијално да се унесу путем исхране.<ref>{{cite journal |author=Young VR |title=Adult amino acid requirements: the case for a major revision in current recommendations |journal=J. Nutr. |volume=124 |issue=8 Suppl |pages=1517S–1523S |year=1994 |pmid=8064412 |url=http://jn.nutrition.org/cgi/reprint/124/8_Suppl/1517S.pdf}}</ref><ref name="DRI">[http://fnic.nal.usda.gov/dietary-guidance/dietary-reference-intakes/dri-reports Dietary Reference Intakes: The Essential Guide to Nutrient Requirements] {{webarchive|url=https://web.archive.org/web/20140705140516/http://fnic.nal.usda.gov/dietary-guidance/dietary-reference-intakes/dri-reports |date=5. 7. 2014 }}. Institute of Medicine's Food and Nutrition Board. usda.gov</ref> Сисари поседују ензиме за синтезу [[аланин]]а, [[asparagine|аспарагина]], [[aspartate|аспартата]], [[cysteine|цистеина]], [[glutamate|глутамата]], [[glutamine|глутамина]], [[glycine|глицина]], [[proline|пролина]], [[serine|серина]], и [[tyrosine|тирозина]], неесенцијалне аминокиселине. Они додоше могу да синтетишу [[arginine|аргинин]] и [[histidine|хистидин]], али не могу да произведу довољне количине да се задовоље потребе младих и растућих животиња, тако да се оне често исто тако сматрају есенцијалним аминокиселинама. |
|||
Ingested proteins are usually broken up into single amino acids or dipeptides in the [[small intestine]], and then absorbed. They can then be joined to make new proteins. Intermediate products of glycolysis, the citric acid cycle, and the [[pentose phosphate pathway]] can be used to make all twenty amino acids, and most bacteria and plants possess all the necessary enzymes to synthesize them. Humans and other mammals, however, can synthesize only half of them. They cannot synthesize [[isoleucine]], [[leucine]], [[lysine]], [[methionine]], [[phenylalanine]], [[threonine]], [[tryptophan]], and [[valine]]. These are the [[essential amino acid]]s, since it is essential to ingest them. Mammals do possess the enzymes to synthesize [[alanine]], [[asparagine]], [[aspartate]], [[cysteine]], [[glutamate]], [[glutamine]], [[glycine]], [[proline]], [[serine]], and [[tyrosine]], the nonessential amino acids. While they can synthesize [[arginine]] and [[histidine]], they cannot produce it in sufficient amounts for young, growing animals, and so these are often considered essential amino acids. |
|||
Ако се амино група уклони са аминокиселине, она оставља за собом угљенични скелетон такозване α-[[кетокиселина|кетокиселине]]. Ензими који се називају [[transaminase|трансаминазе]] могу да са лакоћом пренесу амино групу са једне аминокиселине (претварајући је у α-кетокиселину) на другу α-кетокиселину (правећи од ње аминокиселину).<ref>{{cite journal | vauthors = Karmen A, Wroblewski F, Ladue JS | title = Transaminase activity in human blood | journal = The Journal of Clinical Investigation | volume = 34 | issue = 1 | pages = 126–31 | date = January 1955 | pmid = 13221663 | pmc = 438594 | doi = 10.1172/jci103055 }}</ref><ref>{{cite journal | vauthors = Karmen A | title = A note on the spectrometric assay of glutamic-oxalacetic transaminase in human blood serum | journal = The Journal of Clinical Investigation | volume = 34 | issue = 1 | pages = 131–3 | date = January 1955 | pmid = 13221664 | pmc = 438594 | doi = 10.1172/JCI103055 }}</ref><ref>{{cite journal | vauthors = Ladue JS, Wroblewski F, Karmen A | title = Serum glutamic oxaloacetic transaminase activity in human acute transmural myocardial infarction | journal = Science | volume = 120 | issue = 3117 | pages = 497–9 | date = September 1954 | pmid = 13195683 | doi = 10.1126/science.120.3117.497 }}</ref> Ово је важна способност при биосинтези аминокиселина, јер се у многим синтетичким путевима, интермедијери из других биохемијских путева конвертују до α-киселинског скелетона, путем [[transamination|трансаминације]].<ref>{{VoetBiochemistry3rd}}</ref> Аминокиселине се затим могу повезати чиме се формира протеин.<ref>[[#Fromm|Fromm and Hargrove]] (2012), pp. 279–292.</ref> |
|||
Ако се амино група уклони са аминокиселине, it leaves behind a carbon skeleton called an α-[[keto acid]]. Enzymes called [[transaminase]]s can easily transfer the amino group from one amino acid (making it an α-keto acid) to another α-keto acid (making it an amino acid). This is important in the biosynthesis of amino acids, as for many of the pathways, intermediates from other biochemical pathways are converted to the α-keto acid skeleton, and then an amino group is added, often via [[transamination]]. The amino acids may then be linked together to make a protein.<ref>[[#Fromm|Fromm and Hargrove]] (2012), pp. 279–292.</ref> |
|||
Сличан процес се користи за разлагање протеина. |
Сличан процес се користи за разлагање протеина. Они се прво хидролизују у његове саставне аминокиселине. Слободни [[ammonia|амонијак]] (-{NH}-<sub>3</sub>), који постоји као [[ammonium|амонијум]] јон (-{NH}-<sub>4</sub><sup>+</sup>) у крви, је токсичан за животне форме. Подесан метод за његово излучивање стога мора да постоји. Различите тактике су развијене у процесу еволуције у различитим животињама, у зависности од потреба животиње. [[Unicellular|Једноћелијски]] организми једноставно испуштају амонијак у окружење. Слично томе, [[osteichthyes|кошљорибе]] могу да испусте амонијак у воду где брзо бива разблажен. Сисари генерално конвертују амонијаку у [[Уреа|уреју]], путем [[urea cycle|циклуса уреје]].<ref name="Sherwood 2012">[[#Sherwood|Sherwood]] (2012), p. 558.</ref> |
||
Да би се утврдило да ли су два протеина повезана, или другим речима да би се одлучило да ли су хомологни или не, научници користе методе поређења секвенци. Методе као што су [[sequence alignment|поравнавање секвенци]]<ref name=mount>{{cite book| author=Mount DM.| year=2004 | title=Bioinformatics: Sequence and Genome Analysis |edition=2nd | publisher= Cold Spring Harbor Laboratory Press: Cold Spring Harbor, NY. |isbn=0-87969-608-7}}</ref><ref>{{cite web|url=http://www.ebi.ac.uk/Tools/msa/clustalw2/help/faq.html#23|website=Clustal |title= Clustal FAQ #Symbols|accessdate=8 December 2014}}</ref> и [[structural alignment|структурно поравнавање]]<ref>{{cite journal |author1=Hui Sun Lee |author2=Wonpil Im |title=Ligand Binding Site Detection by Local Structure Alignment and Its Performance Complementarity |journal=Journal of Chemical Information and Modeling |volume=53 |issue=9 |pages=2462–2470 |year=2013 | url =http://pubs.acs.org/doi/pdf/10.1021/ci4003602 |doi=10.1021/ci4003602|pmc=3821077 }}</ref><ref>{{cite journal |author1=Janez Konc |author2=Dušanka Janežič |title=ProBiS algorithm for detection of structurally similar protein binding sites by local structural alignment |journal=Bioinformatics |volume=26 |issue=9 |pages=1160–1168 |year=2010 | url =http://bioinformatics.oxfordjournals.org/content/26/9/1160.full.pdf+html |doi=10.1093/bioinformatics/btq100 |pmid=20305268 |pmc=2859123}}</ref> су моћна оружја која помажу научницима да идентифкују [[Homologno modelovanje|хомологе]] међу сродним молекулима.<ref name="Fariselli 2007">[[#Fariselli|Fariselli]] (2007), pp. 78–87.</ref> Релевантност налажења хомолога међу протеинима иде изван опсега формирања еволуционих патерна [[Protein family|протеинских фамилија]]. Путем одређивања у којој мери су две протеинске секвенце сличне,<ref name=Shulman2007>{{cite journal|author1=Alexandra Shulman-Peleg |author2=Maxim Shatsky |author3=Ruth Nussinov |author4=Haim J Wolfson |title=Spatial chemical conservation of hot spot interactions in protein-protein complexes |journal=BMC Biology|date=2007|volume=5 |issue=43 |url=http://bmcbiol.biomedcentral.com/articles/10.1186/1741-7007-5-43}}</ref> стиче се знање о њиховој потенцијалној структури и у извесној мери о њиховој функцији. |
|||
Да би се утврдило да ли су два протеина повезана, или другим ријечима да би се одлучило да ли су хомологни или не, научници користе методе поређења секвенци. Methods like [[sequence alignment]]s and [[structural alignment]]s are powerful tools that help scientists identify [[Sequence homology|homologies]] between related molecules.<ref name="Fariselli 2007">[[#Fariselli|Fariselli]] (2007), pp. 78–87.</ref> The relevance of finding homologies among proteins goes beyond forming an evolutionary pattern of [[Protein family|protein families]]. By finding how similar two protein sequences are, we acquire knowledge about their structure and therefore their function. |
|||
=== Нуклеинске киселине === |
=== Нуклеинске киселине === |
||
Верзија на датум 20. новембар 2018. у 04:28
Један корисник управо ради на овом чланку. Молимо остале кориснике да му допусте да заврши са радом. Ако имате коментаре и питања у вези са чланком, користите страницу за разговор.
Хвала на стрпљењу. Када радови буду завршени, овај шаблон ће бити уклоњен. Напомене
|
| Биохемија |
|---|
 |
| Кључне компоненте |
| Историја и теме |
| Портали: Биологија, Хемија, MCB |
Биохемија или биолошка хемија је хемија живота, мост између биологије и хемије који проучава како комплексне хемијске реакције стварају живот.[1] Биохемија је хибридни део хемије који проучава хемијске процесе у живим организмима. Како сви облици живота имају заједничко порекло, они имају и сличне биохемије, као што су генетички код и стереохемија многих биомолекула. Конторлом протока информација путем биохемијске сигнализације и протока хемијске енергије путем метаболизма, биохемијски процеси омогућавају постојање комплексности живота. Током задњих деценија двадестог века, биохемија је постала у тој мери успешна у објашњавању процеса живих бића да су у данашње време скоро све области науке о животу од ботанике до медицине до генетике учествују у биохемијским истраживањима.[2] Данашњи главни фокус чисте биохемије је на разумевању начина на који биолошки молекули производе процесе који се одвијају у живим ћелијама,[3] што је блиско повезано са изучавањем и разумевањем ткива, органа, и целих организама[4] — другим речима, целокупне биологије.
Биохемија је блиско сродна са молекуларном биологијом, изучавањем молекуларних механизама којима генетичка информација кодирана у ДНК доводи до процеса живота.[5] У зависности од дефиниције термина, молекуларна биологија се може сматрати граном биохемије, или биохемија оруђем којим се истражује и студира молекуларна биологија.
Биохемија се бави структурама, фукнцијама и интеракцијама целуларних компоненти, као што су протеини, угљени хидрати, липиди, нуклеинске киселине и остали биомолекули, који производе ћелијску структуру и изводе многобројене функције везане за живот.[6] Иако постоји огроман број различитих биомолекула, они се често састоје од истих јединица које се понављају, мономера који се понављају у различитим секвенцима. Хемија ћелија исто тако зависи од реакција малих молекула и јона. Они могу да буду неоргански, на пример вода и јони метала, или органски, као што су аминокиселине, које се користе за синтезу протеина.[7] Биохемијске студије су превасходно изучавају малу групу елемената: угљеник, водоник, азот, кисеоник, фосфор, и сумпор; који се често називају CHNOPS. Низ других елемената учествује у биохемиским процесима, али у знатно нижим концентрацијама. Механизми којима ћелије конвертују енергију и свог окружења путем хемијских реакција су познати као метаболизам. Биохемија метаболизма ћелије и биохемија ендокриног система су два домена која су интензивно студирана.
Друге области обухваћене појмом биохемије су генетички код (ДНК, РНК), синтеза протеина, транспорт кроз ћелијску мембрану и трансдукција сигнала. Резултати биохемијских истраживања налазе примену у медицини, исхрани, и пољопривреди. У медицини, биохемичари истражују узроке и лекове болести.[8] У пољу исхране, се изучава начин одржавања здравља и ефекти нутрионе дефицијенције.[9] У пољопривреди предмет истраживања су земљиште и ђубрива, и ради се на повољшању култивације усева, њиховог складиштења и контроле штеточина.
Развој биохемије


У почетку се веровало да на живе материје закони науке делују другачије од неживих материја. Веровало се да само жива бића могу да произведу молекуле живота (од претходно постојећих живих молекула). Међутим Фридрих Велер је 1828. објавио стручни рад који је за тему имао синтезу урее, притом доказавши да органска једињења могу бити створена вештачким путем. Синтеза урее, односно карбамида из амонијум-цијанида била је прва лабораторијска синтеза неког органског једињења.
У својој најширој дефиницији, биохемија се може сматрати студијом компоненти и композиције живих организама и начина на који оне формирају интеракције стварајући живот, и стога се може сматрати да историја биохемије започиње са античком Грчком.[10] Међутим, биохемија као специфична научна дисциплина има свој почетак током 19-тог века, или мало раније, у зависнод од тога на којем аспекту биохемије је фокус. Неки извори заузимају становиште де почетак биохемије кореспондира открићу првог ензима, диастазе (који се данас назива амилазом), 1833. од стране Анселма Пајена,[11] док други сматрају Бухнерову прву демонстрацију комплексног биохемијског процеса алкохолне ферментације у бесћелијским екстратима 1897. године рођењем биохемије.[12][11] Исто тако се може сматрати почетком биохемије објављивање 1842. године утицајног рада Јустуса фон Либига, Животињска хемија, или, органска хемија у њеној примени на физиологију и патологију, који је представио хемијску теорију метаболизма,[10] или чак раније студије из 18-тог века о ферментацији и респирацији Антоана Лавоазјеа.[13][14] Многи други пионири поља који су помогли да се открију слојеви комплексности биохемије су били прокламисани оснивачима модерне биохемије, на пример Емил Фишер због његовог рада на хемији протеина,[15] и Ф. Гоуланд Хопкинс због рада на ензимима и динамичкој природи биохемије.[16]
Сам термин „биохемија“ је изведен из комбинације речи биологија и хемија. Године 1877, Феликс Хопе-Сејлер је користио овај термин (biochemie у Немачком) као синоним за физиолошку хемију у предговору првог издања Zeitschrift für Physiologische Chemie (Часописа за физилошку хемију), где је он залагао за успостављање институција посвећених том пољу истраживања.[17][18] Немачки хемичар Карл Нојберг се међутим често наводи у литератури као особа која је сковала реч биохемија 1903. године,[19][20][21] док неки извори наводе Франц Хофмајстера као творца речи.[18]

Некад је преовладавало мишљење да живит и његови материјали имају нека есенцијална својства или супстанце (што је често називано "виталним принципом") која се различита од оних која су присутна у неживој материји, и постојало је веровање да само живи организми могу да произведу молекуле живота.[23] Године 1828, Фридрих Велер је објавио чланак о синтези уреје, чије је доказао да органска једињења могу да буду креирана вештачким путем.[24] Од тада биохемија је навелико напредовала, нарочито током средине 20. века, са открићем и развојем метода као што су хроматографија, рендгентска дифракција, нуклеарна магнетна резонанција (НМР), радиоизотопско обележавање, електронска микроскопија и симулација молекуларне динамике. Захваљујући овим методима научници су открили и детаљно анализирали многе молекуле као и активности у самим ћелијама на молекуларном нивоу, као што су путеви метаболизма у ћелијама, тј гликолиза и Кребсов циклус (циклус лимунске киселине).
Још један значајни историјски догађај у биохемији је откриће гена и његове улоге у трансферу информација у ћелији. Тај део биохемије се обично назива молекуларном биологијом.[25] Током 1950-тих, Џејмс Д. Вотсон, Франсис Крик, Росалинд Франклин, и Морис Вилкинс су решили ДНК структуру и објаснили њену релацију са генетичим трансфером информација.[25] Године 1958, Џорџ Бидл и Едвард Тејтум су награђени Нобеловом нагадом за рад на гљивама којим су показали да један ген производи један ензим.[26] Године 1988, Колин Пичфорк је био прва особа која је осуђена за убиство на бази ДНК доказа, чему је следио знатан развој форензике.[27] У ближој прошлости су Ендру Фајер и Крејг Мело награђени Нобеловом наградом 2006 за откриће улоге РНК интерференције (РНКи), у онемогућавању експресије гена.[28]
Почетни материјали: хемијски елементи живота
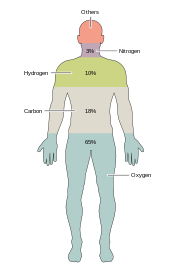
Око 20-30 елемената од 92 елемента који се јављају у природи су есенцијални за разне врсте биолошког живота. Већина ретких елемената на Земљи нису неопходни за живот (изузеци су селен и јод). Исто тако неколико распрострањених елемената (алуминијум и титанијум) се не користи. Већина организама има истоветне потребе за елементима. Постоје извесне разлике између биљака и животиња. На пример, океанске алге користе бром, док не постоје индикације да је тај елемент неопходан копненим биљкама и животињама. Свим животињама је неопходан натријум, што није случај с биљкама. Биљкама је неопходан бор и силицијум, док они нису неопходни животињама (или су потребни у ултра-малим количинама).
Само шест елементата: угљеник, водоник, азот, кисеоник, калцијум, и фосфор сачињавају скоро 99% масе живих ћелија, укључујући оне у људском телу. Осим тих шест главних елемената који сачињавају већину људског тела, људима су неопходне мале количине 18 других елемената.[29]
Биомолекули
Четири главне класе молекула у биохемији (које се често називају биомолекулима) су угљени хидрати, липиди, протеини, и нуклеинске киселине.[30] Многи биолошки молекули су полимери: у тој терминологији, мономери су релативно мали микромолекули који се повезују и тиме се креирају велики макромолекули познати као полимери. Кад се мономери повезују при синтези биолошког полимера, они подлежу процесу дехидрационе синтезе. Различити макромолекули могу да формирају веће комплексе, који су често потребни за биолошку активност.
Угљени хидрати
Функције угљених хидрата су складиште енергије и структура. Шећери су угљени хидрати, међутим постоје и угљени хидрати који нису шећери. На Земљи угљени хидрати су најраспрострањенији биомолекули. Најједноставнији угљени хидрат је моносахарид, који се између осталог састоји од угљеника, водоника, и кисеоника, у односу 1:2:1 са генералном формулом CnH2nO где је n најмање 3. глукоза, један од најбитнијих угљених хидрата, је пример моносахарида. Као и фруктоза, шећер који даје воћу сладак укус.[31][a]
Моносахарид може да пређе из ацикличне форме отвореног ланца у цикличну форму, путем реакције нуклеофилне адиције између карбонилне групе и једне од хидроксилних група истог молекула. Реакција формира прстен од атома угљеника који је затворен кисеоничним мостом. Резултирајући молекул садржи хемиацеталну или хемикеталну групу, у зависности од тога да ли је линеарна форма била алдоза или кетоза. Ово је повратна реакција, те су постоји равнотежа између цикличне и отворене форме молекула.[32]

У цикличним формама, прстен обично има 5 или 6 атома. Те форме се називају фуранозама и пиранозама, респективно — по аналогији са фураном и пираном, најједноставнијим једињењима са истим угљенично-кисеоничним прстеном (мада њима недостају двоструке везе та два молекула). На пример, алдохексоза глукоза може да формира хемиацеталну везу између хидроксила на угљенику 1 и кисеоника на угљенику 4, чиме настаје молекул са петочланим прстеном, који се назива глукофураноза. Иста реакција може да одвије између угљеника 1 и 5 чиме се формира молекул са шесточланим прстеном, који се назива глукопираноза. Цикличне форме са седмочланим прстеном (попут оксепана), се ретко срећу, а називају се хептозама.
Два моносахарида могу бити спојена помоћу дехидрације, реакције у којој се на свака два спојена моносахарида добија један молекул воде. У тој реакцији са једног моносахарида се одваја један атом водоника, а са другог моносахарида се одваја хидроксилна група (-ОН) и таква два моносахарида се споје, док се њиховим спајањем добија један молекул воде H—OH тј. H2O. Новонастали молекул од сва моносахарида се сада назива дисахарид. Обрнути процес, стварање два моносахарида од једног дисахарида се назива хидролиза када молекул воде нападне везу између два спојена шећера. Напознатији дисахарид је сахароза, обични шећер, који се у научном контексту зове кухињски шећер како би се разликовао од осталих шећера. Сахароза се састоји од молекула глукозе и молекула фруктозе. Други важан дисахарид је лактоза, који се састоји од спојених молекула глукозе и галактозе. Већина људи са годинама смањује производњу ензима лактазе који помоћу реакције хидролизе раздваја лактозу у моносахариде, глукозу и галактозу. Резултат смањивања броја лактазе у организму доводи до нетолеранције лактозе, односно у тој старосној групи људи са смањеним бројем ензима не могу да пију млеко и млечне производе.

Када се неколико, 3 до 6, моносахарида споје, тај ланац молекула се зове олигосахарид (олиго значи више). Ови молекули се често користе као маркери и сигнали, али имају и друге улоге.
Дужи моносахаридни ланци се називају полисахаридима. Они се могу јавити у виду једног дугог линеарног ланца, или у облику разгранатог система. Два најзаступљенија полисахарида су целулоза и гликоген, оба се састоје од понављајућих мономера глукозе. Биљке стварају целулозу која је важна структурна конпонента ћелијског зида. Људска бића не могу да произведу целулозу, а исто тако не могу да је варе. Гликоген је угљени хидрат који људи и животиње користе као складиште енергије.
Глукоза је важан извор енергије у већини облика живота. Велики број катаболичких процеса (видети катаболизам) је могућ захваљујући глукози. Глукоза се употребљава у једном веома важном процесу -гликолиза, у којем је циљ да се од једног молекула глукозе добију два молекула пирувата, из чега следи продукција два молекула ATP-а, енергија ћелије, заједно са два редуктована екивалента у форми NAD-а који се претвара у NADH. Овај процес не захтева кисеоник. Ако кисеоник није доступан NADH се пребаци у првобитан облик, NAD; конвертовањем пиривата у лактат (код човека на пример) или у етанол (код гљива).
У аеробним ћелијама са довољно кисеоника, као што су многе људске ћелије, пируват подлеже метаболизму при чему се неповратно трансформише у ацетил-КоА, уз отпуштање једног атома угљеника у виду нуспродуката, угљен-диоксида. Притом се ствара један молекул АТП-а и редукује један NAD молекул (NAD у NADH). Два молекула ацетил-КоА (настала из једног молекула глукозе) се затим укључују у Кребсов циклус, притом стварајући још два молекула АТП-а, 6 молекула NADA и два молекула FADH2. Укупан број молекула ATP-а који се добија овим путем је 32. Јасно се види из овога да комплетна оксидација глукозе омогућава организам са много енергије, и из тога следи да се комплексан живот на Земљи појавио тек онда кад је атмосфера у себи имала велике количине кисеоника.
Код кичмењака, нпр. људи, контрактовањем мишића, на пример током трчања, дизања тегова, брзог хода, организам не добија довољно кисеоника како би одржао ниво енергије како би ове радње биле уопште и могуће. Када дође то тог случаја онда се ћелије пребацују са аеробног метаболизма (кад је кисеоник доступан) у анаеробни метаболизам (кад кисеоник није доступан) и претвајару глукозу у лактат, лактичку киселину. Јетра може да регенерише глукозу, процесом глуконеогенезе.
Липиди

Липиди сачињавају разноврстну групу молекула и у извесној мери се тај термин односи на сва једињења биолошког порекла која су релативно нерастворна у води или неполарна, укључујући воскове, масне киселине, из масних киселина изведене фосфолипиде, сфинголипиде, гликолипиде, и терпеноиде (e.g., ретиноиде и стероиде). Неки липиди су линеарни алифатични молекули, док други имају структуре прстена. Део липида су ароматична једињења, док преостали нису. Неки су флексибилни, док су други крути.[35]
Липиди се обично састоје од једног молекула глицерола и комбинације других молекула. У триглицеридима, који су најзаступљенија група липида, је присутан један молекул глицерола и три масне киселине. Масне киселине се сматрају мономером у овом случају, и могу да буду засићене (без двоструких веза у угљоводоничном ланцу) или незасићени (с једном или више двоструких веза на угљоводоничном ланцу).[32]
Већина липида има делом поларни карактер мада су углавном неполарани. Генерлно, највећи део њихове структуре је неполаран или хидрофобан, и стога они избегавају интеракције са поларним растварачима попут воде. Други део њихове структуре је поларан или хидрофилан и има јаку тенденцију асоцирања са поларним растварачима попут воде. Присуство поларног и неполарног сегмента даје липидима амфифилни карактер. У случају холестерола, једина поларна група је -OH (хидроксил или алкохол), док су код фосфолипида, поларне групе знатно веће и поларније, као што је описано испод.[32]
Липиди су интегрални део људске исхране. Већина уља и млечних производа које се користе за кување и јело, попут маслаца, сира, топљеног масла etc., се састоји од масти. Биљна уља су богата разним полинезасићеним масним киселинама (PUFA). Храна која садржи липиде подлеже варењу у телу и бива разложена у масне киселине и глицерол, који су финали продукти деградације масти и липида. Липиди, а посебно фосфолипиди, се исто тако користе у разним фармацеутским производима, било као помоћна средства за побољшање растварања (e.g., у парентералним инфузијама) или као носеће компоненте лекова (e.g., у липозомима или трансферзомима).
Протеини
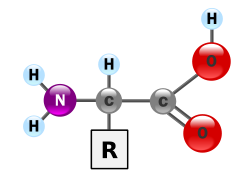
Протеини су веома велики молекули – макро-биополимери – направљени од мономера званих аминокиселине. Аминокиселина се састоји од атома угљеника за који је везана једна амино група, —NH2, једна карбоксилна група, —COOH (мада оне постоје као —NH3+ и —COO− под физиолошким условима), једног атома водоника, и једног бочног ланца, који се обично обележава са „—R”. Бочни ланац „R” је различит за сваку аминокиселину. Постоји двадесет протеиногених (стандардних) аминокиселина. „R”-групе чине сваку аминокиселину особеном, и својства бочног ланца имају велики утицај на свеукупну тродимензионалну конформацију протеина. Неке аминокиселине имају функције као самостални молекули или у модикованим формама; на пример, глутамат делује као важан неуротрансмитер. Аминокиселине се могу спојити путем пептидних веза.[36][37] У тој дехидратационој синтези, молекул воде се уклања и пептидна веза повезује азот једне аминокиселине са угљеником карбоксилне групе друге аминокиселине. Резултирајући молекул се назива дипептидом. Кратки ланци аминокиселина (обично са мање од тридесет аминокиселинских отатака) се називају пептидима или полипептидима. Дужи ланци се називају протеинима. На пример, важан протеин крвног серума је албумин који се састоји од 585 аминокиселинских остатака.[38][39]


Протеини могу да имају стурктурне и/или функционалне улоге. На пример, кретања протеина актина и миозина су ултиматно одговорна за контракције скелеталних мишића. Једно својство које многи протеини имају је њихово специфично везивање за извесне класе молекула—они могу да буду екстремно селективни у погледу тога за шта се везују. Антитела су један пример протеина који се везује за један специфичан тип молекула. Антитела се састоје од тешких и лаких ланаца. Два тешка ланца могу да буду повезана са два лака ланца путем дисулфидних веза између њихових аминокиселина. Антитела остварују специфичност путем варијација базираних на разлика у N-терминалним доменима.[44][45]
Заправо, имуносорбентни тест повезан са ензимом (ELISA),[46][47] који користи антитела, је један од најсензитивнијих тестова које модерна медицина користи за детектовање разних биомолекула. Вероватно најважнији протеини, међутим, су ензими. Виртуално све реакције у живим ћелијама захтевају посредовање ензима ради снижавања енергије активације реакције. Ти молекули препознају специфичне молекуле реактаната који се називају супстратима; они затим катализују реакцију између њих. Путем снижавања енергије активације,[48] ензим може да убрза стопу одвијања реакције и за 1011 или више пута; реакције којима би требало преко 3.000 година да се спонтано окончају могу да се одвију за секунду у присуству ензима.[49][50] Сам ензим се при томе не уграђује у реакционе продукте, већ је остаје слободан да катализује исту реакцију са новим сетом супстрата. Користећи разне модификаторе, активност ензима може да буде регулисана, чиме се омогућава контрола биохемијских процеса у ћелији као целини.[51][52]
Структура протеина традиционално се описује у виду хијерархије са четири нивоа. Примарна структура протеина се састоји од линеарне секвенце аминокиселина;[53][54][55] на пример, „аланин-глицин-триптофан-серин-глутамат-аспарагин-глицерин-лизин-…”. Секундарна структура протеина се односи на локалну морфологију (морфологија је проучавање структуре).[56][57][58] Поједине комбинације аминокиселина имају тенденцију да попримају облик завојнице, која се назива α-хелик или да се групишу у ранви које се називају β-равнима; примери α-хеликса се могу видети у горњем шематском приказу хемоглогина. Терцијарна структура протеина се односи на целокупни тродимензионални облик протеина.[59][60][61] Тај облик је превасходно одређен секвенцом аминокиселина. Заправо, промена појединачне аминокиселине може да промени целокупну структуру. Алфа ланац хемоглобина садржи 146 аминокиселинских остатака; заненом глутаматног остатка у позицији 6 са валинским остатком мења се понашање хемоглобина у тој мери да то доводи до српаста анемија. Коначно, кватернарна структура протеина се односи на структуру протеина са вишеструким пептидним подјединицама, као што је хемоглобин са своје четири подјединице.[62][63] Немају сви протеини више од једне подјединице.[64]

Протеини који се уносе као храна обично прво бивају разложени до појединачних аминокиселина и дипептида у танком цреву, и затим апсорбовани. Они могу да буду поново састављени чиме се формирају нови протеини. Интермедијерни призводи гликолизе, циклуса лимунске киселине, и пута пензоног фосфата могу да буду кориштени за формирање свих двадесет аминокиселина, и већина бактерија и биљки поседује све неопходне ензиме за синтезу свих протеиногених аминокиселина. Људи и други сисари, међутим, могу да синтетишу сам око половине њих. Они не могу да синтетишу изолеуцин, леуцин, лизин, метионин, фенилаланин, треонин, триптофан, и валин. Оне су есенцијалне аминокиселине, јер је есенцијално да се унесу путем исхране.[69][70] Сисари поседују ензиме за синтезу аланина, аспарагина, аспартата, цистеина, глутамата, глутамина, глицина, пролина, серина, и тирозина, неесенцијалне аминокиселине. Они додоше могу да синтетишу аргинин и хистидин, али не могу да произведу довољне количине да се задовоље потребе младих и растућих животиња, тако да се оне често исто тако сматрају есенцијалним аминокиселинама.
Ако се амино група уклони са аминокиселине, она оставља за собом угљенични скелетон такозване α-кетокиселине. Ензими који се називају трансаминазе могу да са лакоћом пренесу амино групу са једне аминокиселине (претварајући је у α-кетокиселину) на другу α-кетокиселину (правећи од ње аминокиселину).[71][72][73] Ово је важна способност при биосинтези аминокиселина, јер се у многим синтетичким путевима, интермедијери из других биохемијских путева конвертују до α-киселинског скелетона, путем трансаминације.[74] Аминокиселине се затим могу повезати чиме се формира протеин.[75]
Сличан процес се користи за разлагање протеина. Они се прво хидролизују у његове саставне аминокиселине. Слободни амонијак (NH3), који постоји као амонијум јон (NH4+) у крви, је токсичан за животне форме. Подесан метод за његово излучивање стога мора да постоји. Различите тактике су развијене у процесу еволуције у различитим животињама, у зависности од потреба животиње. Једноћелијски организми једноставно испуштају амонијак у окружење. Слично томе, кошљорибе могу да испусте амонијак у воду где брзо бива разблажен. Сисари генерално конвертују амонијаку у уреју, путем циклуса уреје.[76]
Да би се утврдило да ли су два протеина повезана, или другим речима да би се одлучило да ли су хомологни или не, научници користе методе поређења секвенци. Методе као што су поравнавање секвенци[77][78] и структурно поравнавање[79][80] су моћна оружја која помажу научницима да идентифкују хомологе међу сродним молекулима.[81] Релевантност налажења хомолога међу протеинима иде изван опсега формирања еволуционих патерна протеинских фамилија. Путем одређивања у којој мери су две протеинске секвенце сличне,[82] стиче се знање о њиховој потенцијалној структури и у извесној мери о њиховој функцији.
Нуклеинске киселине
Нуклеинска киселина је комплекс биохемијских макромолекула високе молекуларне масе који се састоји од нуклеотидних ланаца који преносе генетичке информације. Најпознатије две нуклеинске киселине су Дезоксирибонуклеинска киселина ДНК и Рибонуклеинска киселина РНК. Нуклеинске киселине се налазе у свим живим ћелијама и вирусима.
Напомене
a. ^ Фруктоза није једини шећер присутан у воћу. Глукоза и сахароза су исто тако присутне у варирајућим количинама у разном воћу, и у немим случајевима количински надамашују присутну фруктозу. На пример, 32% јестиве порције порције датуле је глукоза, у поређењу са 23,70 % фруктозе и 8,20 % сахарозе. Брескве садрже више сахарозе (6,66 %) него фруктозе (0,93 %) или глукозе (1,47 %).[83]
Види још
- Часопис Biochemistry
- Часопис Biological Chemistry
- Биофизика
- Хемијска екологија
- Моделовање биолошких система
- ЕЦ број
- Хипотетични типови биохемије
- Међународна унија за биохемију и молекуларну биологију
- Метаболом
- Метаболомика
- Молекуларна биологија
- Молекуларна медицина
- Физиологија биљака
- Протеолиза
- Мали молекул
- Структурна биологија
- Кребсов циклус
Референце
- ^ „Biochemistry”. acs.org.
- ^ Voet 2005, стр. 55
- ^ Karp 2009, стр. 55
- ^ Miller 2012, стр. 55
- ^ Astbury 1961, стр. 55
- ^ Eldra 2007, стр. 55
- ^ Marks (2012), Chapter 14.
- ^ Finkel 2009, стр. 55.
- ^ UNICEF 2010, стр. 55
- ^ а б Helvoort 2000, стр. 55
- ^ а б Hunter 2000, стр. 55.
- ^ Hamblin 2005, стр. 55.
- ^ Berg 1980, стр. 55.
- ^ Holmes (1987), p. xv
- ^ Feldman 2001, стр. 55.
- ^ Rayner-Canham (2005). стр. 136.
- ^ Ziesak 1999, стр. 55.
- ^ а б Kleinkauf 1988, стр. 55.
- ^ Ben-Menahem (2009). стр. 2982.
- ^ Amsler 1986, стр. 55.
- ^ Horton 2013, стр. 55.
- ^ Edwards 1992, стр. 55.
- ^ Fiske 1890, стр. 55.
- ^ Kauffman 2001, стр. 55
- ^ а б Tropp 2012, стр. 55.
- ^ Krebs 2012, стр. 55
- ^ Butler 2009, стр. 55
- ^ Chandan 2007, стр. 55
- ^ Nielsen 1999, стр. 55.
- ^ Slabaugh 2007, стр. 55
- ^ Whiting 1970, стр. 55
- ^ а б в Voet 2005, стр. 55.
- ^ Stryer 2007, стр. 55.
- ^ Voet (2005), Ch. 12 Lipids and Membranes
- ^ Fromm and Hargrove (2012). стр. 22–27.
- ^ „Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations 1983”. European Journal of Biochemistry. 138 (1): 9—37. 1984. ISSN 0014-2956. doi:10.1111/j.1432-1033.1984.tb07877.x.
- ^ Muller, P (1994-01-01). „Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)”. Pure and Applied Chemistry. 66 (5): 1077—1184. ISSN 1365-3075. doi:10.1351/pac199466051077.
- ^ Metzler (2001), p. 58.
- ^ Universal protein resource accession number P02768 for "Serum albumin" at UniProt.
- ^ Steinberg, MH (2001). Disorders of Hemoglobin: Genetics, Pathophysiology, and Clinical Management. Cambridge University Press. стр. 95. ISBN 978-0521632669.
- ^ Hardison, RC (1996). „A brief history of hemoglobins: plant, animal, protist, and bacteria”. Proc Natl Acad Sci USA. 93 (12): 5675—79. Bibcode:1996PNAS...93.5675H. PMC 39118
 . PMID 8650150. doi:10.1073/pnas.93.12.5675.
. PMID 8650150. doi:10.1073/pnas.93.12.5675.
- ^ Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright (1993). Human Biology and Health. Englewood Cliffs, New Jersey, US: Prentice Hall. ISBN 978-0139811760.
- ^ Weed, Robert I.; Reed, Claude F.; Berg, George (1963). „Is hemoglobin an essential structural component of human erythrocyte membranes?”. J Clin Invest. 42 (4): 581—88. PMC 289318
 . PMID 13999462. doi:10.1172/JCI104747.
. PMID 13999462. doi:10.1172/JCI104747.
- ^ Costanzo, Linda S. (2007). Physiology. Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0781773119.
- ^ Feige, Matthias J.; Hendershot, Linda M.; Buchner, Johannes (2010). „How antibodies fold”. Trends in Biochemical Sciences. 35 (4): 189—198. PMC 4716677
 . PMID 20022755. doi:10.1016/j.tibs.2009.11.005.
. PMID 20022755. doi:10.1016/j.tibs.2009.11.005.
- ^ Weiland, G. (1978-11-03). „[The enzyme-linked immunosorbent assay (ELISA)--a new serodiagnostic method for the detection of parasitic infections (author's transl)]”. MMW, Munchener Medizinische Wochenschrift. 120 (44): 1457—1460. ISSN 0341-3098. PMID 100702.
- ^ Lequin, R. M. (2005). „Enzyme Immunoassay (EIA)/Enzyme-Linked Immunosorbent Assay (ELISA)”. Clinical Chemistry. 51 (12): 2415—8. PMID 16179424. doi:10.1373/clinchem.2005.051532.
- ^ Fersht A (1985). Enzyme Structure and Mechanism. San Francisco: W.H. Freeman. стр. 50—2. ISBN 978-0-7167-1615-0.
- ^ Radzicka A, Wolfenden R (јануар 1995). „A proficient enzyme”. Science. 267 (5194): 90—931. Bibcode:1995Sci...267...90R. PMID 7809611. doi:10.1126/science.7809611.
- ^ Callahan BP, Miller BG (децембар 2007). „OMP decarboxylase—An enigma persists”. Bioorganic Chemistry. 35 (6): 465—9. PMID 17889251. doi:10.1016/j.bioorg.2007.07.004.
- ^ Krauss G (2003). „The Regulations of Enzyme Activity”. Biochemistry of Signal Transduction and Regulation (3rd изд.). Weinheim: Wiley-VCH. стр. 89—114. ISBN 9783527605767.
- ^ Changeux JP, Edelstein SJ (јун 2005). „Allosteric mechanisms of signal transduction”. Science. 308 (5727): 1424—8. Bibcode:2005Sci...308.1424C. PMID 15933191. doi:10.1126/science.1108595.
- ^ SANGER F (1952). The arrangement of amino acids in proteins. Adv. Protein Chem. Advances in Protein Chemistry. 7. стр. 1—67. ISBN 9780120342075. PMID 14933251. doi:10.1016/S0065-3233(08)60017-0.
- ^ Aasland, Rein; Abrams, Charles; Ampe, Christophe; Ball, Linda J.; Bedford, Mark T.; Cesareni, Gianni; Gimona, Mario; Hurley, James H.; Jarchau, Thomas (2002-02-20). „Normalization of nomenclature for peptide motifs as ligands of modular protein domains”. FEBS Letters. 513 (1): 141—144. ISSN 1873-3468. doi:10.1016/S0014-5793(01)03295-1.
- ^ Aasland R, Abrams C, Ampe C, Ball LJ, Bedford MT, Cesareni G, Gimona M, Hurley JH, Jarchau T, Lehto VP, Lemmon MA, Linding R, Mayer BJ, Nagai M, Sudol M, Walter U, Winder SJ (1968-07-01). „A One-Letter Notation for Amino Acid Sequences*”. European Journal of Biochemistry. 5 (2): 151—153. ISSN 1432-1033. PMID 11911894. doi:10.1111/j.1432-1033.1968.tb00350.x.
- ^ Linderstrøm-Lang KU (1952). Lane Medical Lectures: Proteins and Enzymes. Stanford University Press. стр. 115. ASIN B0007J31SC.
- ^ Schellman JA, Schellman CG (1997). „Kaj Ulrik Linderstrøm-Lang (1896–1959)”. Protein Sci. 6 (5): 1092—100. PMC 2143695
 . PMID 9144781. doi:10.1002/pro.5560060516. „He had already introduced the concepts of the primary, secondary, and tertiary structure of proteins in the third Lane Lecture (Linderstram-Lang, 1952)”
. PMID 9144781. doi:10.1002/pro.5560060516. „He had already introduced the concepts of the primary, secondary, and tertiary structure of proteins in the third Lane Lecture (Linderstram-Lang, 1952)”
- ^ Steven Bottomley (2004). „Interactive Protein Structure Tutorial”. Приступљено 9. 1. 2011.
- ^ IUPAC. „tertiary structure”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Branden C. and Tooze J. "Introduction to Protein Structure" Garland Publishing, New York. 1990 and 1991.
- ^ Kyte, J. "Structure in Protein Chemistry." Garland Publishing, New York. 1995. ISBN 0-8153-1701-8
- ^ Clarke, Jeremy M. Berg; John L. Tymoczko; Lubert Stryer. Web content by Neil D. (2002). „Section 3.5Quaternary Structure: Polypeptide Chains Can Assemble Into Multisubunit Structures”. Biochemistry (5. ed., 4. print. изд.). New York, NY [u.a.]: W. H. Freeman. ISBN 0-7167-3051-0.
- ^ Chou, Kuo-Chen; Cai, Yu-Dong (1. 11. 2003). „Predicting protein quaternary structure by pseudo amino acid composition”. Proteins: Structure, Function, and Bioinformatics. 53 (2): 282—289. PMID 14517979. doi:10.1002/prot.10500.
- ^ Fromm and Hargrove (2012), pp. 35–51.
- ^ Berman, H. M. (јануар 2008). „The Protein Data Bank: a historical perspective” (PDF). Acta Crystallographica Section A. A64 (1): 88—95. PMID 18156675. doi:10.1107/S0108767307035623.
- ^ Laskowski RA, Hutchinson EG, Michie AD, Wallace AC, Jones ML, Thornton JM (децембар 1997). „PDBsum: a Web-based database of summaries and analyses of all PDB structures”. Trends Biochem. Sci. 22 (12): 488—90. PMID 9433130. doi:10.1016/S0968-0004(97)01140-7.
- ^ Enzyme nomenclature, 1978 recommendations of the Nomenclature Committee of the International Union of Biochemistry on the nomenclature and classification of enzymes. New York: Academic Press. 1979. ISBN 9780323144605.
- ^ McNaught AD (1997). Compendium of Chemical Terminology (2nd изд.). Oxford: Blackwell Scientific Publications. ISBN 0-9678550-9-8.
- ^ Young VR (1994). „Adult amino acid requirements: the case for a major revision in current recommendations” (PDF). J. Nutr. 124 (8 Suppl): 1517S—1523S. PMID 8064412.
- ^ Dietary Reference Intakes: The Essential Guide to Nutrient Requirements Архивирано 2014-07-05 на сајту Wayback Machine. Institute of Medicine's Food and Nutrition Board. usda.gov
- ^ Karmen A, Wroblewski F, Ladue JS (јануар 1955). „Transaminase activity in human blood”. The Journal of Clinical Investigation. 34 (1): 126—31. PMC 438594
 . PMID 13221663. doi:10.1172/jci103055.
. PMID 13221663. doi:10.1172/jci103055.
- ^ Karmen A (јануар 1955). „A note on the spectrometric assay of glutamic-oxalacetic transaminase in human blood serum”. The Journal of Clinical Investigation. 34 (1): 131—3. PMC 438594
 . PMID 13221664. doi:10.1172/JCI103055.
. PMID 13221664. doi:10.1172/JCI103055.
- ^ Ladue JS, Wroblewski F, Karmen A (септембар 1954). „Serum glutamic oxaloacetic transaminase activity in human acute transmural myocardial infarction”. Science. 120 (3117): 497—9. PMID 13195683. doi:10.1126/science.120.3117.497.
- ^ Donald Voet; Judith G. Voet (2005). Biochemistry (3 изд.). Wiley. ISBN 9780471193500.
- ^ Fromm and Hargrove (2012), pp. 279–292.
- ^ Sherwood (2012), p. 558.
- ^ Mount DM. (2004). Bioinformatics: Sequence and Genome Analysis (2nd изд.). Cold Spring Harbor Laboratory Press: Cold Spring Harbor, NY. ISBN 0-87969-608-7.
- ^ „Clustal FAQ #Symbols”. Clustal. Приступљено 8. 12. 2014.
- ^ Hui Sun Lee; Wonpil Im (2013). „Ligand Binding Site Detection by Local Structure Alignment and Its Performance Complementarity”. Journal of Chemical Information and Modeling. 53 (9): 2462—2470. PMC 3821077
 . doi:10.1021/ci4003602.
. doi:10.1021/ci4003602.
- ^ Janez Konc; Dušanka Janežič (2010). „ProBiS algorithm for detection of structurally similar protein binding sites by local structural alignment” (PDF). Bioinformatics. 26 (9): 1160—1168. PMC 2859123
 . PMID 20305268. doi:10.1093/bioinformatics/btq100.
. PMID 20305268. doi:10.1093/bioinformatics/btq100.
- ^ Fariselli (2007), pp. 78–87.
- ^ Alexandra Shulman-Peleg; Maxim Shatsky; Ruth Nussinov; Haim J Wolfson (2007). „Spatial chemical conservation of hot spot interactions in protein-protein complexes”. BMC Biology. 5 (43).
- ^ Whiting, G.C. (1970). стр. 5.
Литература
- Молекуларна Генетика, Џејмс Д. Вотсон. 2005. ISBN 978-0-8053-4642-8.
- Amsler, Mark (1986). The Languages of Creativity: Models, Problem-solving, Discourse. University of Delaware Press. ISBN 978-0874132809.
- Astbury, W.T. (1961). „Molecular Biology or Ultrastructural Biology?” (PDF). Nature. 190 (4781): 1124. PMID 13684868. doi:10.1038/1901124a0. Приступљено 04. 01. 2016.
- Ben-Menahem, Ari (2009). Historical Encyclopedia of Natural and Mathematical Sciences. Springer. стр. 2982. ISBN 978-3-540-68831-0.
- Burton, Feldman (2001). The Nobel Prize: A History of Genius, Controversy, and Prestige. Arcade Publishing. ISBN 978-1559705929.
- Butler, John M. (2009). Fundamentals of Forensic DNA Typing. Academic Press. ISBN 978-0-08-096176-7.
- Chandan, Sen K.; Roy, Sashwati (2007). „miRNA: Licensed to kill the messenger”. DNA Cell Biology. 26 (4). PMID 17465885. doi:10.1089/dna.2006.0567.
- Clarence, Peter Berg (1980). „The University of Iowa and Biochemistry from Their Beginnings”. ISBN 9780874140149.
- Edwards K.J.; Brown D.G.; Spink, N.; Skelly J.V.; Neidle S. (1992). „Molecular structure of the B-DNA dodecamer d(CGCAAATTTGCG)2. An examination of propeller twist and minor-groove water structure at 2.2 A resolution”. J.Mol.Biol. 226: 1161—1173. PMID 1518049.
- Solomon, Eldra P.; Berg, Linda R.; Martin, Diana W. (2007). Biology, 8th Edition, International Student Edition. Thomson Brooks/Cole. ISBN 978-0495317142. Архивирано из оригинала 04. 03. 2016. г. Приступљено 09. 02. 2017.
- Fariselli, Piero; Rossi, Ivan; Capriotti, Emidio; Casadio, Rita (2007). „The WWWH of remote homolog detection: the state of the art”. Briefings in Bioinformatics. 8 (2). PMID 17003074. doi:10.1093/bib/bbl032.

- Fiske, John (1890). Outlines of Cosmic Philosophy Based on the Doctrines of Evolution, with Criticisms on the Positive Philosophy, Volume 1. Boston and New York: Houghton, Mifflin. Приступљено 16. 2. 2015.
- Finkel, Richard; Cubeddu, Luigi; Clark, Michelle (2009). Lippencott's Illustrated Reviews: Pharmacology (4th изд.). Lippencott Williams & Wilkins. ISBN 978-0-7817-7155-9.
- Krebs, Jocelyn E.; Goldstein, Elliott S.; Lewin, Benjamin; Kilpatrick, Stephen T. (2012). Essential Genes. Jones & Bartlett Publishers. ISBN 978-1-4496-1265-8.
- Fromm, Herbert J.; Hargrove, Mark (2012). Essentials of Biochemistry. Springer. ISBN 978-3-642-19623-2.
- Hamblin, Jacob Darwin (2005). Science in the Early Twentieth Century: An Encyclopedia. ABC-CLIO. ISBN 978-1-85109-665-7.
- Helvoort, Ton van (2000). Arne Hessenbruch, ур. Reader's Guide to the History of Science. Fitzroy Dearborn Publishing. ISBN 978-1-884964-29-9.
- Holmes, Frederic Lawrence (1987). Lavoisier and the Chemistry of Life: An Exploration of Scientific Creativity. University of Wisconsin Press. ISBN 978-0299099848.
- Horton, Derek, ур. (2013). Advances in Carbohydrate Chemistry and Biochemistry, Volume 70. Academic Press. ASIN B00H7E78BG.
- Hunter, Graeme K. (2000). Vital Forces: The Discovery of the Molecular Basis of Life. Academic Press. ISBN 978-0-12-361811-5.
- Karp, Gerald (2009). Cell and Molecular Biology: Concepts and Experiments. John Wiley & Sons. ISBN 9780470483374.
- Kauffman, G.B.; Chooljian, S.H. (2001). „Friedrich Wöhler (1800–1882), on the bicentennial of his birth”. The Chemical Educator. 6 (2). doi:10.1007/s00897010444a.
- Kleinkauf, Horst; Döhren, Hans von; Lothar, Jaenicke (1988). The Roots of Modern Biochemistry: Fritz Lippmann's Squiggle and its Consequences. Walter de Gruyter & Co. стр. 116. ISBN 9783110852455.
- Knowles, J. R. (1980). „Enzyme-catalyzed phosphoryl transfer reactions”. Annu. Rev. Biochem. 49: 877—919. PMID 6250450. doi:10.1146/annurev.bi.49.070180.004305.
- Metzler, David Everett; Metzler, Carol M. (2001). Biochemistry: The Chemical Reactions of Living Cells. 1. Academic Press. ISBN 978-0-12-492540-3.
- Miller, G.; Scott, Spoolman (2012). Environmental Science - Biodiversity Is a Crucial Part of the Earth's Natural Capital. Cengage Learning. ISBN 978-1-133-70787-5. Приступљено 04. 01. 2016.
- Nielsen, Forrest H. (1999). Maurice E. Shils, ур. Ultratrace minerals; Modern nutrition in health and disease. Baltimore: Williams & Wilkins. стр. 283—303.
- Peet, Alisa (2012). Marks, Allan; Lieberman Michael A., ур. Marks' Basic Medical Biochemistry (Lieberman, Marks's Basic Medical Biochemistry) (4th изд.). ISBN 978-1-60831-572-7.
- Rayner-Canham, Marelene F.; Rayner-Canham, Marelene; Rayner-Canham, Geoffrey (2005). Women in Chemistry: Their Changing Roles from Alchemical Times to the Mid-Twentieth Century. Chemical Heritage Foundation. ISBN 978-0941901277.
- Rojas-Ruiz, Fernando A; Vargas-Méndez, Leonor; Kouznetsov, Vladimir V. (2011). „Challenges and Perspectives of Chemical Biology, a Successful Multidisciplinary Field of Natural Sciences”. Molecules. 16: 2672—2687. ISSN 1420-3049. doi:10.3390/molecules16032672. Архивирано из оригинала 05. 12. 2015. г.
- Saenger, Wolfram (1984). Principles of Nucleic Acid Structure. New York: Springer-Verlag. ISBN 978-0-387-90762-8.
- Slabaugh, Michael R.; Seager, Spencer L. (2013). Organic and Biochemistry for Today (6th изд.). Pacific Grove: Brooks Cole. ISBN 978-1-133-60514-0.
- Sherwood, Lauralee; Klandorf, Hillar; Yancey, Paul H. (2012). Animal Physiology: From Genes to Organisms. Cengage Learning. ISBN 978-0-8400-6865-1.
- Stryer L, Berg JM, Tymoczko JL (2007). Biochemistry (6th изд.). San Francisco: W.H. Freeman. ISBN 978-0-7167-8724-2.
- Tropp, Burton E. (2012). Molecular Biology (4th изд.). Jones & Bartlett Learning. ISBN 978-1-4496-0091-4.
- UNICEF (2010). Facts for life (PDF) (4th изд.). New York: United Nations Children's Fund. ISBN 978-92-806-4466-1.
- Ulveling, Damien; Francastel, Claire; Hubé, Florent (2011). „When one is better than two: RNA with dual functions”. Biochimie. 93 (4). PMID 21111023. doi:10.1016/j.biochi.2010.11.004.
- Varki A, Cummings R, Esko J, Jessica F, Hart G, Marth J (1999). Essentials of glycobiology. Essentials of glycobiology. Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-560-6.
- Voet, D; Voet, JG (2005). Biochemistry (3th изд.). Hoboken, NJ: John Wiley & Sons Inc. ISBN 9780471193500. Архивирано из оригинала 11. 9. 2007. г.
- Whiting, G.C (1970). „Sugars”. Ур.: A.C. Hulme. The Biochemistry of Fruits and their Products. Volume 1. London & New York: Academic Press. ISBN 978-0-12-361201-4.
- Ziesak, Anne-Katrin; Cram Hans-Robert (1999). Walter de Gruyter Publishers, 1749-1999. Walter de Gruyter & Co. ISBN 978-3110167412.
- Keith Roberts, Martin Raff, Bruce Alberts, Peter Walter, Julian Lewis and Alexander Johnson, Molecular Biology of the Cell
- 4th Edition, Routledge, March, hardcover, 1616 pages, 7.6 pounds. 2002. ISBN 978-0-8153-3218-3.
- 3rd Edition, Garland. 1994. ISBN 978-0-8153-1620-6.
- 2nd Edition, Garland. 1989. ISBN 978-0-8240-3695-9.
- Fruton, Joseph S. (1999). Proteins, Enzymes, Genes: The Interplay of Chemistry and Biology. Yale University Press: New Haven. ISBN 978-0-300-07608-0.
- Kohler, Robert. From Medical Chemistry to Biochemistry: The Making of a Biomedical Discipline. Cambridge University Press, 1982.
Спољашње везе
- Виртуелна библиотека Биохемије
- Америчко хемијско друштво
- Европско Друштво Биохемичара
- „Biochemical Society”.
- The Virtual Library of Biochemistry and Cell Biology
- Biochemistry, 5th ed. Full text of Berg, Tymoczko, and Stryer, courtesy of NCBI.
- SystemsX.ch - The Swiss Initiative in Systems Biology
- Full text of Biochemistry by Kevin and Indira, an introductory biochemistry textbook.



