Толуен
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
Methylbenzene
| |||
| Други називи
фенилметан
толуол Анисен | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.003.297 | ||
| КЕГГ[1] | |||
| RTECS | XС5250000 | ||
| УНИИ | |||
| |||
| Својства | |||
| C7H8 or C6H5CH3 | |||
| Моларна маса | 92,14 g/mol | ||
| Агрегатно стање | безбојна течност | ||
| Густина | 0,8669 g/mL (20 °C) | ||
| Тачка топљења | −93 °C, 180 K | ||
| Тачка кључања | 110.6 °C, 383.8 K | ||
| 0.47 g/L (20–25 °C) | |||
| Индекс рефракције (nD) | 1.497 (20 °C) | ||
| Вискозност | 0.590 cP на 20 °C | ||
| Структура | |||
| Диполни момент | 0.36 D | ||
| Opasnosti | |||
| Opasnost u toku rada | veoma zapaljiv | ||
| Bezbednost prilikom rukovanja | SIRI.org | ||
| R-oznake | R11, R38, R48/20, R63, R65, R67 | ||
| S-oznake | (S2), S36/37, S29, S46, S62 | ||
| NFPA 704 | |||
| Tačka paljenja | 4°C (39 °F) | ||
| 50 mL m−3, 190 mg m−3 | |||
| Сродна једињења | |||
Сродне ароматични угљоводоници
|
бензен ксилен нафтален | ||
Сродна једињења
|
метилциклохексан | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Толуен (толуол) је чиста, у води нерастворљива, течност са типичним мирисом растварача. Хемијски он је моно-субституисани дериват бензена, тј. један атом водоника бензен је замењен CH3 групом.[4]
Он је ароматични угљоводоник који је у широкој употреби као индустријска сировина и растварач.
Историја
[уреди | уреди извор]Толуен је први пут добијен 1844. године путем суве дестилације из толубалзама. Открио га је француски хемичар Хенри Етиен Сант-Клара Девил. Из толуена је 1861. хемичар Јосеф Вилбранд добио ТНТ (тринитротолуен), мада не потпуно хемијски чист.
Хемијске особине
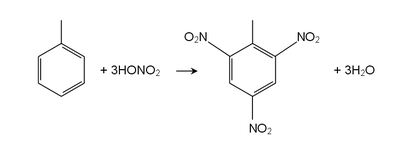
[уреди | уреди извор]Толуен реагује као нормалан ароматичан угљоводоник у погледу електрофилне ароматичне супституције.[5][6][7] Метилна група га чини око 25 пута реактивнијим од бензена у такивм реакцијама. Он подлеже сулфонацији и даје p-толуенесулфонску киселину, и хлоринацији са Cl2 у присуству FeCл3 и даје орто и пара изомере хлоротолуена. Он подлеже нитрацији чиме настају орто и пара нитротолуенски изомери, али ако се загреје даје динитротолуен и ултиматно експлозив тринитротолуен (ТНТ).
Толуен спада у групу 2Б канцерогених материја према класификацији Међународне агенције за истраживање рака (ИАРЦ).[8]
Са другим реагенсима метил бочни ланац толуена може да реагује, подлежући оксидацији. Реакција са калијум перманганатом и разблаженом киселином (нпр. сумпорном киселином) или калијум перманганатом са концентрованом сумпорном киселином, производи бензојеву киселину, док реакција са хромил хлоридом даје бензалдехид (Етардова реакција). Халогенација се може извести под условима слободних радикала. На пример, N-бромосукцинимид (NBS) загреван са толуеном у присуству АИБН доводи до бензил бромида. Толуен се такоже може третирати са елементарним бромом у присуству УВ светла (директна сунчева светлост) да произведе бензил бромид. Толуен се исто тако може броминисати третирањем са HBr и H2О2 у присуству светла[9].
Каталитичка хидрогенација толуена до метилциклохексана захтева висок притисак водоника до би се завршила, због стабилности ароматичног система. pKa је приближно 45.
Употреба и емисија
[уреди | уреди извор]Производи се у процесу краковања сирове нафте, али и путем реакције алкиловања бензена метанолом.[8] Толуен се користи као растварач, за производњу различитих боја и лакова, за производњу гуме, штављење коже, у производњи најлона и различитих хемикалија.[8] Мада је важан органски растварач, има и способност растварања бројних неорганских хемикалија као што је сумпор.[10]
Као и бензен, користи се као адитив безоловним моторним бензинима. Око 20% укупно произведеног толуена се користи и за производњу ксилена.[8]
Попут других растварача, толуен се у неким случајевима такође користи као инхалирајући лек због својих опојних својстава; међутим, то може потенцијално да проузрокује озбиљне неуролошке повреде.[11][12] Емисија толуена у ваздух може имати природно и антропогено порекло. Природне емисије су вулканске ерупције, шумски пожари и сирова нафта, док су антропогени извори процеси у којима се највише користи. Може бити емитован директно у атмосферу или са површина на које су нанети производи који садрже ово једињење, односно процеси у којима се користе боје и растварачи, као и остали индустријски процеси који обухватају употребу толуена или производа у којима се он налази. Најзначајнији антропогени извор толуена је употреба безоловног моторног бензина као горива, али и његова производња, складиштење и манипулисање њиме.[8]
Референце
[уреди | уреди извор]- ^ Јоанне Wиxон; Доуглас Келл (2000). „Wебсите Ревиеw: Тхе Кyото Енцyцлопедиа оф Генес анд Геномес — КЕГГ”. Yеаст. 17 (1): 48—55. дои:10.1002/(СИЦИ)1097-0061(200004)17:1<48::АИД-YЕА2>3.0.ЦО;2-Х.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ B. S. Furnell et al., Vogel's Textbook of Practical Organic Chemistry, 5th edition, Longman/Wiley, New York, 1989
- ^ L. G. Wade, Organic Chemistry, 5th ed. pp. 871, Prentice Hall, Upper Saddle RIver, New Jersey, 2003
- ^ J. March, Advanced Organic Chemistry, 4th ed. pp. 723, Wiley, New York, 1992
- ^ а б в г д Шоштарић 2017, стр. 16.
- ^ Free radical bromination by the H2O2–HBr system on water Ajda Podgorsˇek Stojan Stavber, Marko Zupana, and Jernej Iskraa, Tetrahedron Letters 47 (2006) 7245–7247 . doi:10.1016/j.tetlet.2006.07.109. Недостаје или је празан параметар
|title=(помоћ) - ^ C.Michael Hogan. 2011. sulfur. Encyclopedia of Earth, eds. A.Jorgensen and C.J.Cleveland, National Council for Science and the environment, Washington DC
- ^ Стреицхер ХЗ, Габоw ПА, Мосс АХ, Коно D, Каехнy WД (1981). „Сyндромес оф толуене сниффинг ин адултс”. Анн. Интерн. Мед. 94 (6): 758—62. ПМИД 7235417.
- ^ Деватхасан Г, Лоw D, Теох ПЦ, Wан СХ, Wонг ПК (1984). „Цомплицатионс оф цхрониц глуе (толуене) абусе ин адолесцентс”. Ауст Н З Ј Мед. 14 (1): 39—43. ПМИД 6087782.
Литература
[уреди | уреди извор]- Шоштарић, Андреј I. (2017). Механизми уклањања лако испарљивих моноароматичних угљоводоника (БТЕX) из амбијенталног ваздуха мокром депозицијом (ПДФ). Београд: Хемијски факултет Универзитет у Београду. Архивирано из оригинала (ПДФ) 22. 09. 2020. г. Приступљено 3. 6. 2018.
Спољашње везе
[уреди | уреди извор]![]() Медији везани за чланак толуене на Викимедијиној остави
Медији везани за чланак толуене на Викимедијиној остави
- АТСДР
- Растворљивост Архивирано на сајту Wayback Machine (28. септембар 2007)
- Tehnička specifikacija naftnog toluena




