Криптон
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општа својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, симбол | криптон, Kr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | безбојни гас који показује беличасти сјај у електричном пољу | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| У периодноме систему | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број (Z) | 36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група, периода | група 18 (племенити гасови), периода 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | p-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | племенити гас | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рел. ат. маса (Ar) | 83,798(2)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ел. конфигурација | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по љускама | 2, 8, 18, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физичка својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тачка топљења | 115,78 K (−157,37 °C, −251,27 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тачка кључања | 119,93 K (−153,415 °C, −244,147 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина на СТП (0 °C и 101,325 kPa) | 3,749 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| течно ст., на т.к. | 2,413 g/cm3[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тројна тачка | 115,775 K, 73,53 kPa[3][4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критична тачка | 209,48 K, 5,525 MPa[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлота фузије | 1,64 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлота испаравања | 9,08 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мол. топл. капацитет | 20,95[5] J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Напон паре
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомска својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | 3,00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергије јонизације | 1: 1350,8 kJ/mol 2: 2350,4 kJ/mol 3: 3565 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентни радијус | 116±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Валсов радијус | 202 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Остало | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | постраничноцентр. кубична (FCC) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Брзина звука | (23 °C) 220 m·s−1 1120 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топл. водљивост | 9,43×10−3 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетни распоред | дијамагнетичан[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетна сусцептибилност (χmol) | −28,8·10−6 cm3/mol (298 K)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS број | 7439-90-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откриће и прва изолација | Вилијам Ремзи и Морис Траверс (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Главни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Криптон (Kr, лат. krypton) племенити је гас XVIII групе са редним бројем 36.[9] Има неколико изотопа чије се атомске масе налазе између 72-94. Постојани изотопи су: 78, 80, 82, 83, 84 i 86.[10] Заступљена је у земљиној атмосфери у количини од око 1,14 ppm, такође је заступљен и као један од продуката распада уранијума и плутонијума Откривен је 1898. године од стране Вилијама Ремзија и Мориса Вилијама Траверса.
Криптон је нереактиван племенити гас, а познат је веома мали број његових једињења. Криптон је безбојан. Реагује са гасовитим флуором под високим притиском градећи флуориде. Једини практични значај је његова детекција која омогућава проналажење руда уранијума.
Историја
[уреди | уреди извор]
Након што су Џон Вилијам Страт и Вилијам Ремзи 1894. открили аргон као први племенити гас, те хелијум 1895. којег је Ремзи изоловао из руда уранијума, а који је до тада био познат само из Сунчевог спектра, он је на основу законитости периодног система уочио да би требао постојати још неки сличан елемент. Ремзи је почев до 1896. истраживао различите минерале и метеорите као и гасове које они испуштају при загрејавању или растварању. Међутим, његов сарадник Морис Траверс и он нису били успешни, па су до тада успели да пронађу само хелијум и ретки аргон. Такође, ни проучавања врелих гасова из Котрета у Француској и са Исланда нису дала никакве резултате.[11]
На крају, они су почели да проучавају 15 литара сировог аргона који су добили, те да га раздвајају на састојке помоћу утечњавања и фракционе дестилације. Када су испитали нечистоће, које су преостале након што је готово сав сирови аргон потпуно испарио, нашли су до тада непознате жуте и зелене спектралне линије тј. доказ новог хемијског елемента. Дали су му име криптон према старогрчком κρυπτός (kriptos) у значењу сакривен. Након што су Ремзи и Траверс извршили даљњу дестилацију и прочишћавање, успели су да одреде и моларну масу криптона од око 80 g/mol. Након открића криптона, а након што су из једне фракције са још нижом температуром кључања издвојити гас неон, коначно су путем издвајања из сировог криптона дошли до још једног племенитог гаса, ксенона.[11]
А. фон Антропоф је 1924. објавио да је успео да синтетише прво једињење криптона у облику црвене, стабилне чврсте ствари састављене из криптона и хлора. Касније се испоставило да се у овом споју не налази криптон већ азот моноксид и хлороводоник. Ипак након 1962. када је добијено прво једињење једног племенитог гаса, ксенона, почео је веће интересовање науке и настојања да се синтетишу једињења криптона. Прво такво једињење добио је А.В. Грос, за који је првобитно претпостављао да се ради о криптон-тетрафлуориду, да би после додатних испитивања идентификован као криптон-дифлуорид.[12]
Таласне дужине електромагнетског зрачења које емитује изотоп криптона 86Kr узет је 1960. као основа за дефиницију јединице метра. Тиме је укинуто недовољно тачна дефиниција која је до тада узимана као еталон „праметра” направљен од легуре иридијума и платине. Тада је за један метар узета удаљеност 1.650.763,73 таласних дужина електромагнетног зрачења нуклида 86Kr које емитује при преласку из стања 5d5 у 2pl0 у вакууму.[13] Ова дефиниција је важила све до 1983. када је замењена дефиницијом, која се узима као удаљеност коју светлост пређе у вакууму за одређени део секунде.[14]
Особине
[уреди | уреди извор]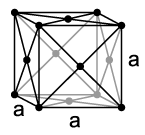
Физичке
[уреди | уреди извор]У нормалним условима температуре и притиска, криптон је једноатомни, безбојни гас без мириса, који се кондензује при температури од 121,2 K (−152 °C) a pri 115,79 K (−157,36 °C) прелази у чврсто стање. Као и други племенити гасови осим хелијума, криптон се кристализује у кубном густо пакованом кристалном систему са параметром решетке a = 572 pm.[15] Као и сви племенити гасови, он такође има све електронске љуске попуњене (електронска конфигурација племенитог гаса). Тиме се може објаснити да се као гас налази у једноатомном стању, те да му је реактивност изузетно слаба.
Са густоћом од 3,749 kg/m³ при температури од 0 °C и притиску од 1013 hPa, криптон је тежи од ваздуха и пада на тло. У фазном дијаграму, тројна тачка се налази на 115,76 K и 0,7315 bar,[16] док се критична тачка налази на −63,75 °C, 5,5 MPa при чему је критична густина 0,909 g/cm³.[17] У води је слабо растворљив, тако да се при 0 °C у 1 литру воде може растворити највише 110 ml криптона.[17]
Хемијске
[уреди | уреди извор]Попут свих племенитих гасова, криптон је веома нереактиван. У изузетним случајевима и под посебним условима окружења, он може реаговати са најелектронегативнијим елементом, флуором, при чему настаје криптон дифлуорид. За разлику од ксенон-флуорида, криптон-дифлуорид је термодинамички нестабилан, његово стварање је стога ендотермно те се мора одвијати при нижим температурама. Флуорови радикали, који су неопходни за реакцију са криптоном, могу се добити помоћу зрачења ултраљубичастим зракама, бомбардовањем протонима или електричним пражњењем.[12]
Криптон гради клатрате са различитим једињењима, у којима је гас физички затворен у неку шупљину те је на тај начин везан за њих. Тако на пример криптон са водом и смесом воде и хлороформа гради клатрат при −78 °C,[18] док је клатрат са хидрохиноном тако стабилан да је криптон за њега везан дуже време.[17] Такође је познат и инклузијско једињење криптона у олигосахариду α-циклодекстрину.[19]
Изотопи
[уреди | уреди извор]Познато је укупно 31 изотоп криптона те 10 нуклеарних изомера. Међу њима постоји пет стабилних изотопа: 80Kr, 82Kr, 83Kr, 84Kr и 86Kr. Сви они се јављају у природи као и изотоп 78Kr који се врло споро распада (време полураспада 2 · 1021 година). Највећи удео у природној смеси изотопа има изотоп 84Kr са 57%, а следе га 86Kr са 17,3%; 82Kr са 11,58% и 83Kr са 11,49%. Осим ових, изотоп 80Kr са уделом од 2,28% и 78Kr са 0,35% су много ређи у природи.[20] У природи се такође налази и радиоактивни изотоп криптона 81Kr, који је уједно и његов најдуже живући нестабилни изотоп са временом полураспада од 229 хиљада година,[20] а настаје у траговима путем атмосферских реакција.[21] И радиоактивни изотоп 85Kr са временом полураспада од 10,756 година такође се јавља у атмосфери у траговима. Он настаје заједно са другим краткоживећим изотопима при разбијању језгара уранијума и плутонијума. Може доспети у атмосферу било нуклеарном експлозијом или током поновне прераде нуклеарног горива, а због различите расподеле емисијских извора на Земљи много је чешћи на северној него на јужној хемисфери. Након атмосферских нуклеарних тестова 1960-их и значајног загађења атмосфере изотопом 85Kr, уследио је пад његове концентрације,[21] али је на мерној станици у Генту између 1979. и 1999. забележен нагли пораст због рада постројења за поновну прераду нуклеарног горива у Ла Агу у Нормандији.[22] Стабилни изотоп 83Kr је једини НРМ-активни изотоп криптона. Хиперполаризирани 83Kr је кориштен у тестовима на пацовима за проучавање плућа животиња помоћу томографије магнетном резонанцом.[23]
Распрострањеност
[уреди | уреди извор]Криптон се убраја међу најређе елементе на Земљи. Сматра се да су од њега ређи само ксенон и неки радиоактивни елементи, који се у природи налазе највећим делом већ распаднути попут плутонијума или као краткоживући међупроизводи у неком од ланаца распада. Удео криптона у Земљиној кори износи 1,9 × 10−5 ppm,[24] док се највећи део овог гаса налази у атмосфери, у којој га има око 1,14 ppm.[25]
У свемиру је криптон далеко чешћи, а његова распострањеност упоредива је са литијумом, галијумом или скандијумом.[26] Однос између криптона и водоника у свемиру је генерално константан. Из тога се може извући закључак да је међузвездана материјал богата криптоном.[27] Присуство овог гаса је доказано и у једном белом патуљку. При томе је измерена количина криптона око 450 пута већа него у Сунцу, а разлог великог удела тог гаса није познат.[28]
Добијање
[уреди | уреди извор]Добијање криптона се врши искључиво у оквирима Линдеовог поступка издвајањем из ваздуха. При раздвајању азота и кисеоника, криптон се обогаћује тј. концентише у течном кисеонику због велике густине, заједно са ксеноном на дну дестилационе колоне. Та смеса се преводи у наредну колону у којој се концентрације криптона и ксенона повећавају до 0,3%.[29] Она поред течног кисеоника и концентрата ксенона и криптона садржи још велике количине угљиководика попут метана, флуорираних једњења попут сумпор-хексафлуорида или тетрафлуорметана као и трагове угљен диоксида и азот-моноксида. Метан и диазот-моноксид се могу превести у угљен диоксид, воду и азот помоћу сагоревања на платинским или паладијумским катализаторима на 500 °C, те се адсорпцијом на молекуларном ситу могу уклонити.[30]
Међутим, из ове смесе на овај начин се не могу издвојити једињења флуора. Да би се она разложила и уклонила из смесе, гас се може озрачити микроталасима при чему пуцају везе између елемента и флуора а слободни атоми флуора могу се ухватити у натрон-кречу (смеса натријум- и калцијум-хидроксида)[31] или се преводе преко катализатора од титанијум диоксид-цирконијум диоксида на температури од 750 °C. У том процесу флуорова једињења реагирају до угљен диоксида и флуороводоника и других једињења, те се могу лако издвојити.[30]
Коначно, смеса криптона и ксенона се уводи у следећу колону, која се с горње стране хлади а с доње загрева, где се раздвајају. Ксенон се накупља на дну, док се према врху колоне формира струја гаса, којом прво одлази кисеоник, а након неког времена и криптон. Оксидацијом се криптон ослобађа заосталих трагова кисеоника те се сакупља и пакује у боце.[29]
Употреба
[уреди | уреди извор]
Највећи део производње криптона користи се за пуњење светиљки с лучним пражењењем. Због његове инертности, степен испаравања и оксидације жарних нити од волфрама је знатно спорији, што омогућава знатно вишу температуру жарења. Самим тим добија се и много виши степен искориштења рада светиљке. Криптон понекад улази и у састав халогених и флуоресцентних светиљки. Осим наведеног, он служи и као гас за пуњење у Гајгеровим бројачима, сцинтилацијским бројачима и електронским уређајима.[29] И поред високе цене неретко се ставља као гас за изолацију стаклених комора уместо много јефтинијег аргона, када се при истој дебљини стакленог зида жели остварити знатно боља изолација без обзира на трошкове.
Заједно са флуором, криптон се користи у криптон-флуорид ласерима. Ти ласери се убрајају у ексцимерне ласере а имају таласне дужине од 248 nm у ултраљубичастом спектралном подручју.[32] Такође, ласери на бази јона племенитих гасова садрже криптон, у којима су активни медији једноструко или вишеструко наелектрисани јони криптона.[33] Као и ксенон, криптон такође апсорбује рендгенско зрачење, мада у знатно мањој мери. Стога се испитује да ли се мешавина криптона и ксенона може користити као контрастно средство при компјутерској томографији (ЦТ). Таква смеса може дати бољи контраст него сâм ксенон, чији удео у контрастном средству је ограничен на највише 35% због његовог наркотичког деловања на људе.[34] Течни криптон се користи као материјал за калориметрију у физици честица. Он омогућава посебно тачно одређивање места и енергије.[35] Пример детектора честица, који користи калориметре на бази течног криптона, јесте експеримент NA48 при CERN-у.[36]
Референце
[уреди | уреди извор]- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ Krypton Архивирано на сајту Wayback Machine (29. јул 2013). encyclopedia.airliquide.com
- ^ „Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, triple, and critical temperatures of the elements”. CRC Handbook of Chemistry and Physics (85th изд.). Boca Raton, Florida: CRC Press. 2005.
- ^ а б Haynes, William M., ур. (2011). CRC Handbook of Chemistry and Physics (92nd изд.). Boca Raton, FL: CRC Press. стр. 4.121. ISBN 1439855110.
- ^ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). Kirk Othmer Encyclopedia of Chemical Technology. Wiley. pp. 343–383. „Noble Gases”. doi:10.1002/0471238961.0701190508230114.a01..
- ^ Magnetic susceptibility of the elements and inorganic compounds Архивирано на сајту Wayback Machine (12. јануар 2012), in Lide, D. R., ур. (2005). CRC Handbook of Chemistry and Physics (86th изд.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. стр. E110. ISBN 0-8493-0464-4.
- ^ Patrignani, C.; et al. (Particle Data Group) (2016). „Review of Particle Physics”. Chinese Physics C. 40 (10): 100001. Bibcode:2016ChPhC..40j0001P. doi:10.1088/1674-1137/40/10/100001. See p. 768
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ а б William Ramsay: The Rare Gases of the Atmosphere. Govor tokom dodjele Nobelove nagrade 12. decembar 1904.
- ^ а б John F. Lehmann, Hélène P. A. Mercier, Gary J. Schrobilgen, u: Coordination Chemistry Reviews. 2002, 233/234, str. 1–39, „The chemistry of krypton”. doi:10.1016/S0010-8545(02)00202-3..
- ^ K. Clusius, 1963, 19, 4, str. 169–177, „Zur Geschichte des Metermasses. u: Cellular and Molecular Life Sciences.”. doi:10.1007/BF02172293..
- ^ Međunarodni biro za mjere i utege: The BIPM and the evolution of the definition of the metre Архивирано 2011-06-07 на сајту Wayback Machine. Pristupljeno 10. decembra 2009.
- ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. u: Acta Crystallographica. 1974, 30, str. 193–204.
- ^ W. T. Ziegler, D. W. Yarbrough, J. C. Mullins: Calculation of the Vapor Pressure and Heats of Vaporization and Sublimation of Liquids and Solids below One Atmosphere Pressure. VI. Krypton. u: Ga. Inst. Technol., Eng. Exp. Stn., Proj. A-764, Tech. Rep. No. 1, 1964. (NIST webbook).
- ^ а б в Helmut Sitzmann: Krypton. Thieme Chemistry (izdavač): RÖMPP Online – Version 3.13. Georg Thieme Verlag KG, Stuttgart 2011.
- ^ R. M. Barrer, D. J. Ruzicka, 1962, 58, str. 2262–2271, „Non-stoichiometric clathrate compounds of water. Dio 4. – Kinetics of formation of clathrate phases. u: Transactions of the Faraday Society.”. doi:10.1039/TF9625802262..
- ^ Wolfram Saenger, Mathias Noltemeyer, 1972, 86, 16, str. 594–595, „Röntgen-Strukturanalyse des α-Cyclodextrin-Krypton-Einschlußkomplexes: Ein Edelgas in organischer Matrix. u: Angewandte Chemie”. doi:10.1002/ange.19740861611..
- ^ а б G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties Архивирано 2011-07-20 на сајту Wayback Machine (PDF). u: Nuclear Physics. 2003, vol. A 729, str. 3–128.
- ^ а б Dan Snyder: Resources on Isotopes – Periodic Table--Krypton Архивирано 2001-09-24 на сајту Wayback Machine. United States Geological Survey, stanje januar 2004.
- ^ Cauwels, P.; Buysse, J.; Poffijn, A.; Eggermont, G. (2001). „Study of the atmospheric 85Kr concentration growth in Gent between 1979 and 1999”. Radiation Physics and Chemistry. 61 (3–6): 649—651. Bibcode:2001RaPC...61..649C. doi:10.1016/S0969-806X(01)00361-9.
- ^ Cleveland, Z. I.; Pavlovskaya, G. E.; Elkins, N. D.; Stupic, K. F.; Repine, J. E.; Meersmann, T. (2008). „Hyperpolarized 83Kr MRI of lungs”. Journal of Magnetic Resonance (San Diego, Calif. : 1997). 195 (2): 232—237. PMID 18948043. doi:10.1016/j.jmr.2008.09.020.
- ^ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ^ David R. Williams: Earth Fact Sheet. NASA, Greenbelt, stanje 20. maj 2009.
- ^ A. G. W. Cameron: Abundances of the elements in the solar system. u: Space Science Reviews, 1970, 15, str. 121–146; PDF.
- ^ Cartledge, Stefan I. B.; Lauroesch, J. T.; Meyer, David M.; Sofia, Ulysses J.; Clayton, Geoffrey C. (2008). „Interstellar Krypton Abundances: The Detection of Kiloparsec-scale Differences in Galactic Nucleosynthetic History”. The Astrophysical Journal. 687 (2): 1043—1053. Bibcode:2008ApJ...687.1043C. arXiv:0808.0886
 . doi:10.1086/592132.
. doi:10.1086/592132.
- ^ Werner, Klaus; Rauch, Thomas; Ringat, Ellen; Kruk, Jeffrey W. (2012). „First Detection of Krypton and Xenon in a White Dwarf”. The Astrophysical Journal. 753 (1): L7. Bibcode:2012ApJ...753L...7W. doi:10.1088/2041-8205/753/1/L7.
- ^ а б в Häussinger, Peter; Glatthaar, Reinhard; Rhode, Wilhelm; Kick, Helmut; Benkmann, Christian; Weber, Josef; Wunschel, Hans-Jörg; Stenke, Viktor; Leicht, Edith; Stenger, Hermann (2001). „Noble Gases”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a17_485.
- ^ а б EP patent 1752417, Matthias Meilinger, "Process and apparatus for the production of krypton and/or xenon", issued 20. 9. 2005, assigned to Linde AG
- ^ Rostaing, Jean-Christophe; Bryselbout, Francis; Moisan, Michel; Parent, Jean-Claude (2000). „Méthode d'épuration des gaz rares au moyen de décharges électriques de haute fréquence”. Comptes Rendus de l'Académie des Sciences - Series Iv - Physics. 1 (1): 99—105. Bibcode:2000CRASP...1...99R. doi:10.1016/S1296-2147(00)70012-6.
- ^ Johnson, Thomas H.; Hunter, Allen M. (1980). „Physics of the krypton fluoride laser”. Journal of Applied Physics. 51 (5): 2406—2420. Bibcode:1980JAP....51.2406J. doi:10.1063/1.328010.
- ^ Helmut Sitzmann: Edelgas-Ionen-Laser. Thieme Chemistry (izdavač): RÖMPP Online – Version 3.13. Georg Thieme Verlag KG, Stuttgart 19. juni 2014.
- ^ Chon, Deokiee; Beck, Kenneth C.; Simon, Brett A.; Shikata, Hidenori; Saba, Osama I.; Hoffman, Eric A. (2007). „Effect of low-xenon and krypton supplementation on signal/Noise of regional CT-based ventilation measurements”. Journal of Applied Physiology. 102 (4): 1535—1544. PMID 17122371. doi:10.1152/japplphysiol.01235.2005.
- ^ Aulchenko, V.M.; Klimenko, S.G.; Kolachev, G.M.; Leontiev, L.A.; Onuchin, A.P.; Panin, V.S.; Pril, Yu.V.; Rodyakin, V.A.; Rylin, A.V.; Tayursky, V.A.; Tikhonov, Yu.A.; Cantoni, P.; Frabetti, P.L.; Stagni, L.; Lo Bianco, G.; Palombo, F.; Manfredi, P.F.; Re, V.; Speziali, V. (1990). „Investigation of an electromagnetic calorimeter based on liquid krypton”. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 289 (3): 468—474. Bibcode:1990NIMPA.289..468A. doi:10.1016/0168-9002(90)91518-G.
- ^ Mazzucato, E. (1997). „Status of the NA48 experiment at the CERN SPS”. Nuclear Physics B - Proceedings Supplements. 59 (1–3): 174—181. Bibcode:1997NuPhS..59..174M. doi:10.1016/S0920-5632(97)00440-4.
Литература
[уреди | уреди извор]- William P. Kirk "Krypton 85: a Review of the Literature and an Analysis of Radiation Hazards", Environmental Protection Agency, Office of Research and Monitoring, Washington (1972)
Спољашње везе
[уреди | уреди извор]- Krypton at The Periodic Table of Videos (University of Nottingham)
- Krypton Fluoride Lasers, Plasma Physics Division Naval Research Laboratory


