Цезијум
 | ||||||||||||||||||||||||||||
| Општа својства | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, симбол | цезијум, Cs | |||||||||||||||||||||||||||
| Изглед | бледо златан | |||||||||||||||||||||||||||
| У периодноме систему | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Атомски број (Z) | 55 | |||||||||||||||||||||||||||
| Група, периода | група 1 (алкални метали), периода 6 | |||||||||||||||||||||||||||
| Блок | s-блок | |||||||||||||||||||||||||||
| Категорија | алкални метал | |||||||||||||||||||||||||||
| Рел. ат. маса (Ar) | 132,90545196(6)[1] | |||||||||||||||||||||||||||
| Ел. конфигурација | ||||||||||||||||||||||||||||
по љускама | 2, 8, 18, 18, 8, 1 | |||||||||||||||||||||||||||
| Физичка својства | ||||||||||||||||||||||||||||
| Тачка топљења | 301,7 K (28,5 °C, 83,3 °F) | |||||||||||||||||||||||||||
| Тачка кључања | 944 K (671 °C, 1240 °F) | |||||||||||||||||||||||||||
| Густина при с.т. | 1,93 g/cm3 | |||||||||||||||||||||||||||
| течно ст., на т.т. | 1,843 g/cm3 | |||||||||||||||||||||||||||
| Критична тачка | 1938 K, 9,4 MPa[2] | |||||||||||||||||||||||||||
| Топлота фузије | 2,09 kJ/mol | |||||||||||||||||||||||||||
| Топлота испаравања | 63,9 kJ/mol | |||||||||||||||||||||||||||
| Мол. топл. капацитет | 32,210 J/(mol·K) | |||||||||||||||||||||||||||
Напон паре
| ||||||||||||||||||||||||||||
| Атомска својства | ||||||||||||||||||||||||||||
| Електронегативност | 0,79 | |||||||||||||||||||||||||||
| Енергије јонизације | 1: 375,7 kJ/mol 2: 2234,3 kJ/mol 3: 3400 kJ/mol | |||||||||||||||||||||||||||
| Атомски радијус | 265 pm | |||||||||||||||||||||||||||
| Ковалентни радијус | 244±11 pm | |||||||||||||||||||||||||||
| Валсов радијус | 343 pm | |||||||||||||||||||||||||||
| Остало | ||||||||||||||||||||||||||||
| Кристална структура | унутрашњецентр. кубична (BCC) | |||||||||||||||||||||||||||
| Топл. ширење | 97 µm/(m·K) (на 25 °C) | |||||||||||||||||||||||||||
| Топл. водљивост | 35,9 W/(m·K) | |||||||||||||||||||||||||||
| Електроотпорност | 205 nΩ·m (на 20 °C) | |||||||||||||||||||||||||||
| Магнетни распоред | парамагнетичан[3] | |||||||||||||||||||||||||||
| Јангов модул | 1,7 GPa | |||||||||||||||||||||||||||
| Модул стишљивости | 1,6 GPa | |||||||||||||||||||||||||||
| Мосова тврдоћа | 0,2 | |||||||||||||||||||||||||||
| Бринелова тврдоћа | 0,14 MPa | |||||||||||||||||||||||||||
| CAS број | 7440-46-2 | |||||||||||||||||||||||||||
| Историја | ||||||||||||||||||||||||||||
| Именовање | од латинског caesius, небеско плаво, због његових спектралних боја | |||||||||||||||||||||||||||
| Откриће | Роберт Бунзен и Густаф Кирхоф (1860) | |||||||||||||||||||||||||||
| Прва изолација | Карл Сетерберг (1882) | |||||||||||||||||||||||||||
| Главни изотопи | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Цезијум (Cs, лат. caesium) алкални је метал прве групе Периодног система, шеста периода. Име му потиче од латинске речи за плавичасто.[5][6] По својим физичким, а посебно хемијским својствима веома је налик рубидијуму, који се налази у истој групи у петој периоди. Такође у природи се готово увек налазе заједно. Највећа разлика јесте та што рубидијум, попут калијума, показује слабу бета-радиоактивност, а цезијум не.[7]
Мале количине цезијума се налазе, уз остале алкалне метале, у различитим алумосиликатима (лепидолит, леуцит, цинвалдит). Минерал цезијума је полуцит (). У Земљиној кори заступљен је у количини од 3 ppm (енгл. parts per million). Гори плаво-љубичастим пламеном, и то у супероксид, .
Као елементарна супстанца цезијум се не добија у значајнијим количинама. За ту сврху се обично користи редукција цезијум-хидроксида или карбоната загревањем са алуминијумом или магнезијумом. Цезијум-хлорид се може загревати са калцијумом и та метода је најзахвалнија за његово елементарно добијање.[7]
Једињења цезијума показују слична својства као иста та једињења рубидијума и калијума. Ипак, за разлику од халогенида рубидијума који имају кристалну решетку као натријум-хлорид, цезијум-хлорид, цезијум-бромид и цезијум-јодид имају кубичну кристалну решетку у којој углове коцке заузимају цезијумови јони, а у средишту је хлоридни јон. Гледајући ширу слику, та решетка је даље формирана тако да се може замислити и да на угловима коцке се налазе хлоридни јони, а у средишту цезијум-јон. Разлика у кристалној решетки између цезијум-хлорида и натријум-хлорида узрокована је величином цезијумовог јона, око ког се може сместити 8 хлоридних јона.[7]
Историја
[уреди | уреди извор]
Цезијум је први пут описан 1861. године, а открили су га Густаф Роберт Кирхоф и Роберт Wилхелм Бунсен. Они су проучавали две, дотад непознате, спектралне линије које су се појавиле након што су из минералне воде из извора у Диркхајму издвојили калцијум, стронцијум, магнезијум и литијум. Из свог проучавања су закључили да у минералној води постоји још један дотад непознати елемент, који су назвали caesium, од латинског caesius у значењу небеско плаво, због тих плавих спектралних линија.[8]
Бунсен је покушавао да одвоји цезијум од других алкалних метала, да би проучио друге особине новооткривеног елемента. Зато је покушао да раздвоји раствор помоћу раствора платина(IV) хлорида, како би исталожио калијум и нове тешке алкалне метале рубидијум и цезијум као нерастворљиви хексахлоридплатинат. Калијум је успео да одвоји након неколико прокувавања раствора са мало воде. Да би добио чисти хлорид, редуковао је платину до елементарног стања помоћу водоника, тако да је тиме добио само нерастворљиви талог цезијум- и рубидијум-хлорида. Одвајање цезијума и рубидијума је успело након што је искористио појаву различитог степена растворљивости карбоната у апсолутном етанолу, где је цезијум-карбонат растворљив за разлику од одговарајућег рубидијевог једињења. Цезијум-хлорид је Бунсену и Кирхофу служио и за прве процене о моларној маси нових елемената, за које су установили вредност од 123,35 g/mol.[8]
Ни један од ових научника није добио елементарни цезијум, јер је након електролизе раствореног цезијум-хлорида умјесто чистог метала настало плаво једињење, које су они назвали субхлорид, а заправо се највероватније радило о некој обојеној смеси цезијума и цезијум-хлорида.[9] При електролизи воденог раствора путем живине аноде ствара се један лако разградиви цезијум амалгам.[8]
Тек је 1881. године Карл Сетербер успео да добије елементарни цезијум, који је решио проблем са хлоридом, тако што је употребио цезијум цијанид током процеса суве електролизе. Иако је при том поступку била потребна изразито висока температура, да би се цезијум-цијанид истопио, он се распао преко еутетског система са баријум цијанидом.[10]
Особине
[уреди | уреди извор]Физичке особине
[уреди | уреди извор]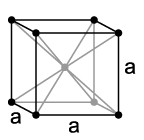

У свом најчистијем стању, цезијум је сребрнасти лаки метал који има густину од 1,9 g/cm3, међутим уколико дође у контакт и с најмањом количином нечистоће, појављује се златножути одсјај. По многим особинама он стоји између рубидијума, колико је до данас познато, и нестабилног францијума. Са изузетком францијума, он има најнижу тачку топљења од свих алкалних метала која износи 28,7 °C, након живе и галијума, међу најнижим тачкама топљења од свих метала уопште. Цезијум је веома мекан (тврдоћа по Мосовој скали 0,2) и врло лако се извлачи.
Као и код других алкалних метала, цезијум се при нормалним стандардним условима кристализује у кубном кристалном систему са једном кубно-просторно центрираном елементарном ћелијом у просторној групи са параметром решетке a = 614 pm као и две формулске групе по свакој елементарној ћелији. Под притиском од 41 kbar долази до промене фазе у кубично-површински центрирану кристалну структуру са параметром решетке a = 598 pm.[11]
Уз изузетак литијума, цезијум се може мешати са другим алкалним металима у произвољном односу. Легура од 41% цезијума, 12% натријума и 47% калијума има најнижу до данас познату температуру топљења која износи −78 °C.[12]
Атом цезијума као и јон Cs+ имају изразито велики атомски пречник; они су, уз изузетак францијума, највећи појединачни атоми односно јони који постоје у природи. Ово зависи од посебно ниског ефективног набоја језгра, због чега је најудаљенији s-електрон само у веома малој мери повезан са језгром. Та појава, поред великог атомског пречника и ниске енергије јонизације атома цезијума, даје му особине неуобичајено велике реактивности међу елементима.[13]
Цезијум у гасовитом стању има неуобичајен индекс преламања светлости који је мањи од један. То значи да фазна брзина електромагнетних таласа - у овом случају светлости - је већа него у вакууму. Међутим, пошто се тиме не могу преносити информације нити материја, и даље вреде постулати специјалне теорије релативитета.[14]
Хемијске особине
[уреди | уреди извор]Поред францијума, цезијум је елемент са најнижом енергијом јонизације. Због одвајања најудаљенијег електрона од језгра, јавља се и најнижа вредност електронегативности. Атом цезијума у контакту са другим елементима веома лако отпушта овај електрон и формира једновалентне цезијумске соли. Пошто отпуштањем овог једног електрона достиже електронску конфигурацију племенитог гаса, он не формира двовалентне и вишевалентне јоне.
Реакције са цезијумом по правилу се одвијају врло бурно, тако да на пример у контакту са кисеоником, цезијум се одмах запали, те попут калијума и рубидијума, гради одговарајуће хипероксиде.
Такође, цезијум у додиру с водом веома бурно реагује и гради цезијум хидроксид. Ова реакција се одвија и са ледом при температури од −116 °C.[15]
Изотопи
[уреди | уреди извор]
Свеукупно је познато 39 изотопа цезијума и 23 нуклеарних изомера. У природи јавља се само изотоп 133Cs. Због тога је цезијум изотопски посматрано чисти елемент. Међу вештачким изотопима, изотопи 134Cs са 2,0648 година, 135Cs са 2,3 милиона година и 137Cs са 30,17 година, имају средње и веома дуго време полураспада. Код осталих познатих изотопа, време полураспада износи између 17 µs код изотопа 113Cs до 13,16 дана код изотопа 136Cs.[16]
Један од најважнијих вештачких изотопа је управо 137Cs, који зрачи бета-зраке а време полураспада му је 30,17 година.[17] 137Cs се распада уз вероватноћу од 94,6% прво на метастабилни међупроизвод 137mBa, који са временом полураспада од 2,552 минута путем гама распада прелази у стабилни изотоп баријума 137Ba. Код осталих 5,4% дешава се директан прелаз у стабилни изотоп баријума 137Ba. Заједно са другим изотопима цезијума настаје приликом разбијања атома у нуклеарним реакторима.
- Стварање изотопа 137Cs при цепању атома 235U.[18]
Изотоп 137Cs је поред изотопа кобалта 60Co један од најважнијих извора гама зрачења и користи се у терапији зрачењем за лечење малигних обољења, за мерење брзине тока у цевима и испитивања дебљине папира, филма или метала.[19] Осим тога, служи и за контролу квалитета у нуклеарној медицини као дуговечни нуклид за испитивање зрачења.[20]
Веће количине изотопа 137Cs су доспеле у околину путем надземних нуклеарних проби, након чернобиљске катастрофе те после катастрофе у јапанској нуклеарној централи Фукушима. Код свих надземних проба атомског оружја, испуштена радиоактивност изотопа 137Cs износила је 948×1015 бекерела.[21] Укупна количина 137Cs, која се ослободила након чернобиљске несреће имала је активност од око 85×1015 Bq.[21] На то треба додати активност од око 47×1015 Bq коју је емитовао изотоп 134Cs и 36×1015 Bq путем изотопа 136Cs.[21] Путем радиоактивних падавина, многа подручја широм Европе су загађена радиоактивним цезијумом.[22][23] Изотоп 137Cs се нарочито накупља у гљивама које могу разграђивати лигнин те тако имају лакши приступ калијуму од биљака и на тај начин и до хемикалија које су сличне цезијуму. То се посебно односи на гљиве Xerocomus badius (познату као костањевка) и Boletus erythropus које су познате као сакупљачи цезијума, док на пример сродна врста камењара Boletus edulis показује доста слабу активност прикупљања цезијума. Узрок високе загађености цезијумом за обе наведене врсте гљива је због пигмента њиховог клобука (Бадион А и Норбадион А), који могу комплексирати цезијум.[24][25] У гљиви камењари нема ових деривата пулвинске киселине.[26] Угрожене су и дивље животиње које једу гљиве.[27] Тачан обим загађења цезијумом зависи од доспеле количине путем падавина и способности земљишта да веже цезијум и омогућавајући тако биљкама да дођу до њега.[28]
У Јапану су велика подручја загађена цезијумом 137Cs након несреће у нуклеарном реактору у Фукушими.[29] Године 1987. десио се случај крађе апарата намењеног за терапије зрачењем у Бразилу, из кога је извађен цезијум 137Cs. При томе је неколико људи умрло од последица зрачења.[30]
Примена
[уреди | уреди извор]Цезијум, као и рубидијум, користи се за израду фотоелектричних ћелија.
Поред тога, атомски часовници направљени од цезијума користе електромагнетне прелазе у хиперфиној структури атома цезијума-133 као референтну тачку. Ови часовници мере фреквенцију са грешком од 2 до 3 јединице на 1014, што одговара тачности од 2 наносекунде дневно, или једну секунду у 1,4 милиона година. Најновије верзије оваквих часовника још нису у употреби, али су још тачније и праве грешку у на 1015, што је око 1 секунду на 20 милиона година. Атомски часовници направљени од цезијума данас регулишу време на Интернету, као и време мреже мобилних телефонија.
Галерија
[уреди | уреди извор]-
Цезијумови кристали, изотопа 133Cs веома високе чистоће смештени у инертној атмосфери, аргону.
-
Цезијумови кристали (златни), у поређењу са рубидијумовим кристалима (сребрни).
-
Цезијум приликом додира са водом даје бурну експлозивну реакцију.
-
Схематски приказ кристалне решетке цезијум-хлорида.
-
Атомски часовници у Америчкој морнаричкој опсерваторији.
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ Haynes, William M., ур. (2011). CRC Handbook of Chemistry and Physics (92nd изд.). Boca Raton, FL: CRC Press. стр. 4.121. ISBN 1439855110.
- ^ „Magnetic susceptibility of the elements and inorganic compounds”. Handbook of Chemistry and Physics (PDF) (87th изд.). CRC press. ISBN 0-8493-0487-3. Архивирано из оригинала (PDF) 12. 01. 2012. г. Приступљено 2010-09-26.
- ^ „NIST Radionuclide Half-Life Measurements”. NIST. Архивирано из оригинала 12. 03. 2011. г. Приступљено 2011-03-13.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ а б в Филиповић Иван, Липановић Стјепан „Opća i anorganska kemija – I. dio”, Национална и универзитетска библиотека (Загреб: Школска књига). Девето издање 1995, стр. 917-918.
- ^ а б в G. Kirchhoff; R. Bunsen (1861). „Chemische Analyse durch Spectralbeobachtungen”. Annalen der Physik und Chemie. 189 (7): 337—381. doi:10.1002/andp.18611890702.
- ^ Richard Zsigmondy (2007). Colloids and the Ultramicroscope. Read books. стр. 69. ISBN 978-1-4067-5938-9.
- ^ Carl Setterberg (1881). „Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst”. Justus Liebigs Annalen der Chemie. 221 (1): 100—116. doi:10.1002/jlac.18822110105.
- ^ K. Schubert (1974). „Ein Modell für die Kristallstrukturen der chemischen Elemente”. Acta Crystallographica. B30: 193—204. doi:10.1107/S0567740874002469.
- ^ Arnold F. Holleman; Nils Wiberg (2007). Lehrbuch der Anorganischen Chemie (102 изд.). Berlin: de Gruyter. стр. 1273. ISBN 978-3-11-017770-1.
- ^ Michael Binnewies; Michael Jäckel; Helge Willner (2003). Allgemeine und Anorganische Chemie. Berlin: Spektrum Akademischer Verlag. стр. 49—53. ISBN 978-3-8274-0208-0.
- ^ L. J. Wang; A. Kuzmich; A. Dogariu (2000). „Gain-assisted superluminal light propagation”. Nature. 406: 277—279. doi:10.1038/35082117.
- ^ Caesium na webelements.com, 5. septembar 2009.
- ^ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. u: Nuclear Physics. 2003, Bd. A 729, str. 3–128.
- ^ M.P. Unterweger: Half-life measurements at the National Institute of Standards and Technology. u: Applied Radiation and Isotopes. 56, 2002, str. 125–130
- ^ Martin Volkmer (1996). Basiswissen Kernenergie. Bonn: Informationskreis Kernenergie. стр. 30. ISBN 3-925986-09-X.
- ^ Radioisotope Brief: Cesium-137 (Cs-137). Centers for Disease Control and Prevention, Atlanta 2006, 25. septembar 2009.
- ^ L. Geworski; Chr. Reiners (2003). „Qualitätsprüfung nuklearmedizinischer Messsysteme: Konstanzprüfung”. Empfehlungen zur Qualitätskontrolle in der Nuklearmedizin. Stuttgart / New York: Schattauer Verlag. стр. 258—263. ISBN 3-7945-2242-7.
- ^ а б в Izvještaj UNSCEAR 2008. Sources and effects of ionizing radiation. Knjiga 2. Annex D - Health effects due to radiation from the Chernobyl accident. New York 2011, str. 49.
- ^ B. Turković: Nakon tragedije u Černobilu prije 25 godina, čelnici CK SKBiH ozračene janjce podvalili restoranima, Dnevni Avaz, 19. mart 2011.
- ^ Aleksandra Bosiočić - Dronjić: Je li moguća radioaktivna kiša iznad BiH, 14. mart 2011.
- ^ D. C. Aumann, G. Clooth, B. Steffan, W. Steglich: Komplexierung von Caesium-137 durch die Hutfarbstoffe des Maronenröhrlings (Xerocomus badius). u: Angewandte Chemie' vol. 101, br. 4, 1989, str. 495–496.
- ^ P. Kuad, R. Schurhammer, C. Maechling, C. Antheaume, C. Mioskowski, G. Wipff, B. Spiess: Complexation of Cs+, K+ and Na+ by norbadione A triggered by the release of a strong hydrogen bond: nature and stability of the complexes. u: Phys Chem Chem Phys. 11, 2009, str. 10299–10310.
- ^ B. Steffan, W. Steglich: Die Hutfarbstoffe des Maronenröhrlings (Xerocomus badius). u: Angewandte Chemie knjiga 96, br. 6, juni 1984, str. 435–437.
- ^ Landesanstalt für Umwelt, Messungen und Naturschutz Baden-Württemberg: Radioaktivitätsbelastung in Wild. Архивирано 2008-06-19 на сајту Wayback Machine 2007.
- ^ Jenny Hartmann-Schreier: Caesium 137, Caesium 134. u: Römpp Chemie-Lexikon, Thieme-Verlag, mart 2006.
- ^ Fukushima, Große Mengen Cäsium 137 auf Japans Boden u Spigel Online, 15. novembar 2011.
- ^ IAEA: Radiological Accident in Goiânia. Beč 1988, HTML (PDF), 13. decembar 2007.
Литература
[уреди | уреди извор]- Fritz Blatter; Ernst Schuhmacher (1986). „Production of high purity caesium”. Journal of the Less Common Metals. 115 (2): 307—313. doi:10.1016/0022-5088(86)90153-0.
Додатна литература
[уреди | уреди извор]- Rogachev, Andrey Yu.; Miao, Mao-Sheng; Merino, Gabriel; Hoffmann, Roald (2015). „Molecular CsF5and CsF2+”. Angewandte Chemie. 127 (28): 8393—8396. doi:10.1002/ange.201500402.
Спољашње везе
[уреди | уреди извор]

- Caesium or Cesium at The Periodic Table of Videos (University of Nottingham)
- View the reaction of Caesium (most reactive metal in the periodic table) with Fluorine (most reactive non-metal) courtesy of The Royal Institution.












