Стронцијум
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општа својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, симбол | стронцијум, Sr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | сребрнасто бео металичан; са бледожутом нијансом[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| У периодном систему | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број (Z) | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група, периода | група 2 (земноалкални метали), периода 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | s-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | земноалкални метал | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рел. ат. маса (Ar) | 87,62(1)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ел. конфигурација | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по љускама | 2, 8, 18, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физичка својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тачка топљења | 1050 K (777 °C, 1431 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тачка кључања | 1650 K (1377 °C, 2511 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина при с.т. | 2,64 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| течно ст., на т.т. | 2,375 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлота фузије | 7,43 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлота испаравања | 141 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мол. топл. капацитет | 26,4 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Напон паре
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомска својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | 0,95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергије јонизације | 1: 549,5 kJ/mol 2: 1064,2 kJ/mol 3: 4138 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски радијус | 215 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентни радијус | 195±10 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Валсов радијус | 249 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Остало | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | постраничноцентр. кубична (FCC) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топл. ширење | 22,5 µm/(m·K) (на 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топл. водљивост | 35,4 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електрична отпорност | 132 nΩ·m (на 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетни распоред | парамагнетичан | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетна сусцептибилност (χmol) | −92,0·10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Јангов модул | 15,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул смицања | 6,03 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поасонов коефицијент | 0,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мосова тврдоћа | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS број | 7440-24-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Именовање | по миниералу стронцијаниту, који је назван по Стронтијану, Шкотска | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откриће | Вилијам Круикшаку (1787) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прва изолација | Хамфри Дејви (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Главни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Стронцијум (Sr, лат. strontium), земноалкални је метал IIA групе[4] и пете периоде.
Откривен је 1790. године (Adair Crawford) и по хемијским особинама сличан је Са и Ва. Представља смешу 4 природна изотопа (84Sr, 86Sr, 87Sr и 88Sr), а познато је и 19 радиоактивних, који су основне компоненте радиоактивног отпада и настају у нуклеарним реакторима и бомбама — фисиони производи уранијума и плутонијума. Концентришу се у костима, одакле се врло тешко уклањају, а међу њима најважнији је 90Sr (T1/2 = 27,7 год.).
То је сребрнастобео, лак метал, који је као и остали елементи IIa групе хемијски веома активан. Запаљен на ваздуху он енергично сагорева, бојећи пламен у црвенољубичасту боју:
што се употребљава у аналитици за одређивање, а у пиротехници за ракете за сигнализацију и осветљавање (тзв. „бенгалска ватра“).
Оксид стронцијума је бела, врло тешко топљива материја, која лако реагује са водом градећи стронцијумхидроксид, Sr(ОН)2:
који може да се добије и у реакцији стронцијумхлорида са алкалним хидроксидима:
- .
То је јака и у води добро растворљива база и употребљава се у индустрији шећера.
Историја[уреди | уреди извор]
Прве доказе о постојању овог елемента нашли су Адар Крофорд и Вилијам Каберлаенд Круикшанк 1790. године, када су детаљније проучили један минерал који потиче из села Стронцијан из Шкотске. Дотад су тај минерал сматрали баријум карбонатом или минералом витеритом. Од минерала су начинили хлорид те су успоређивали многе особине баријум хлорида и новонасталог хлорида, касније познатог као стронцијум хлорид. Притом су утврдили да се хлориди разликују у растворљивости у води, а различите су биле у форме кристала. Касније је Фридрих Габриел Салзер 1791. године[5] новом минералу дао име стронцијанит по месту где је пронађен. Салзер и Јохан Фридрих Блуменбах још су прецизније проучавали минерал и пронашли и друге разлике у односу на витерит, као што су различит степен отровности и боја пламена.[6] Следећих година стронцијанит су детаљније проучавали хемичари као што су Мартин Хајнрих Клапрот, Ричард Кирван, Томас Чарлс Хоуп и Џоната Тобајс Ловиц те су из њега добили друга једињења стронцијума.[7]
Хамфри Дејви је успео 1808. да добије стронцијум у металном стању електролитичком редукцијом у присуству црвеног жива(II) оксида, чиме је настао амалгам, те га је на крају прочистио дестилацијом. Тако добијени стронцијум и даље је садржавао трагове других елемената.[8] Он га је назвао стронцијум по минералу стронцијаниту, аналогно другим земноалкалним металима. Чисти елементарни стронцијум добио је Роберт Бунзен 1855. електролизом истопљеног стронцијум-хлорида. Такође је утврдио неке особине метала стронцијума као што је густина.[9]
Особине[уреди | уреди извор]
Физичке[уреди | уреди извор]
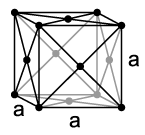
У потпуно чистом елементарном стању, стронцијум је свијетли, златножути, сјајни метал[10], док му примесе других елемената дају сребрнастобели изглед. У присуству ваздуха на његовој површини ствара се заштитни слој оксида, слично као и код алуминијума. По температури топљења од 777 °C и температури кључања од 1380 °C налази се између лаког калцијума и тежег баријума, тако да калцијум има нешто више, а баријум нешто ниже талиште. Након магнезијума и радијума стронцијум има најнижу тачку кључања међу земноалкалним металима. Убраја се у лаке метале и има густину 2,63 g/cm3. Врло је мек, по Мосовој скали има тврдоћу 1,5 и може се лако савијати и ваљати. Попут калцијума, стронцијум на собној температури се кристализује у кубни површински центрирани кристални систем, просторна група Fmm (тип бакра) с параметром решетке a = 608,5 pm са четири формулске јединице по елементарној ћелији. Осим ове, познате су још две модификације које настају на високим температурама. На температури вишој од 215 °C кристална структура мења се у хексагоналну компактну сферичну структуру (тип магнезијума) с параметрима решетке a = 432 pm и c = 706 pm. Изнад 605 °C најстабилнија је кубна просторно центрирана структура (тип волфрама).[11]
Хемијске[уреди | уреди извор]
Након баријума и радијума стронцијум је најреактивнији земноалкални метал. Он реагује с халогеним елементима, кисеоником, азотом и сумпором, градећи оксиде, хидроксиде, флуориде и соли органских киселина. У свим својим једињењима увек гради двовалентне катјоне. При загрејавању на ваздуху сагорева дајући типични јаркоцрвени пламен, оксидирајући на стронцијум оксид и стронцијум нитрид. Као веома неплеменит (базни метал), реагује с водом истерујући водоник и градећи стронцијум хидроксид, који се ствара већ при контакту метала с влагом из ваздуха. Стронцијум се раствара и у амонијаку, градећи плаво-црни комплекс (амонијакат).
Изотопи[уреди | уреди извор]
Позната су 32 изотопа стронцијума и седам нуклеарних изомера, чије су атомске масе између 75 и 101.[12] Од њих су стабилна четири изотопа, која се јављају у природи: 84Sr, 86Sr, 87Sr и 88Sr. У природној смеси изотопа превладава изотоп 88Sr с уделом 82,58%. Изотопи 86Sr с уделом 9,86%, 87Sr са 7%, као и 84Sr с уделом 0,56% много су ређи.[13] Изотоп 90Sr емитује бета зраке енергијом распада од 546 keV с временом полураспада 28,78 година, након чега прелази у изотоп 90Y, који се даље распада (време полураспада 64,1 сат), емитирајући енергетски снажније бета (енергија распада од 2282 keV) и гама-зраке, дајући стабилни изотоп 90Zr. Притом се 90Sr појављује углавном као секундарни производ распада. Настаје у току неколико минута након вишеструког бета-распада из примарних производа распада масеног броја 90, који се јавља при 5,7%[14] од свих нуклеарних распада изотопа уранијума 235U у нуклеарним реакторима и при експлозији атомске бомбе. Због тога се изотоп 90Sr убраја међу најчешће производе распада уопће.[15]
Код свих досадашњих нуклеарних катастрофа у свету у околину су доспеле велике количине изотопа 90Sr. Несреће услед којих је у околину испуштен изотоп 90Sr, између осталих, јесу пожар у нуклеарној централи Виндскејл 1957, када је испуштено 0,07 TBq 90Sr,[16] и Чернобиљска катастрофа, кад је испуштена радиоактивност 90Sr износила 800 TBq.[17] Након надземних нуклеарних тестова у периоду 1955–1958, те 1961-1963 изузетно је порасла концентрација 90Sr у атмосфери. То је довело, заједно с повећањем концентрације изотопа 137Cs, до потписивања споразума о забрани нуклеарних тестова у атмосфери, свемиру и под водом 1963, којим су такви тестови забрањени свим државама потписницама. Након тог споразума приметно је значајно смањење испуштања стронцијумевог изотопа у атмосферу.[18] Укупна количина испуштене радиоактивности 90Sr у нуклеарним тестовима износи приближно 6×1017 Bq (600 PBq).[15]
Стронцијум се концентрише се у костима одакле се врло тешко уклањају и најзначајнији међу њима је 90Sr (Т1/2=27,7 година) који настаје као производ радиоактивног распада. Услед недостатка калцијума у костима, стронцијум може да заузме његово место и утиче на околно ткиво изазивајући рак коштаног ткива. Већина стена садржи мале количине стронцијума и однос 87Sr и 86Sr варира према локалној геолошкој области. Старије стене акумулирају веће количине 87Sr. Људи и животиње апсорбују стронцијум кроз воду и храну коју конзумирају стварајући тако свој „хемијски потпис геолошке средине.”[19]. Анализа стабилних изотопа стронцијума нашла је широку примену у археологији. То оправдава чињеницу да се стронцијумови изотопи таложе у костима и зубима, док код животиња то могу бити и рогови који се формирају у различитим фазама живота[20].
Зубна глеђ се формира у првим годинама живота и не мења се током старости, па сродно томе стронцијум у глеђи зуба одговара геолошкој области где је човек провео своје детињство. Насупрот томе, стронцијум се у костима постепено мења током 7-10 година и открива регион где људи проводе последње деценије свог живота. Упоређивањем нивоа изотопа стронцијума у костима и зубима са оним у одређеним областима, може се рећи да ли је особа мигрирала између детињства и смрти, а понекад је могуће одредити и где је особа рођена[19].
Добијање стронцијума[уреди | уреди извор]
Добија се електролизом истопљеног стронцијум-хлорида, са додатком калцијум-хлорида, или редукцијом стронцијум-оксида алуминијумом, у вакууму. Остала једињења стронцијума слична су једињењима калцијума. Познат је стронцијумкарбонат, SrCO3, који се издваја приликом прераде меласе у тешко растворљиви стронцијумсахарат, Cl2Н22O11•2SrO. А поред тога, може да се добије у реакцији стронцијумхлорида са амонијумкарбонатом:
и веома је лако растворљив у води која је богата угљен-диоксидом:
Од осталих једињења познат је и стронцијумнитрат, Sr(NO3)2, који се употребљава у пиротехници за „црвене ватре“, затим стронцијумсулфат, SrSO4, стронцијумхромат, SrCrO4 итд.
Стронцијум у природи[уреди | уреди извор]
Стронцијум је релативно редак елемент (370 ppm) и у природи се најчешће проналази у облику минерала: целестина (стронцијумсулфата), SrSO4 и стронцијанита (стронцијумкарбоната), SrCO3.[21][22]. Присутан је у многим минералним, речним, морским и подземним водама. У изградњи Земљине коре учествује са масеним уделом 0,017% [12] Гради: оксиде, хидроксиде, флуориде и соли органских киселина. Нема биолошког значаја, али може да заступа калцијум у организму без споредних последица. Чист стронцијум експлозивно реагује са водом и често се користи као додатак неким врстама стакла[23].
Примена[уреди | уреди извор]
Стронцијум спада у групу оних елемената који још увек нису у потпуности проучени, не јавља се тако често у природи и нема неке значајније примене. Минерали и соли стронцијума имају примену у металургији (чишћење челика од Р и S), хемијској индустрији, и за обогаћивање минералних сировина, а халогениди у индустрији хлађења, медицини и козметици и наравно археологији, где анализом стронцијума помоћу физичко-хемијских метода можемо да дамо одговоре на питања везана о пореклу неке индивидуе.
Референце[уреди | уреди извор]
- ^ Greenwood and Earnshaw, p. 112
- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. стр. E110. ISBN 0-8493-0464-4.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Hans Lüschen (1968). Die Namen der Steine. Das Mineralreich im Spiegel der Sprache (2 изд.). Thun, München: Ott Verlag. стр. 329, 381. ISBN 978-3-7225-6265-0.
- ^ J. F. Blumenbach: Ueber den Strontianit, ein Schottisches Fossil, das ebenfalls eine neue Grunderde zu enthalten scheint; und über einige andere naturhistorische Merkwürdigkeiten u: Johann Heinrich Voigt (ur.), Magazin für das Neueste aus der Physik und Naturgeschichte. 1891, 8, 3, str. 68–72
- ^ J. R. Partington (1942). „The early history of strontium”. Annals of Science. 5 (2): 157—166. doi:10.1080/00033794200201411.
- ^ Humphry Davy: Electro-Chemical Researches, on the Decomposition of the Earths; With Observations on the Metals Obtained from the Alkaline Earths, and on the Amalgam Procured from Ammonia. u: Philosophical Transactions of the Royal Society of London. 1808, 98, str. 333–337. (sažetak).
- ^ Robert Bunsen (1855). „Darstellung des Lithiums”. Justus Liebigs Annalen der Chemie. 94 (1): 107—111. doi:10.1002/jlac.18550940112.
- ^ Arnold F. Holleman; Nils Wiberg (2007). Lehrbuch der Anorganischen Chemie (102 изд.). Berlin: de Gruyter. стр. 1238. ISBN 978-3-11-017770-1.
- ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. u: Acta Crystallographica. 1974, B30, str. 193.
- ^ а б Филиповић И. Липановић С.1988. Опћа и анорганска кемија. Загреб: Школска књига
- ^ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties Архивирано на сајту Wayback Machine (24. јул 2013) (PDF). u: Nuclear Physics. 2003, vol. A 729, str. 3–128.
- ^ Martin Volkmer (1996). Basiswissen Kernenergie. Bonn: Informationskreis Kernenergie. стр. 30. ISBN 3-925986-09-X.
- ^ а б Helmut Sitzmann: Strontium. Thieme Chemistry (izdavač): RÖMPP Online – Version 3.13. Georg Thieme Verlag KG, Stuttgart 2011.
- ^ Windscale-Kernreaktorunfall. u: Römpp Chemie-Lexikon. Thieme Verlag, mart 2002.
- ^ Tschernobyl-Kernreaktorunfall. u: Römpp Chemie-Lexikon. Thieme Verlag, mart 2002.
- ^ Jozef Goldblat; David Cox (1988). Nuclear weapon tests: prohibition or limitation?. Stockholm International Peace Research Institute, Oxford University Press. стр. 83-85. ISBN 978-0-19-829120-6.
- ^ а б Fovler B.2007. Uncovering the Life and Times of a Prehistoric Man found in a Alpine Glacier. Chicago: Iceman
- ^ Мелор Џ. В. 1968. Модерна неорганска хемија. Београд: Научна књига
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ Бојановић Ј. Чорбић М.1991. Општа хемија. Горњи Милановац: Дечје новине
- ^ Арсенијевић С.1986. Општа и неорганска хемија. Београд: Научна књига
Литература[уреди | уреди извор]
- Harry H. Binder (1999). Lexikon der chemischen Elemente. Stuttgart: S. Hirzel Verlag. ISBN 3-7776-0736-3.
- Ludwig Bergmann; Clemens Schaefer; Rainer Kassing (2005). Lehrbuch der Experimentalphysik, vol. 6: Festkörper (2 изд.). Walter de Gruyter. стр. 361. ISBN 978-3-11-017485-4.
- Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: J. Phys. Chem. A. 2009, 113, str. 5806–5812, . doi:10.1021/jp8111556. Недостаје или је празан параметар
|title=(помоћ) - N. N. Greenwood; A. Earnshaw (1988). Chemie der Elemente (1 изд.). Weinheim: VCH. стр. 136. ISBN 3-527-26169-9.
- Yiming Zhang; Julian R. G. Evans; Shoufeng Yang (2011). „Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks”. Journal of Chemical & Engineering Data. 56: 328—337. doi:10.1021/je1011086.
- Protelos and Osseor Архивирано на сајту Wayback Machine (3. јул 2018), Evropska medicinska agencija
- David R. Lide, ур. (2009). CRC Handbook of Chemistry and Physics (90 изд.). Boca Raton, Florida: CRC Press. ISBN 1420090844., Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea
- J. Paul MacMillan; Jai Won Park; Rolf Gerstenberg; Heinz Wagner; Karl Köhler; Peter Wallbrecht (2005). „Strontium and Strontium Compounds”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a25_321.
- Marc A. Angulo: Strontium (PDF; 85 kB). U.S. Geological Survey, Mineral Commodity Summaries, januar 2010.
- De Deckker Patrick (2004). „On the celestite-secreting Acantharia and their effect on seawater strontium to calcium ratios”. Hydrobiologia. 517: 1. doi:10.1023/B:HYDR.0000027333.02017.50.
- Pors Nielsen S. (2004). „The biological role of strontium”. Bone. 35 (3): 583—8. doi:10.1016/j.bone.2004.04.026.
- Cabrera Walter E.; et al. (1999). „Strontium and Bone”. Journal of Bone and Mineral Research. 14 (5): 661—8. doi:10.1359/jbmr.1999.14.5.661.
- „Strontium”. Gießereilexikon (17 изд.). Berlin: Verlag Schiele&Schön. 1997. ISBN 3-7949-0606-3.
Спољашње везе[уреди | уреди извор]
- WebElements.com – Strontium
- Strontium at The Periodic Table of Videos (University of Nottingham)
- „The Effects of Strontium Citrate on Osteoblast Proliferation and Differentiation”. Архивирано из оригинала 6. 10. 2008. г. Приступљено 21. 1. 2014.









![{\displaystyle \mathrm {^{90}_{35}Br\ {\xrightarrow[{{1,91}\ {\ s}}]{\beta ^{-}}}\ _{36}^{90}Kr\ {\xrightarrow[{{32,32}\ {\ s}}]{\beta ^{-}}}\ _{37}^{90}Rb\ {\xrightarrow[{{158}\ {\ s}}]{\beta ^{-}}}\ _{38}^{90}Sr\ {\xrightarrow[{{28,78}\ {\ a}}]{\beta ^{-}}}\ _{39}^{90}Y\ {\xrightarrow[{{64,0}\ {\ h}}]{\beta ^{-}}}\ _{40}^{90}Zr} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/19f9b7b23a0458ceaaba9f31db69cbb831bf119a)

