Litijum
 pluta u ulju | |||||||||||||||||
| Opšta svojstva | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ime, simbol | litijum, Li | ||||||||||||||||
| Izgled | srebrnobel | ||||||||||||||||
| Zastupljenost | 0,006[1][2] | ||||||||||||||||
| U periodnom sistemu | |||||||||||||||||
| |||||||||||||||||
| Atomski broj (Z) | 3 | ||||||||||||||||
| Grupa, perioda | grupa 1 (alkalni metali), perioda 2 | ||||||||||||||||
| Blok | s-blok | ||||||||||||||||
| Kategorija | alkalni metal | ||||||||||||||||
| Rel. at. masa (Ar) | [6,938, 6,997] konvencionalna: 6,94 | ||||||||||||||||
| El. konfiguracija | [He] 2s1[3] | ||||||||||||||||
po ljuskama | 2, 1 | ||||||||||||||||
| Fizička svojstva | |||||||||||||||||
| Agregatno stanje | čvrsto | ||||||||||||||||
| Tačka topljenja | 453,65 K (180,50 °C, 356,90 °F) | ||||||||||||||||
| Tačka ključanja | 1603[4] K (1330 °C, 2426 °F) | ||||||||||||||||
| Gustina pri s.t. | 0,534[5][6] g/cm3 | ||||||||||||||||
| tečno st., na t.t. | 0,512[2] g/cm3 | ||||||||||||||||
| Kritična tačka | 3220 K, 67 MPa (ekstrapolirano)[7] | ||||||||||||||||
| Toplota fuzije | 3,00 kJ/mol | ||||||||||||||||
| Toplota isparavanja | 136 kJ/mol | ||||||||||||||||
| Mol. topl. kapacitet | 24,860 J/(mol·K) | ||||||||||||||||
Napon pare
| |||||||||||||||||
| Atomska svojstva | |||||||||||||||||
| Oksidaciona stanja | +1 (veoma kiseo oksid) | ||||||||||||||||
| Elektronegativnost | 0,98 | ||||||||||||||||
| Energije jonizacije | 1: 520,2 kJ/mol 2: 7298,1 kJ/mol 3: 11815,0 kJ/mol | ||||||||||||||||
| Atomski radijus | 152 pm | ||||||||||||||||
| Kovalentni radijus | 128±7 pm | ||||||||||||||||
| Valsov radijus | 182 pm | ||||||||||||||||
| Ostalo | |||||||||||||||||
| Kristalna struktura | unutrašnjecentr. kubična (BCC) | ||||||||||||||||
| Brzina zvuka tanak štap | 6000 m/s (na 20 °C) | ||||||||||||||||
| Topl. širenje | 46 µm/(m·K) (na 25 °C) | ||||||||||||||||
| Topl. vodljivost | 84,8 W/(m·K) | ||||||||||||||||
| Električna otpornost | 92,8 nΩ·m (na 20 °C) | ||||||||||||||||
| Magnetni raspored | paramagnetičan (= 1,4 · 10−5)[8] | ||||||||||||||||
| Magnetna susceptibilnost (χmol) | +14,2·10−6 cm3/mol (298 K)[9] | ||||||||||||||||
| Jangov modul | 4,9 GPa | ||||||||||||||||
| Modul smicanja | 4,2 GPa | ||||||||||||||||
| Modul stišljivosti | 11 GPa | ||||||||||||||||
| Mosova tvrdoća | 0,6 | ||||||||||||||||
| Brinelova tvrdoća | 5 MPa | ||||||||||||||||
| CAS broj | 7439-93-2 | ||||||||||||||||
| Istorija | |||||||||||||||||
| Otkriće | Johan Avgust Arfvedson (1817) | ||||||||||||||||
| Prva izolacija | Vilijam Tomas Brand (1821) | ||||||||||||||||
| Glavni izotopi | |||||||||||||||||
| |||||||||||||||||
| 6Li sadržaj može biti nizak i do 3,75% u prirodnim uzorcima. 7Li stoga može da ima sadržaj do 96,25%. | |||||||||||||||||
Litijum (grč. lithos — kamen), oznaka Li, je najlakši od svih poznatih metala. Ima redni broj 3 u periodnom sistemu elemenata, atomsku težinu 6,94, specifičnu težinu 0,534 (pri 20 °C). Predstavlja smešu dva izotopa 7Li(92,6%) i 6Li(7,4%).[10] On je alkalni metal u drugoj periodi periodnom sistemu elemenata. Litijum je vrlo lak metal i ima najmanju gustinu među svim čvrstim elementima (u standardnim uslovima).
Zbog svoje velike reaktivnosti, u prirodi se ne nalazi u elementarnom stanju. Na sobnoj temperaturi, samo na potpuno suvom vazduhu je postojan duže vreme, ali vrlo sporo reaguje dajući litijum nitrid. U vlažnom vazduhu, na površini litijuma vrlo brzo se formira mat sivi sloj litijum hidroksida. Kao i svi alkalni metali, elementarni litijum reaguje odmah već pri dodiru sa vlagom na koži te tako može prouzrokovati teške opekotine i ozlede zbog nagrizanja. Mnoga jedinjenja litijuma, koja u vodenim rastvorima daju jone litijuma smatraju se opasnim za zdravlje, za razliku od analognih jedinjenja natrijuma i kalijuma.
Kao mikroelement, litijum u obliku svojih soli je često sastavni deo mineralnih voda. U ljudskom organizmu nalaze se vrlo male količine ovog elementa. Ne smatra se neophodnim za život i nema poznate biološke funkcije u organizmu. Međutim, neke soli litijuma pokazuju medicinsko delovanje i upotrebljavaju se u litijumskoj terapiji pri lečenju bipolarnih poremećaja, manija, depresija i drugih sličnih bolesti.
Istorija[uredi | uredi izvor]

Švedski naučnik Johan Arfvedson je otkrio litijum 1817. godine. On je 1817. primetio prisustvo nekog nepoznatog elementa u mineralu petalitu (Li[4]Al[4][Si4O10]), a nedugo kasnije i u mineralima spodumenu (LiAl[Si2O6]) i lepidolitu (K(Li,Al)3[(Al,Si)4O10](F,OH)2), nakon analize mineralnih uzoraka sa ostrva Ute u Švedskoj. Njegov akademski učitelj Jakob Bercelijus predložio je naziv lithion, izvedenicu iz grčkog λίθος líthos‚ kamen, ime koje je izvedeno iz materijala iz kojeg je izolovan, slično kao i kod drugih, do tada poznatih, alkalnih metala natrijuma i kalijuma, a kasnije se to ime ustalilo u svojoj latiniziranoj formi lithium.[11] Nemački hemičar Kristian Gotlob Gmelin primetio je 1818. godine da soli litijuma boje plamen u crvenu boju. Oba naučnika su narednih godina pokušavali da dobiju ovaj element u čistom stanju. Ovo je uspelo iste godine Brandu i Dejviju pomoću postupka elektrolize litijum oksida (Li2O). Robert Bunzen i Ogastus Matiesen uspeli su 1855. pomoću elektrolize litijum hlorida (LiCl) da dobiju još veće količine elementarnog litijuma. Atomsku težinu mu je odredio Ričards pretvaranjem litijum-hlorida u litijum perhlorat.[12]
Prva komercijalna proizvodnja počela je 1923. u nemačkoj kompaniji Metallgesellschaft (danas Chemetall GmbH), gde se dobijao pomoću elektrolize istopljene smese litijum- (LiCl) i kalijum hlorida (KCl). Vilhelm Šlenk je 1917. sintetisao prvo litijumorgansko jedinjenje iz organskih jedinjenja žive.[13] Sve do kraja Drugog svetskog rata, osim upotrebe kao sredstvo za podmazivanje (mineralno ulje sa dodatkom litijum stearata) i u industriji stakla (litijum karbonat ili litijum oksid), gotovo da i nisu postojale aplikacije u kojima se koristio litijum. Međutim, to se promenilo nakon što je SAD-u zatrebao tricijum za pravljenje hidrogenske bombe, a koji se može dobiti iz litijuma. Počela je znatna proizvodnja litijuma, a jedno od najizdašnijih nalazišta bio je rudnik u blizini grada Kings Mauntin u Severnoj Karolini.[14] Pošto tricijum ima vrlo kratko vreme poluraspada, neophodne količine litijuma su konstantno rasle, pa su u SAD u periodu od 1953. do 1963. nagomilane ogromne zalihe ovog metala, koje su tek nakon završetka Hladnog rata 1993. dospele na svetsko tržište.[14]
Osim klasičnih rudarskih izvora, jeftinije dobijanje litijuma je moguće i iz slanih voda. Danas se litijum koristi u velikim količinama za razne svrhe kao što je proizvodnja baterija, za polimerizaciju elastomera, u građevinarstvu, te za organske sinteze u farmaciji i argohemijskoj industriji. Od 2007. najvažniji segment upotrebe litijuma su primarne (takozvane „litijumske”) baterije i akumulatori (sekundarne ili litijum-jonske baterije).[15]
Nalaženje u prirodi[uredi | uredi izvor]
Zastupljen je u zemljinoj kori u količini od 0,0018%, ali je i pored male procentualne zastupljenosti veoma čest. Za razliku od ostalih alkalnih metala, litijum se u prirodi nalazi u obliku silikata. Minerali koji ga sadrže su lepidolit, spodumen, ambligonit i petalit, od kojih neki i služe kao polazna sirovina za njegovo dobijanje. Najveća ležišta rude litijuma su u Boliviji, Čileu, Argentini, Kini i Australiji.[16] Pronađen je i u pepelu mnogih biljaka kao što je duvan, ali i u mleku i krvi.[12]
Dobijanje[uredi | uredi izvor]
Dobija se ekstrakcijom iz minerala na razne načine, ali se svi oni zasnivaju ili na slabijoj rastvorljivosti litijum-karbonata, a u odnosu na karbonate drugih alkalnih metala ili na rastvorljivosti litijum hlorida u alkoholu. Takođe, litijum se može dobiti elektrolizom stopljenog litijum hlorida.[12] Iz slanih rastvora koji sadrže litijum, može se istaložiti litijum-karbonat razblaživanjem vodom i dodavanjem natrijum karbonata (sode). Zatim se uparava slana voda u vazduhu sve dok udeo litijuma ne pređe 0,5%. Dodavanjem natrijum karbonata iz nje se počinje taložiti teško rastvorljivi litijum karbonat:
- .
Ne računajući proizvodnju u SAD, tokom 2008. godine u svetu je proizvedeno oko 27.400 tona litijuma,[17] a uglavnom se na tržištu prodavao u obliku litijum karbonata (Li2CO3). Od ove količine 12.000 tona otpada na čileansku Salar de Atakama, a gotovo 7.000 tona na australijski rudnik Grinbušes.
Da bi se dobio metalni litijum, prvo se litijum karbonatu dodaje hlorovodonična kiselina. Pri tome nastaje ugljen-dioksid koji se izdvaja kao gas, te preostaje rastvoreni litijum hlorid. Ovaj rastvor se stavlja u vakuumski isparivač gde se uparava, sve dok se hlorid ne iskristalizuje:
Uređaji i oprema koja se koristi za dobijanje litijum-hlorida moraju biti načinjeni iz posebnih vrsta čelika ili legura nikla, jer slani rastvor deluje izuzetno korozivno. Metalni litijum se dobija elektrolizom topivim elektrodama pri temperaturi od 352 °C iz istopljene eutektične smese iz 52 masena postotka litijum hlorida i 48 masena postotka kalijum hlorida:
odnosno:
- .
Međutim, u procesu elektrolize, kalijum se ne izdvaja, jer u istopljenom hloridu on ima niži elektrodni potencijal. Za razliku od njega, tragovi natrijuma se izdvajaju, te čine litijum izuzetno reaktivnim (što je prednost u organskoj hemiji, ali ne i za Li-baterije). Tečni litijum se skuplja na površini elektrolita, te se relatno lako može izdvojiti iz elektrolitičke ćelije. Litijum je takođe moguće dobiti i elektrolizom litijum-hlorida u piridinu. Ova metoda je posebno pogodna za laboratorijsko dobijanje manjih količina litijuma.
Svojstva[uredi | uredi izvor]
Fizičke[uredi | uredi izvor]
U čistom stanju i u odsustvu vazduha, ima srebrnastometalni sjaj, po čemu liči na natrijum i kalijum, ali od njih je tvrđi. Takođe, ima i višu tačku topljenja, koja iznosi 186 °C, a ključa na oko 1.336 °C. Gustina iznosi svega 0,534 g/cm3[19] i predstavlja najmanju gustinu od svih čvrstih elemenata.[12] Samo vodonik u čvrstom stanju pri temperaturi od −260 °C ima manju gustinu od 0,0763 g/cm3.[19] Prilično je isparljiv i njegova para boji plamen Bunzenove grejalice karmin crveno, što se koristi prilikom kvalitativne analize njegovih soli.[20] Ima najveću specifičnu toplotu od svih elemenata i ona iznosi 0,96 na 50 °C. Litijum među ostalim alkalnim metalima ima najviše tačke topljenja i ključanja kao i najveći specifični toplotni kapacitet. Iako on ima najveću tvrdoću od svih alkalnih metala, može se rezati nožem a njegova Mosova tvrdoća iznosi 0,6.[6][21] Kao tipičan metal, dobar je provodnik struje (provodljivost oko 18% od provodljivosti bakra[1]) kao i toplote.
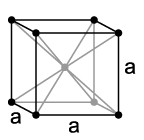
Poput drugih alkalnih metala, i litijum se kristalizuje u kubnom, prostorno centriranom, gusto pakovanom kristalnom sistemu u prostornoj grupi Im3m sa parametrom rešetke a = 351 pm i dve formulske jedinice po elementarnoj ćeliji. Na izuzetno niskim temperaturama od 78 K menja se kristalna struktura spontanim prelazom bilo u heksagonalnu strukturu tipa magnezijuma sa parametrima rešetke a = 311 pm i c = 509 pm ili izmenom u izobličenu kubnu strukturu tipa bakra (kubna površinsko centrirana) sa parametrom rešetke a = 438 pm. Tačan uzrok zbog čega se javlja jedna od ovih struktura nije poznat.[18]
Litijum ispoljava veliki broj sličnosti sa magnezijumom, što se, između ostalog, iskazuje i u činjenici javljanja heterotipskih mešanih kristala od litijuma i magnezijuma, a koji imaju osobinu izodimorfije. Iako se magnezijum najgušće kristalizuje heksagonalno, dok se nasuprot njega litijum kristalizuje u kubinu prostorno centriranu kuglastu rešetku, oba metala se mogu heterotipski mešati.[22] Međutim, ovo se dešava samo u vrlo ograničenom rasponu koncentracija, pri čemu kod viška neke od komponenti, jedna od njih nameće (prisiljava da promeni) kristalnu rešetku drugoj.
Jon litijuma sa −520 kJ/mol[23] ima najvišu entalpiju hidratacije među svim jonima alkalnih metala. Stoga se on u vodi u potpunosti hidratizuje i snažno privlači molekule vode. Jon litijuma gradi dve hidratne ljuske, jednu unutrašnju sa četiri molekula vode, koja je izuzetno snažno povezana sa litijumovim jonom preko svojih atoma kiseonika, te jednu spoljnu ljusku, koja je povezana sa jonom Li[H2O]4+ preko „vodoničnih mostova” sa drugim molekulima vode. Zbog toga je jonski radijus hidratizovanih jona litijuma veoma velik, veći čak i od nekih jona teških alkalnih metala kao što su rubidijum i cezijum, koji u vodenim rastvorima ne grade takvu vrstu snažno vezanih hidratnih ljuski.

U gasovitom stanju, litijum se ne nalazi u vidu pojedinačnih atoma, već u molekularnom stanju kao dilitijum Li2. Na taj način jednovalentni litijum dostiže popunjenu s-atomsku orbitalu a time i energetski povoljniju situaciju. Dilitijum ima dužinu veze od 267,3 pm i energiju veze od 101 kJ/mol.[24]
Hemijske[uredi | uredi izvor]

Litijum je, kao i svi drugi alkalni metali, vrlo reaktivan i vrlo lako reaguje sa mnogim elementima i jedinjenjima (poput vode dajući toplotu). Među svim alkalnim metalima, on je najviše reaktivan. Posebnost, po kojoj se litijum razlikuje od drugih alkalnih metala je njegova reakcija sa molekularnim azotom gradeći litijum nitrid, reakcija koja se polako odvija već i na sobnoj temperaturi:
- .
Ovo je moguće zbog velike gustine naboja jona litijuma Li+ te tako i velike energije rešetke litijum nitrida. Litijum sa -3,04 V[23] ima najniži elektrodni potencijal u celom periodnom sistemu, te je stoga i najmanje plemeniti element od svih. Kao i svi alkalni metali, elementarni litijum se može čuvati u kerozinu (petroleumu) ili parafinskom ulju, jer u suprotnom reaguje sa azotom i kiseonikom iz vazduha.
Pošto su radijusi jona litijuma Li+ i magnezijuma Mg2+ slični po veličini, takođe postoje i određene sličnosti u osobinama litijuma odnosno njegovih jedinjenja sa magnezijumom ili jedinjenjima magnezijuma. Ova sličnost u osobinama između dva elementa iz susednih grupa periodnog sistema poznata je i kao dijagonalna veza (dijagonalni efekt). Tako litijum, za razliku od natrijuma, gradi mnoga metalnoorganska jedinjenja (organolitijumska jedinjenja), poput butil litijuma ili metil litijuma. Ista sličnost uočena je i između berilijuma i aluminijuma, kao i između bora i silicijuma.
Na vazduhu gori blještavom belom svetlošću poput magnezijuma, gradeći monoksid, ali druge okside gradi teže. Sa vodonikom se jedini na crvenom usijanju gradeći litijum hidrid, a sa azotom litijum nitrid. Direktno se jedini i sa halogenima i sumporom i može se reći da je hemijski aktivan, ali manje od drugih alkalnih metala. Burno reaguje sa kiselinama, a u reakciji sa vodom se ne pali, čak ni ako voda ključa. Tada nastaje reakcija:[12]
Izotopi[uredi | uredi izvor]
U prirodi se javljaju oba stabilna izotopa litijuma 6Li (7,6%) i 7Li (92,4%). Osim njih, poznato je još nekoliko nestabilnih izotopa počev od 4Li preko 8Li do 12Li, koji se mogu dobiti samo veštačkim putem. Njihova vremena poluraspada iznose samo nekoliko milisekundi.[25]

Izotop 6Li ima vrlo važnu ulogu u tehnologiji nuklearne fuzije. Pored uloge u nuklearnim fuzijskim reaktorima, služi i kao polazni materijal za dobijanje tricijuma u hidrogenskoj bombi, koji je neophodan za fuziju sa deuterijumom kojom se proizvodi enormna količina energije. Tricijum nastaje u plaštu fuzijskog reaktora (takozvanom blanketu) ili unutar hidrogenske bombe pored helijuma bombardiranjem litijuma 6Li neutronima, koji nastaju tokom fuzije, a prema sledećoj nuklearnoj reakciji:
- .
Takođe, moguća je i reakcija
ali je ona manje pogodna.
Iz ovog razloga, izotop 6Li se izdvaja pri proizvodnji litijuma.[26] Razdvajanje izotopa se može vršiti na primjer putem razmene izotopa litijum amalgama i nekog rastvorenog litijumovog jedinjenja (poput litijum hlorida u etanolu). Pri tome se može dostići prinos od oko 50%.[27]
Izotop 7Li nastaje u neznatnim količinama u nuklearnim centralama putem nuklearne reakcije izotopa bora 10B (korišten kao usporivač neutrona) sa neutronima.[28]
Oba izotopa litijuma 6Li i 7Li korištena su u eksperimentima sa ultrahladnim kvantnim gasovima. Tako je načinjen i prvi Boze-Ajnštajnov kondenzat sa (bozon) izotopom 7Li.[29] Međutim 6Li je fermion[30][31] te su naučnici 2003. godine uspeli da molekul ovog izotopa pretvore u superfluid.[32]
Upotreba[uredi | uredi izvor]

Najveći deo proizvedenih soli litijuma se ne redukuje do metalnog litijuma, već se koristi bilo direktno kao litijum karbonat, litijum hidroksid, litijum hlorid, litijum bromid ili se prevodi u neki drugo jedinjenje litijuma. Kao metal, on je neophodan u određenom broju aplikacija, među kojima je najviše u industriji baterija i industriji stakla i keramike.
Kao metal[uredi | uredi izvor]
Deo proizvedenog metalnog litijuma koristi se za dobijanje njegovih jedinjenja, koja se ne mogu direktno dobiti iz litijum karbonata. To su, u prvom redu, organolitijumska jedinjenja poput butil litijuma, jedinjenja litijuma i vodonika kao litijum hidrida (LiH) ili litijum aluminijum hidrida kao i litijum amida. Zbog sposobnosti litijuma da reaguje direktno sa azotom, koristi se i za uklanjanje tog gasa tamo gde je to neophodno.
Metalni litijum je izuzetno snažno redukciono sredstvo. On redukuje mnoge materijale, koji inače ne reaguju sa drugim redukcionim sredstvima. Upotrebljava se i za delimično hidriranje aromatičnih jedinjenja (Birčova redukcija). U metalurgiji, koristi se za odstranjivanje sumpora iz istopljenog željeza, dezoksidaciju i uklanjanje ugljenika iz istopljenih metala.
Pošto litijum ima veoma nizak elektrodni potencijal, može se upotrebljavati u baterijama kao anoda. Takve litijumske baterije imaju vrlo veliku gustinu energije, a mogu proizvesti posebno visok električni napon. Treba razlikovati litijumske baterije koje se ne mogu ponovno puniti sa punjivim litijum-jonskim baterijama (akumulatorima), kod kojih se kao katoda koristi metalni oksid litijuma kao na primjer litijum kobalt oksid, a na strani anode koristi se grafit ili neko jedinjenje na kojem se interkaliraju joni litijuma.[33]
Sastojak legura[uredi | uredi izvor]
Litijum se ponekad dodaje drugim metalima pri njihovom legiranju, radi poboljšanja njihovih osobina. Često za te svrhe dovoljne i vrlo male količine litijuma. Mnogim supstancama dodavanje litijuma poboljšava otpornost na izvlačenje, tvrdoću i mehaničku elastičnost. Jedan od primera legura sa litijumom je takozvani Bahnmetall (nem. željeznički metal), legura olova sa oko 0,04% litijuma, koja se koristi u Nemačkoj kao materijal za izradu valjkastih ležaja na željeznicama. Takođe i u magnezijumskim i aluminijumskim legurama, litijum se dodaje za poboljšanje mehaničkih osobina. Istovremeno, legure litijuma su vrlo lake i stoga se često koriste i u avionskoj i svemirskoj tehnici.
Istraživanje (atomska fizika)[uredi | uredi izvor]
U oblasti atomske fizike, litijum se vrlo često upotrebljava, jer je kao 6Li jedini među alkalnim metalima sa stabilnim fermionskim izotopom, zbog čega je pogodan za istraživanje efekata u ultrahladnim fermionskim kvantnim gasovima. Istovremeno, iskazuje veoma široku Fešbačovu rezonancu, koja omogućava da se dužina raspršenja između atoma podešava po želji, pri čemu se ne mora posebno precizno održavati magnetno polje zbog širine rezonance.
Medicina[uredi | uredi izvor]
Već od 1850. litijum se počeo koristiti u medicini zapadnoevropskih zemalja kao sredstvo protiv gihta. Međutim, nije se pokazao delotvoran. I drugi vidovi upotrebe litijumskih soli u medicini su takođe ostali bezuspešni, između ostalih i kao sredstvo protiv infektivnih bolesti.
Tek 1949. australijski fizijatar Džon Kejd opisao je moguću oblast upotrebe litijumovih soli. On je zamorcima ubrizgavao različita hemijska jedinjenja, između ostalih i soli litijuma, od čega su oni mnogo slabije reagovali na spoljne nadražaje, te su bili mnogo mirniji ali ne i pospani.[34] Tek nakon što je isto isprobao i na sebi između 1952. i 1954. Kejd je podržao upotrebu litijum karbonata kao leka u terapiji depresivnih, šizofrenih i maničnih pacijenata, a nakon sprovedene opsežne studije na psihijatrijskoj bolnici u Riskovu (Danska).[35] Time su postavljeni budući temelji današnje terapije litijumom.
Nalazišta litijuma u Srbiji[uredi | uredi izvor]
Ovaj odeljak bi trebalo proširiti. Možete pomoći dodavanjem sadržaja. |
Reference[uredi | uredi izvor]
- ^ a b dtv-Atlas Chemie. 1 (9 izd.). dtv. 2000. ISBN 9783423032179.
- ^ a b Binder, Harry H. der chemischen Elemente (1999). Lexikon. Stuttgart: S. Hirzel Verlag. ISBN 978-3-7776-0736-8.
- ^ Wieser, Michael E.; Coplen, Tyler B. (2010). „Atomic weights of the elements 2009 (IUPAC Technical Report)”. Pure and Applied Chemistry. 83 (2): 359—396. S2CID 95898322. doi:10.1351/PAC-REP-10-09-14.
- ^ Zhang, Yiming; Julian R. G. Evans; Yang, Shoufeng (2011). „Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks” (PDF). Journal of Chemical & Engineering Data. 56 (2): 328—337. doi:10.1021/je1011086.
- ^ Greenwood, N. N.; Earnshaw, A. (1988). Chemie der Elemente (1 izd.). Weinheim: VCH. str. 97. ISBN 978-3-527-26169-7.
- ^ a b "„Lithium”. The Gale Encyclopedia of Science. Gale. 2008. ISBN 978-1578516803. Pristupljeno 5. 9. 2014.[mrtva veza]
- ^ Bergmann, Ludwig; Schaefer, Clemens; Kassing, Rainer (2005). Lehrbuch der Experimentalphysik, Band 6: Festkörper (2 izd.). Walter de Gruyter. str. 361. ISBN 978-3-11-017485-4.
- ^ Robert C. Weast, ur. (1990). CRC Handbook of Chemistry and Physics. Boca Raton: CRC (Chemical Rubber Publishing Company). str. E—129 do E—145. ISBN 978-0-8493-0470-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. str. E110. ISBN 978-0-8493-0464-4.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Figurowski, N. (1981). Die Entdeckung der chemischen Elemente und der Ursprung ihrer Namen. Köln: Aulis-Verlag Deubner. str. 135. ISBN 978-3-7614-0561-1.
- ^ a b v g d Parkes, G. D. & Fil, D. 1973. Melorova moderna neorganska hemija. Naučna knjiga. Beograd.
- ^ Elschenbroich, C. (2009). Organometallchemie (6 izd.). Leipzig: Teubner B.G. Gmbh. str. 16. ISBN 9783835192232.
- ^ a b Kogel, Jessica Elzea (2006). Industrial minerals & rocks: commodities, markets, and uses (7 izd.). SME. str. 599. ISBN 978-0-87335-233-8.
- ^ United States Geological Survey: Minerals Yearbook 2007: Lithium. (PDF), 2007.
- ^ Dodaci; Po definicijama USGS, bazne rezerve obuhvataju one dijelove resursa koji imaju dovoljan potencijal da postanu ekonomski dostupne u okviru planiranih nivoa a izvan onih koji pretpostavljaju dokazane tehnologije i trenutne ekonomije. Bazna rezerva uključuje one resurse koji su trenutno ekonomični (rezerve), granično ekonomični (granične rezerve) i neke od onih koji su trenutno neekonomični (subekonomski resursi).
- ^ Lithium na USGS Mineral Resources, 2009 (PDF).
- ^ a b Schubert, K. (1974). „Ein Modell für die Kristallstrukturen der chemischen Elemente”. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 30: 193—204. doi:10.1107/S0567740874002469..
- ^ a b Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). Lehrbuch der Anorganischen Chemie (91–100 izd.). Berlin: de Gruyter. str. 928—931. ISBN 978-3-11-007511-3.
- ^ Rondović, D. 1991. Kvalitativna hemijska analiza. Naučna knjiga: Beograd.
- ^ Litijum na stranici webelements.com, fizičke osobine.
- ^ Malissa, H. (1959). „Die Trennung des Lithiums vom Magnesium in Lithium-Magnesium-Legierungen”. Fresenius' Zeitschrift für Analytische Chemie. 171 (4): 281—282. S2CID 94700911. doi:10.1007/BF00555410..
- ^ a b Binnewies, M. (2004). Allgemeine und Anorganische Chemie (1 izd.). Spektrum Verlag. str. 241. ISBN 978-3827402080.
- ^ Winter, Mark J. Bonding (1994). Chemical. Oxford University Press. ISBN 978-0-19-855694-7.
- ^ The Nubase evaluation of nuclear and decay properties Arhivirano na sajtu Wayback Machine (24. јул 2013) (PDF, engl.).
- ^ ABC oružje.
- ^ Bauer, Richard (1985). „Lithium – wie es nicht im Lexikon steht”. Chemie in unserer Zeit. 19 (5): 167—173. doi:10.1002/ciuz.19850190505.
- ^ Volkmer, Martin (2007). Kernenergie Basiswissen (PDF). Inforum. стр. 39. ISBN 978-3-926956-44-6. Архивирано из оригинала (PDF) 17. 6. 2012. г. Приступљено 1. 4. 2019.
- ^ Bradley, C. C.; Sackett, C. A.; Tollett, J. J.; Hulet, R. G. (1995). „Evidence of Bose-Einstein Condensation in an Atomic Gas with Attractive Interactions”. Physical Review Letters. 75 (9): 1687—1690. PMID 10060366. doi:10.1103/PhysRevLett.75.1687. hdl:1911/79442. (PDF[мртва веза]).
- ^ Fermionic Studies in 6Lithium
- ^ Ling, A. V. (2006). Focus on Boson Research. Nova Publishers. стр. 184. ISBN 9781594545207.
- ^ Jochim, S.; Bartenstein, M.; Altmeyer, A.; Hendl, G.; Riedl, S.; Chin, C.; Hecker Denschlag, J.; Grimm, R. (2003). „Bose-Einstein Condensation of Molecules”. Science. 302 (5653): 2101—2103. PMID 14615548. S2CID 13041446. doi:10.1126/science.1093280.
- ^ O litijskim baterijama Архивирано на сајту Wayback Machine (24. januar 2009) na stranici TU Graz (PDF).
- ^ Cade, J. (1949). „Lithium salts in the treatment of psychotic excitement”. Med. J. Australia. 36 (10): 349—352. PMC 2560740
 . PMID 18142718. doi:10.1080/j.1440-1614.1999.06241.x.
. PMID 18142718. doi:10.1080/j.1440-1614.1999.06241.x.
- ^ Schou, M. (2001). Lithiumbehandlung der manisch-depressiven Krankheit. Thieme. ISBN 978-3-13-593304-7.
Spoljašnje veze[uredi | uredi izvor]
- Lithium at The Periodic Table of Videos (University of Nottingham)
- International Lithium Alliance
- USGS: Lithium Statistics and Information
- Lithium Supply & Markets 2009 IM Conference 2009 Sustainable lithium supplies through 2020 in the face of sustainable market growth
- University of Southampton, Mountbatten Centre for International Studies, Nuclear History Working Paper No5.






![{\displaystyle \mathrm {Li^{+}+\mathrm {e} ^{-}\ {\xrightarrow[{elektroliza}]{352\,^{\circ }C}}\ Li} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9c4f392667eae5fea5bd062050b0b8883488c53c)
![{\displaystyle \mathrm {KCl+LiCl\ {\xrightarrow[{elektroliza}]{352\,^{\circ }C}}\ K+Li+Cl_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cacbb963ddc07c91454983764f2376c1e594a01e)




