Metabolizam
| Биохемија |
|---|
 |
| Кључне компоненте |
| Историја и теме |
| Портали: Биологија, Хемија, MCB |
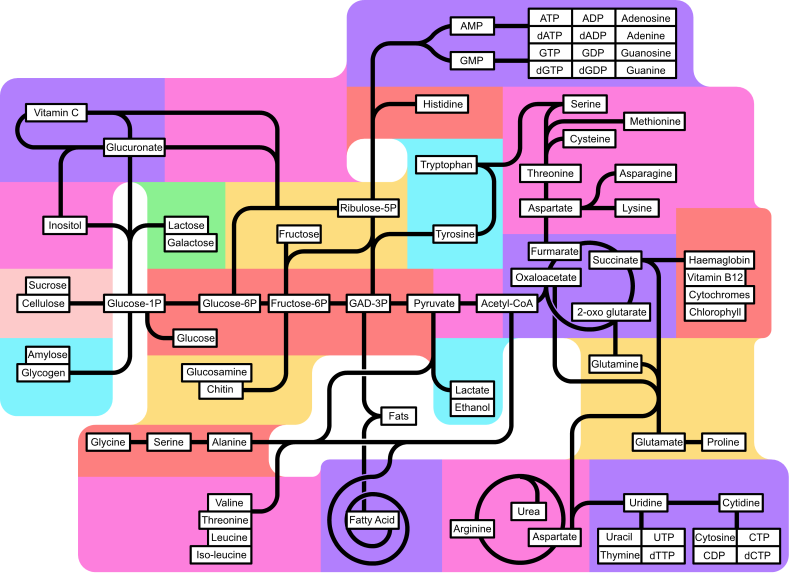
Metabolizam (grč. μεταβολήσμός što znači promena) je biohemijski proces u kome dolazi do modifikacije hemijskih jedinjenja u živim organizmima i ćelijama. Metabolizam se deli na anabolizam odnosno biosintezu (stvaranje) kompleksnih organskih molekula i na katabolizam koji je obrnuti proces od anabolizma, a to je razdvajanje kompleksnih organskih jedinjenja u jednostavnija jedinjenja. Sveukupni biohemijski procesi u jednom organizmu se rečju nazivaju metabolizam. Bez metabolizma živi organizmi ne bi mogli da postoje.[1]
Metabolizam je set hemijskih transformacija kojima se održava život u ćelijama. Ove reakcije su katalizovane enzimima. One omogućavaju organizmima da rastu i da se reprodukuju, održe svoje strukture, i da odgovaraju na stimuluse iz okoline. Reč metabolizam se isto tako može odnositi na sve hemijske reakcije koje se odvijaju u živim organizmima, uključujuću varenje i transport supstanci između različitih ćelija, u kom slučaju se set reakcija unutar ćelija naziva intermedijerni metabolizam.
Hemijske reakcije metabolizma su organizovane u metaboličke puteve, u kojima se jedna hemikalija transformiše putem serije koraka u drugu hemikaliju, posredstvom sekvence enzima. Enzimi su od presudnog značaja za metabolizam, zato što oni omogućavaju organizmima odvijanje željenih reakcija sa visokom energijom aktivacije koje se ne bi spontano odvijale. To se obično ostvaruje putem sprezanja tih reakcija sa spontanim reakcijama u kojima se otpušta energija. Enzimi deluju kao katalizatori koji omogućavaju reakcijama da brže teku. Enzimi isto tako omogućavaju regulaciju metaboličkih puteva u odgovoru na promene u ćelijskom okruženju ili na signale iz drugih ćelija.
Metabolički sistem datog organizma određuje koje supstance će biti hranljive, a koje će biti otrovne. Na primer, neke prokariote koriste vodonik sulfid kao nutrijent, dok je taj gas otrovan za životinje.[2] Brzina metabolizma, metabolička stopa, utiče na količinu hrane koja je neophodna organizmu, a isto tako utiče i na način na koji organizam dolazi do hrane.
Upadljiva odlika metabolizma je sličnost osnovnih metaboličkih puteva i njihovih komponenti, čak i između veoma različitih vrsta.[3] Na primer, grupa karboksilnih kiselina koje su najbolje poznate kao intermedijeri ciklusa limunske kiseline je prisutna u svim poznatim organizmima, od jednoćelijske bakterije Escherichia coli do ogromnih višećelijskih organizama, kao što su slonovi.[4] Te upadljive sličnosti metaboličkih puteva su verovatno posledica njihove rane pojave tokom evolucione istorije, i zadržavanja usled njihove efikasnosti.[5][6]
Ključne biohemikalije
[uredi | uredi izvor]
Većina struktura od kojih se sastoje životinje, biljke i mikrobi su napravljene od tri osnovne klase molekula: aminokiselina, ugljenih hidrata i lipida (koji se često nazivaju mastima). Pošto su ti molekuli vitalni za život, metaboličke reakcije su usredsređene bilo na pravljenje tih molekula tokom konstrukcije ćelija i tkiva, ili na njihovo razlaganje, pri čemu se oni koriste kao izvori energije, putem varenja. Te biohemikalije mogu da budu spojene u polimere kao što su DNK i proteini, esencijalni makromolekuli života.
| Tip molekula | Ime monomernih formi | Ime polimernih formi | Primeri polimernih formi |
|---|---|---|---|
| Aminokiseline | Aminokiseline | Proteini (takođe poznati kao polipeptidi) | Fibrozni proteini i globularni proteini |
| Ugljeni hidrati | Monosaharidi | Polisaharidi | Skrob, glikogen i celuloza |
| Nukleinske kiseline | Nukleotidi | Polinukleotidi | DNK i RNK |
Aminokiseline i proteini
[uredi | uredi izvor]Proteini se sastoje od aminokiselina uređenih u linearne lance spojene peptidnim vezama. Mnogi proteini su enzimi koji katalizuju hemijske reakcije metabolizma. Drugi proteini imaju strukturne i mehaničke funkcije, kao što su oni koji formiraju citoskeleton, sistem kojim se održava ćelijski oblik.[7] Proteini su isto tako važni u ćelijskoj signalizaciji, imunskom responsu, ćelijskoj adheziji, aktivnom transportu kroz membrane, i ćelijskom ciklusu.[8] Aminokiseline takođe doprinose ćelijskom energetskom metabolizmu, tako što služe kao izvor ugljenika na ulazu u cilus limunske kiseline (Krebsov ciklus),[9] što je posebno značajno kad su one primarni izvori energije, kao što slučaj kad je glukoza oskudna, ili kad ćelije podležu metaboličkom stresu.[10]
Lipidi
[uredi | uredi izvor]Lipidi su najraznovrsnija grupa biohemikalija. Njihova glavna strukturna ulaga je da su komponenta bioloških membrana, unutrašnjih i spoljašnjih, kao što je ćelijska membrana. Oni su isto tako značajan izvor energije.[8] Lipidi se obično definišu kao hidrofobni ili amfifilni biološki molekuli, mada se rastvaraju u organskim rastvaračima kao što je benzen ili hloroform.[11] Masti su grupa velikih molekula koji se sastoje od masnih kiselina i glicerola; molekul glicerola vezan za tri masne kiseline je estar koji se zove triacilglicerid.[12] Postoji nekoliko varijacija ove osnovne strukture, uključujući alternativne osnove kao što je sfingozin u sfingolipidima, i hidrofilne grupe kao što su fosfati u fosfolipidima. Steroidi, kao što je holesterol, su još jedna važna klasa lipida.[13]
Ugljeni hidrati
[uredi | uredi izvor]
Ugljeni hidrati su aldehidi ili ketoni, sa nekoliko vezanih hidroksilnih grupa, koji mogu da postoje kao otvoreni lanci ili prstenovi. Ugljeni hidrati su najrasprostranjeniji biološki molekuli. Oni vrše brojne uloge, kao što je skladištenje i transport energije (skrob, glikogen) i kao strukturne komponente (celuloza u biljkama, hitin kod životinja).[8] Osnovne ugljeno hidratne jedinice se nazivaju monosaharidima i obuhvataju između ostalih galaktozu, fruktozu, i glukozu. Monosaharidi mogu da budu povezani u polisaharide na skoro neograničen broj načina.[14]
Nukleotidi
[uredi | uredi izvor]Dve nukleinske kiseline, DNK i RNK, su polimeri nukleotida. Svaki nukleotid se sastoji od fosfata vezanog za riboznu ili dezoksiriboznu šećernu grupu, koja je vezana za azotnu bazu. Nukleinske kiseline su kritične za čuvanje i upotrebu genetičke informacije, i njenu interpretaciju putem procesa transkripcije i biosinteze proteina.[8] Ta informacija je zaštićena putem mehanizma za popravku DNK i propagira se putem DNK replikacije. Mnogi virusi imaju RNK genome, na primer HIV. Oni koriste reverznu transkripciju za kreiranje DNK šablona iz svog viralnog RNK genoma.[15] RNK u ribozimima kao što su splajseozomi i ribozomi je slična sa enzimima u smislu da može da katalizuje hemijske reakcije. Individualni nukleotidi su formirani vezivanjem nukleobaze za ribozni šećer. Te baze su heterociklični prstenovi koji sadrže azot. Oni se klasifikuju kao purini ili pirimidini. Nukleotidi isto tako deluju kao koenzimi u reakcijama transfera metaboličkih grupa.[16]
Koenzimi
[uredi | uredi izvor]
Metabolizam obuhvata širok niz hemijskih reakcija. Većina njih se može grupisati u nekoliko osnovnih tipova reakcija koje obuhvataju transfer funkcionalnih grupa atoma i njihovih veza unutar molekula.[17] Ta zajednička hemija omogućava ćelijama da koriste malu grupu metaboličkih intermedijera da prenose hemijske grupe između različitih reakcija.[16] Ti intermedijeri koji prenose grupe se nazivaju koenzimima. Svaka klasa reakcija prenosa grupa se izvodi posredstvom specifičnog koenzima, koji je supstrat za grupu enzima koji ga proizvode, i za grupu enzima koji ga konzumiraju. Ti koenzimi se stoga stalno formiraju, konzumiraju i zatim recikliraju.[18]
Jedan centralni koenzim je adenozin trifosfat (ATP), koji je univerzalna energijska valuta u ćelijama. Taj nukleotid se koristi za transfer hemijske energije između različitih hemijskih reakcija. Postoji relativno mala količina ATP molekula u ćelijama, ali se oni konstantno regenerišu, ljudsko telo može da upotrebi ekvivalent svoje težine ATP molekula na dan.[18] ATP deluje kao most između katabolizma i anabolizma. Katabolizmom se razlažu molekuli, a anabolizmom se formiraju. Kataboličke reakcije generišu ATP, a anaboličke reakcije ga konzumiraju. ATP takođe služi kao prenosnik fosfatne grupe u reakcijama fosforilacije.

Vitamin je organsko jedinjenje koje je neophodno u malim količinama i koje se ne može formirati u ćelijama datog organizma. U ljudskoj ishrani, vitamini većinom funkcionišu kao koenzimi nakon modifikacije; na primer, svi u vodi rastvorni vitamini su fosforilisani ili su spregnuti sa nukleotidima kad se koriste u ćelijama.[19] Nikotinamid adenin dinukleotid NAD+), derivat vitamina B3 (niacina), važan je koenzim koji deluje kao akceptor vodonika. Stotine različitih tipova dehidrogenaza uklanjaju elektrone sa svojih supstrata i redukuju NAD+ do NADH. Tom redukcijom se formira koenzim je zatim supstrat za bilo koju od reduktaza u ćeliji, koje redukuju svoje supstrate.[20] Nikotinamid adenin dinukleotid postoji u dve srodne forme u ćeliji, NADH i NADPH. NAD+/NADH forma je važnija u kataboličkim reakcijama, dok se NADP+/NADPH koristi u anaboličkim reakcijama.
Minerali i kofaktori
[uredi | uredi izvor]Neorganski elementi igraju kritične uloge u metabolizmu; neki su izobilno zastupljeni (npr. natrijum i kalijum), dok drugi funkcionišu u veoma malim koncentracijama. Oko 99% mase sisara se sastoji od elemenata ugljenik, azot, kalcijum, natrijum, hlor, kalijum, vodonik, fosfor, kiseonik i sumpor.[21] Organska jedinjenja (proteini, lipidi i ugljeni hidrati) sadrže najveći deo ugljenika i azota; najveći deo kiseonika i vodonika je prisutan u obliku vode.[21]
Izobilni neorganski elementi deluju kao jonski elektroliti. Najvažniji joni su natrijum, kalijum, kalcijum, magnezijum, hlor, fosfor i organski jon bikarbonat. Održavanjem preciznih jonskih gradijenata kroz ćelijske membrane održava se osmotski pritisak i pH.[22] Joni su takođe kritični za funkciju nerva i mišića, pošto se akcioni potencijali u tim tkivima proizvode razmenom elektrolita između ekstracelularnog fluida i ćelijskog fluida, citozola.[23] Elektroliti ulaze i napuštaju žive ćelije posredstvom proteina u ćelijskoj membrani zvanih jonski kanali. Na primer, kontrakcija mišića je zavisna od kretanja kalcijuma, natrijuma i kalijuma kroz jonske kanale u ćelijskoj membrani i T-tubulama.[24]
Prelazni metali su obično prisutni kao mikroelementi organizmima, pri čemu su cink i gvožđe najzastupljeniji među njima.[25][26] Ti metali se koriste u pojedinim proteinima kao kofaktori i esencijalni su za aktivnost enzima, kao što su katalaze, i proteina koji prenose kiseonik, kao što je hemoglobin.[27] Metalni kofaktori su snažno vezani za specifična mesta u proteinima; mada enzimski kofaktori mogu da budu modifikovani tokom katalize, oni se uvek vraćaju u svoje početno stanje na kraju katalitičke reakcije. Metalni mikronutrijenti se unose u organizme posredstvom specifičnih transportera i vezuju se za skladišne proteine, kao što je feritin ili metalotionein, kad se ne koriste.[28][29]
Metabolički procesi
[uredi | uredi izvor]Metabolički procesi omogućuju organizmu da raste, da se razmnožava, da održava svoju strukturu i reaguje na okolinu. Prema metaboličkim reakcijama, metabolizam se deli u dve kategorije:
- Katabolizam kojim se razgrađuje organska materija (npr. nakupljanje energije ćelijskim disanjem)
- Anabolizam koji koristi energiju za izgradnju ćelijskih delova (biosinteza organske materije) kao što su npr. proteini i nukleinske kiseline.
Hemijske reakcije metabolizma su podeljene u metaboličke puteve u kojima se određeno hemijsko jedinjenje pretvara u neka druga uz pomoć enzima. Enzimi su ključni u metabolizmu zato što omogućuju organizmu da brzo i efikasno izvodi biološki poželjne, ali termodinamički nepovoljne hemijske reakcije, u kojima enzimi deluju kao katalizatori. Enzimi omogućuju i kontrolu metaboličkih puteva, kao odgovor na promene u ćelijskoj okolini ili neki drugi podražaj.
Neki od osnovnih metaboličkih puteva u organizmu čoveka su:
- Metabolizam vode
- Metabolizam aminokiselina, koje se međusobno povezuju peptidnom vezom i oblikuju polipeptide tj. proteine
- Metabolizam ugljenih hidrata
- Metabolizam masti
Metabolizam pojedinog organizma određuje koja će se hemijska jedinjenja koristiti kao hranjive materija, a koja će biti otrovi. Tako na primer, neki prokarioti koriste vodonik sulfid, kao hranljivu materiju, dok je to jedinjenje za većinu životinja otrovno. Iznenađujuća je sličnost osnovnih metaboličkih puteva među velikim brojem vrsta. Tako na primer karboksilna kiselina, međuprodukt u ciklusu limunske kiseline, je prisutna u svim organizmima, od bakterija, kao što je Escherichia coli, pa do velikih višećelijskih organizama, npr. slon.
Bazalni metabolizam je naziv za količinu energije koja je potrebna za održavanje osnovnih životnih funkcija organizma. U razgovorima o dijetama i održavanju linije, stalno se javlja teza da postoje ljudi koji imaju „metabolizam da im se ništa ne zadržava, koliko god da jedu“ i o onima „kojima se goje i kad prođu pored hrane“. Tačno je da individualne razlike postoje, ali postoje i promene koje jedna osoba može sama na različite načine (svesno ili nesvesno) da indukuje u svom telu. Koliko je „brz metabolizam“, odnosno koliko jedan organizam troši u stanju mirovanja u toku dana izražava se BMR brojem, odnosno brojem kalorija koje troši bazalni metabolizam.[30]
Katabolizam
[uredi | uredi izvor]Katabolizam je grupa metaboličkih procesa koji razgrađuju velike složene molekule. Glavna svrha razgradnje složenih molekula je dobijanje manjih molekula koji kasnije služe kao „materijal“ za izgradnju složenih jedinjenja za potrebe organizma (anaboličke reakcije), kao i dobijanje energije. Kataboličke reakcije se razlikuju od organizma do organizma, pa se prema načinu na koji organizmi dobivaju energiju i ugljenik mogu i podeliti. Organizmi koji koriste organske molekule kao izvor energije nazivaju se organotrofni organizmi, dok litotrofni organizmi koriste neorganska jedinjenja, a fototrofni organizmi sunčevu svetlost koriste kao potencijalni izvor hemijske energije.
- Celularna respiracija je proces stvaranje energije (ATP i NADPH). Ovaj proces je takođe aktivan i pri varenju hrane.
- Katabolizam ugljenih hidrata
- Glikogenoliza proces razgradnje glikogena do glukoze
- Glikoliza proces razgradnje glukoze do piruvata uz produkciju ATP, pri čemu kiseonik nije potreban
- Embden-Mejerhofov metabolizam, najčešći metabolizam u procesu glikolize
- Entner-Doudorofov metabolizam sporedni proces glikolize koji se javlja kod nekih bakterija
- Metabolizam fosfatne pentoze je proces u kome se sintetiše NADPH iz glukoze
- Katabolizam proteina je proces u kome se proteini hidrolizom pretvaraju u amino kiseline
- Katabolizam ugljenih hidrata
- Aerobna respiracija
- Anaerobna respiracija
Svi ovi različiti oblici metabolizma zavise od redoks reakcija koje obuhvataju prenos elektrona s redukovanog molekula donora (npr. organski molekuli, voda, amonijak, vodonik sulfid, ili jon gvožđa), na molekul akceptora elektrona (npr. kiseonik, nitrat ili sulfat).[31] Kod životinja, ove reakcije obuhvataju kompleksne organske molekule, koji se razlažu do jednostavnijih molekula, kao što su ugljen-dioksid i voda. Kod fotosintetičkih organizama, kao što su biljke i modrozelene bakterije, ove reakcije elektronskog transfera ne oslobađaju energiju, nego se koriste kao način skladištenja energije apsorbovane iz sunčevog svetla.[32]
| ||||||||||||||||||||||
Najčešći skup kataboličkih reakcija kod životinja može se razdvojiti u tri glavne faze. U prvoj fazi se veliki molekuli, kao što su proteini, polisaharidi ili lipidi, vare do manjih komponenti izvan ćelija. Zatim te manje molekule preuzimaju ćelije i konvertuju ih do malih molekula, obično acetil koenzima A (acetil-KoA), čime se oslobaća deo energije. Na kraju se acetil grupa na KoA oksiduje do vode i ugljen-dioksida u ciklusu limunske kiseline i lancu elektronskog transporta, čime se oslobađa uskladištena energija putem redukcije koenzima nikotinamid adenin dinukleotida (NAD+) do NADH.
Varenje
[uredi | uredi izvor]Makromolekule, kao što su skrob, celuloza ili proteini, ćelije ne mogu brzo da preuzmu i oni moraju da budu razloženi u manje jedinice pre nego što se mogu koristiti u helijskom metabolizmu. Nekoliko ustaljenih klasa enzima vari ove polimere. Ovi digestivni enzimi obuhvataju proteaze, koje vare proteine do aminokiselina, kao i glikozidne hidrolaze koje vare polisaharide do jednostavnih šećera poznatih kao monosaharidi.
Mikrobi jenostavno izlučuju digestivne enzime u svoje okruženje,[33][34] dok životinje jedino izlučuju te enzime iz specijalizovanih ćelija u svojim crevima, uključujući želudac i gušteraču, i pljuvačne žlezde.[35] Aminokiseline ili šećeri oslobođeni pomoću tih ekstracelularnih enzima zatim bivaju upumpani u ćelije pomoću proteina aktivnog transporta.[36][37]
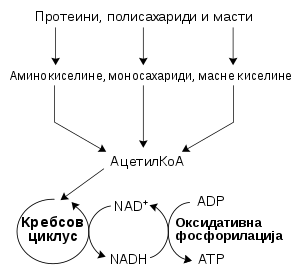
Energija iz organskih jedinjenja
[uredi | uredi izvor]Katabolizam ugljenih hidrata je razlaganje ugljenih hidrata u manje jedinice. Ugljeni hidrati obično bivaju uneti u ćelije nakon što su svareni do monosaharida.[38] Unutar ćelije, glavni put razlaganja je glikoliza, pri čemu se šećeri kao što su glukoza i fruktoza konvertuju u piruvat i delom se formira ATP.[39] Piruvat je intermedijer u nekoliko metaboličkih puteva, mada se najveći deo konvertuje u acetil-KoA putem aerobne (kiseonične) glikolize i ulazi u ciklus limunske kiseline. Izvesna količina ATP formira u Krebsovom ciklusu. Najvažniji produkat je NADH, koji nastaje iz NAD+ pri oksidaciji acetil-KoA. Ovom oksidacijom se oslobađa ugljen-dioksid kao otpadni produkat. U anaerobnim uslovima, glikolizom se proizvodi laktat, putem enzima laktatna dehidrogenaza koji ponovo oksiduje NADH do NAD+ radi ponovne upotrebe u glikolizi. Jedna alternativna ruta za razlaganje glukoze je pentozno fosfatni put, kojim se redukuje koenzim NADPH i formiraju pentozni šećeri kao što je riboza, šećerna komponenta nukleinskih kiselina.
Masti se katabolizuju putem hidrolize do slobodnih masnih kiselina i glicerola. Glicerol dalje podleže glikolizi, a masne kiseline se razlažu putem beta oksidacije uz formiranje acetil-KoA, koji zatim ulazi u ciklus limunske kiseline. Masne kiseline oslobađaju više energije pri oksidaciji od ugljenih hidrata, zato što ugljeni hidrati imaju veći sadržaj kiseonika u svojoj strukturi. Steroide isto tako razlažu neke bakterije u procesu koji je sličan beta oksidaciji, i pri tom procesu razlaganja se oslobađaju znatne količine acetil-KoA, propionil-KoA, i piruvata, svi od kojih se mogu koristiti u ćeliji kao izvor energije. M. tuberculosis može da raste na lipidu holesterol kao jedinom izvoru ugljenika, i za gene koji učestvuju u putevima upotrebe holesterola je utvrđeno da su važni tokom različitih faza životnog ciklusa infekcije sa M. tuberculosis.[40]
Aminokiseline se koriste za sintezu proteina i drugih biomolekula, ili bivaju oksidovane do uree i ugljen-dioksida kao izvor energije.[41] Oksidacioni put počinje sa uklanjanjem amino grupe posredstvom transaminaze. Amino grupa ulazi u ciklus ureje, ostavljajući deaminovani ugljenični kostur u obliku ketokiselina. Neke od tih ketokiselina su intermedijeri u ciklusu limunske kiseline, na primer deaminacijom glutamata se formira ketokiselina α-ketoglutarat.[42] Glukogene aminokiseline isto tako mogu da budu konvertovane u glukozu, putem glukoneogeneze.[43]
Anabolizam
[uredi | uredi izvor]Anabolizam je proces stvaranja kompleksnih jedinjenja od jednostavnih organskih molekula:
- Glikogeneza
- Glukoneogeneza
- Sinteza porfirina
- HMG-CoA redukcija, u kojoj se stvara holesterol i izoprenoidi.
- Sekundardni metabolizam, metabolizam koji nije neophodan za rast, preživljavanje i reprodukciju, ali ima ekoloških funkcija.
- Fotosinteza
- Svetla faza fotosinteze (reakcije koje zavise od određene količine svetlosti)
- Tamna faza (ne zavise od svetlosti)
Anabolizam je niz metaboličkih procesa izgradnje složenih molekula, u kojima se koriste prekurzori i energija nastala katabolizmom. Složeni molekuli koji najvećim delom čine ćelijske strukture, nastaju postupno, korak po korak iz malih jednostavnih molekula. Anabolizam se odvija u tri osnovna stupnja. U prvom stupnju nastaju prekurzori složenih molekula kao što su aminokiseline, monosaharidi, isoprenoidi i nukleotidi. U drugom stupnju prekurzori se aktiviraju, vezanjem energije iz ATP molekula, a u trećem stupnju se prekurzori spajaju u složena jedinjenja kao što su proteini, polisaharidi, lipidi i nukleinske kiseline.
Organizmi se međusobno razlikuju po tome koliko molekula mogu da izgrade u svojim ćelijama. Autotrofni organizmi kao što su biljke mogu da izgrade složene molekule kao što su polisaharidi i proteini iz jednostavnih molekula poput ugljen-dioksida i vode (fotosinteza). Za razliku od njih, heterotrofnim organizmima su potrebni izvori složenijih molekula, kao što su aminokiseline i monosaharidi, kako bi izgradili svoje složene molekule. Organizmi se mogu dalje podeliti na fotoautotrofne i fotoheterotrofne, čiji je izvor energije Sunce, i na hemoautotrofne i hemoheterotrofne, čiji je izvor energije reakcija oksidacije neorganskih materija.
Fiksacija ugljenika
[uredi | uredi izvor]
Fotosinteza je sinteza ugljenih hidrata iz sunčeve svetlosti i ugljen-dioksida (CO2). U biljkama, modrozelenim bakterijama i algama, kiseonična fotosinteza razlaže vodu, i pri tome nastaje kiseonik kao otpadni produkat. Ovaj proces koristi ATP i NADPH, koji su formirani putem fotosintetičkih reakcionih centara, za konvertovanje CO2 u glicerat 3-fosfat, koji se zatim može konvertovati u glukozu. Ova reakcija fiksacije ugljenika se izvodi posredstvom enzima ribuloza-bisfosfatna karboksilaza kao deo Kalvin – Bensonovog ciklusa.[44] Tri tipa fotosinteze se odvijaju u biljkama, C3 ugljenična fiksacija, C4 ugljenična fiksacija i CAM fotosinteza. Oni se razlikuju po ruti koju ugljen-dioksid uzima u Kalvinovom ciklusu, pri čemu C3 biljke direktno fiksiraju CO2, dok pri C4 i CAM fotosintezi prvo dolazi do inkorporacije CO2 u druga jedinjenja, kao adaptacija na intenzivnu sunčevu svetlost i sušne uslove.[45]
Kod fotosintetičkih prokariota mehanizmi ugljenične fiksacije su raznovrsniji. Ovde, ugljen-dioksid može da bude fiksiran putem Kalvin – Bensonovog ciklusa, reverznog Krebsog ciklusa,[46] ili karboksilacije acetil-KoA.[47][48] Prokariotski hemoautotrofi isto tako fiksiraju CO2 putem Kalvin – Bensonovog ciklusa, ali koriste energiju iz neorganskih jedinjenja za vođenje reakcije.[49]
Ugljeni hidrati i glikani
[uredi | uredi izvor]U anabolizmu ugljenih hidrata, jednostavne organske kiseline se mogu konvertovati u monosaharide, kao što je glukoza, koji se zatim koriste za formiranje polisaharida, kao što je skrob. Stvaranje glukoze iz jedinjenja kao što je piruvat, laktat, glicerol, glicerat 3-fosfat i aminokiseline se naziva glukoneogeneza. Glukoneogenezom se konvertuje piruvat do glukoza 6-fosfata putem serije intermedijera, mnogi od kojih su zajednički sa glikolizom.[39] Međutim, ovaj metabolički put nije jednostavno glikoliza koja se odvija unazad, pošto je nekoliko koraka katalizovano neglikolitičkim enzimima. Ovo je važno, jer se time omogućava zasebna regulacija formiranja i razlaganja glukoze, i sprečavaju situacije u kojima se oba metabolička puta simultano odvijaju u supstratnom (beskorisnom) ciklusu.[50][51]
Iako je stvaranje masti uobičajeni način čuvanja energije kod kičmenjaka, kao što su ljudi, masne kiseline u tim ostavama ne mogu da budu konvertovane do glukoze putem glukoneogeneze, pošto ti organizmi ne mogu da konvertuju acetil-KoA u piruvat; biljke imaju tu sposobnost, dok životinje nemaju neophodnu enzimatsku mašineriju.[52] Konsekventno, nakon dugotrajnog gladovanja, kičmenjaci moraju da proizvode ketonska tela iz masnih kiselina da bi nadoknadili glukozu u tkivima kao što je mozak, koja ne mogu da metabolizuju masne kiseline.[53] U drugim organizmima, kao što su biljke i bakterije, ovaj metabolički problem je rešen koristeći glioksilatni ciklus, kojim se zaobilazi dekarboksilacioni korak u ciklusu limunske kiseline i omogućava transformacija acetil-KoA do oksaloacetata, koji se zatim može koristiti za produkciju glukoze.[52][54]
Polisaharidi i glikani nastaju sekvencijalnim dodavanjem monosaharida posredstvom glikoziltransferaze iz reaktivnih šećerno-fosfatnih donora, kao što je uridin-difosfat glukoza (UDP-glukoza), na akceptorsku hidroksilnu grupu rastućeg polisaharida. Kako bilo koja hidroksilna grupa na prstenu supstrata može da bude akceptor, formirani polisaharidi mogu da imaju pravolančane ili razgranate strukture.[55] Nastali polisaharidi mogu da imaju strukturne i metaboličke funkcije, ili mogu da budu povezani sa lipidima i proteinima posredstvom enzima zvanih oligosahariltransferaze.[56][57]
Masne kiseline, izoprenoidi i steroidi
[uredi | uredi izvor]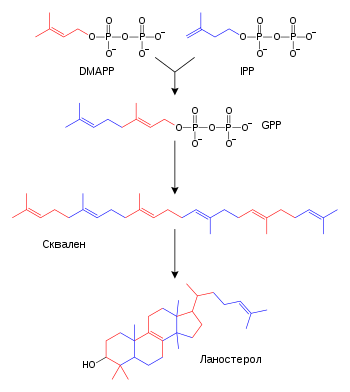
Masne kiseline se formiraju posredstvom masno kiselinskih sintaza kojima se polimerizuju i zatim redukuju acetil-KoA jedinice. Acilni lanci u masnim kiselinama se produžuju putem ciklusa reakcija kojima se dodaje acil grupa, redukuje do alkohola, dehidrira do alkenske grupe i zatim ponovo redukuje do alkanske grupe. Enzimi biosinteze masnih kiselina se dele u dve grupe: kod životinja i gljiva sve reakcije sinteze masnih kiselina posreduje jedan multifunkcionalni protein tipa I,[58] dok u biljnim plastidima i bakterijama zasebni enzimi tipa II posreduju svaki korak biohemijskih puteva.[59][60]
Terpeni i izoprenoidi su velika klasa lipida koja obuhvata karotenoide i formira najveću klasu biljnih prirodnih proizvoda.[61] Ova jedinjenja se formiraju putem sastavljanja i modifikacije izoprenskih jedinica doniranih iz reaktivnih prekurzora izopentenil pirofosfata i dimetilalil pirofosfata.[62] Ovi prekurzori mogu da budu formirani na različite načine. Kod životinja i arheja, mevalonatnim putem se proizvode ova jedinjenja iz acetil-KoA,[63] dok u biljkama i bakterijama nemevalonatni put koristi piruvat i gliceraldehid 3-fosfat kao supstrate.[62][64] Jedna važna reakcija u kojoj se koriste ovi aktivirani izoprenski donori je biosinteza steroida. Ovde se izoprenske jedinice spajaju i formira se skvalen koji zatim poprima konformaciju podesnu za formiranje seta prstenova, koja je prekurzor lanosterola.[65] Lanosterol zatim može da bude konvertovan u druge steroide, kao što su holesterol i ergosterol.[65][66]
Proteini
[uredi | uredi izvor]Organizmi variraju u pogledu njihove sposobnosti da sintetišu 20 proteinogenih aminokiselina. Većina bakterija i biljki može da sintetiše svih dvadeset, dok životinje mogu da sintetišu samo jedanaest neesencijalnih aminokiselina, a devet esencijalnih aminokiselina se moraju unositi putem hrane.[8] Nekim jednostavnim parazitima, kao što je bakterija Mycoplasma pneumoniae, nedostaje sposobnost sinteze svih aminokiselina i oni moraju da preuzimaju sve aminokiseline direktno od njihovih domaćina.[67] Sve aminokiseline se sintetišu iz intermedijera u biohemijskom putu glikolize, ciklusa limunske kiseline, ili pentoznog fosfata. Kao izvor azota koristi se glutamat i glutamin. Sinteza aminokiselina zavisi od formiranja podesne alfa-keto kiseline, koja zatim biva transaminisana do aminokiseline.[68]
Aminokiseline se koriste kao gradivni blokovi proteina. One se spajaju u lance putem peptidnih veza. Svaki protein ima svoju jedinstvenu sekvencu aminokiselinskih ostataka: to je njegova primarna struktura. Kao što se slova alfabeta mogu kombinovati i formirati skoro beskrajno mnoštvo različitih reči, aminokiseline se mogu povezati u različitim sekvencama kako bi se formiralo ogromno mnoštvo različitih proteina. Proteini se prave od aminokiselina koje su bile aktivirane vezivanjem za molekul transportne RNK putem estarske veze. Ovaj aminoacil-tRNK prekurzor se formira reakcijom koja je zavisna od ATP i koja se odvija posredstvom aminoacil tRNK sintetaze.[69] Molekul aminoacil-tRNk je zatim supstrat za ribozom, koji dodaje aminokiselinu na proteinski lanac, koristeći sekvencionu informaciju u informacionoj RNK.[70]
Nukleotidna sinteza i spasavanje
[uredi | uredi izvor]Nukleotidi se formiraju iz aminokiselina, ugljen-dioksida i mravlje kiseline u biohemijskom putu u kome se troši velika količina metaboličke energije.[71] Konsekventno, većina organizama ima efikasne sisteme za ponovnu upotrebu već formiranih nukleotida.[71][72] Purini se sintetišu kao nukleozidi (baze vezane za rubozu).[73] Adenin i gvanin se formiraju iz prekurzornog nukleozida inozin monofosfata, koji se sintetiše koristeći atome iz aminokiselina glicina, glutamina, i aspartinske kiseline, kao i formata prenesenog sa koenzima tetrahidrofolata. Pirimidini se, međutim, sintetišu iz baze orotata, koja se formira iz glutamina i aspartata.[74]
Energija
[uredi | uredi izvor]Oksidacijska fosforilacija
[uredi | uredi izvor]
U procesu oksidativne fosforilacije elektroni uklonjeni sa organskih jedinjenja u metaboličkim putevima, kao što je npr. Krebsov ciklus, prenose se na molekul kiseonika pri čemu se nastala energija koristi za sintezu ATP molekula. Kod eukariota prenos elektrona obavlja niz proteinskih kompleksa na unutrašnjoj membrani mitohondrija. Taj niz proteina koristi energiju nastalu prenosom elektrona za ispumpavanje protona izvan mitohondrija i čini respiratorni lanac. Proteinski kompleksi deluju tako da prenose elektron iz jednog aktivnog mesta u kompleksu na drugo, pri čemu u svakoj reakciji elektron gubi malu količinu energija, koja se na taj način vrlo efikasno koristi za ispumpavanje protona izvan mitohondrija. Ispumpavanjem protona nastaje na membrani mitohondrija elektrohemijski gradijent,[75] zbog razlike u koncentraciji protona. Ispumpani protoni se vraćaju unutar mitohondrija pomoću enzima ATP sintaza, koji koristi njihov protok niz gradijent sa sintezu ATP-a iz ADP-a.[18] Taj protok se može koristiti i za druge procese u ćeliji.
Kod prokariota, ovi proteini se nalaze na unutrašnjoj membrani ćelija.[76] Ovi proteini koriste energiju oslobođenu prolazom elektrona sa redukovanih molekula kao što je NADH na kiseonik za pumpanje protona kroz membranu.[77]
Energija iz neorganskih jedinjenja
[uredi | uredi izvor]Hemolitotrofni organizmi su grupa prokariota koji energiju dobijaju oksidacijom neorganskih jedinjenja. Ovi organizmi mogu da koriste vodonik,[78] jedinjenja koje sadrže redukovani sumpor (sulfid, vodonik sulfid, tiosulfat),[2] gvožđe(II)-oksid[79] ili amonijak,[80] kao elektronske donore. Elektroni se u respiratornom lancu iskorištavaju za dobivanje ATP-a, dok su elektron akceptori molekuli poput kiseonika ili nitrita.[81] Ovi procesi koji se odvijaju u mikroorganizmima mogu biti od velike važnosti u globalnom biogeohemijskim ciklusima, kao što su acetogeneza, nitrifikacija tla i denitrifikacija, i oni su od kritični za plodnost zemljišta.[82][83]
Energija sunčeve svetlosti
[uredi | uredi izvor]Energiju iz sunčeve svetlosti koriste biljke, određene grupe bakterija[84] (modrozelene bakterije, purpurne bakterije,[85] zelene sumporne bakterije[86][87]) i protisti. Ovaj proces je obično spregnut sa konverzijom ugljen-dioksida u organska jedinjenja, što je deo fotosinteze. Sistemi za prihvat energije i fiksiranje ugljenika mogu međutim zasebno da deluju kod prokariota, budući da purpurne bakterije i zelene sumporne bakterije mogu da koriste sunčevu svetlost kao izvor energije, uz prelaz između fiksacije ugljenika i fermentacije organskih jedinjenja.[88][89]
U mnogim organizmima prihvat solarne energije je u principu sličan sa oksidativnom fosforilacijom, jer uključuje skladištenje energije u vidu gradijenta protonske koncentracije. Ova sila protonskog kretanja zatim pokreće ATP sintezu.[18] Elektroni potrebni za vođenje ovog elektronskog transportnog lanca potiču od proteina za prikupljanje svetlosti zvanih fotosintetički reakcioni centri ili rodopsini. Reakcioni centeri se klasifikuju u dva tipa u zavisnosti od tipa prisutnog fotosintetskog pigmenta, pri čemu većina fotosintetičkih bakterija poseduje samo jedan tip, dok biljke i modrozelene bakterije imaju dva.[90]
U biljkama, algama i modrozelenim bakterijama, fotosistem II koristi svetlosnu energiju za uklanjanje elektrona iz vode, čime se oslobađa kiseonik kao otpadni produkat. Elektroni zatim teku do citohrom b6f kompleksa, koji koristi njihovu energiju za pumpanje protona kroz tilakoidnu membranu u hloroplastima.[32] Ovi protoni se vraćaju kroz membranu i omogućavaju dejstvo ATP sintaze. Elektroni zatim prolaze kroz fotosistem I i mogu da budu korišteni za redukovanje koenzima NADP+, da budu upotrebljeni u Kalvinovom ciklusu, ili da budu reciklovani za dalje ATP generisanje.[91]
Metabolizam azota
[uredi | uredi izvor]Azotni metabolizam podrazumeva procese u kojima se sintetišu azotna jedinjenja i u kojima dolazi do ispuštanja azota iz organizama, kao i biološki proces azotnog ciklusa:
- Ciklus uree je važan proces u kome dolazi do ispuštanja azota iz organizma u obliku uree
- Biološka azotofiksacija
- Azotna asimilacija
- Nitrifikacija
- Denitrifikacija
Azotni ciklus je biogeohemijski ciklus putem koga se azot konvertuje u višestruke hemijske forme dok cirkuliše između atmosfere, zemljišta i morskog ekosistema. Do konverzije azota može doći putem bioloških i fizičkih procesa. Važni procesi u azotnom ciklusu su fiksacija, amonifikacija, nitrifikacija, i denitrifikacija. Većinski deo zemljine atmosfere (78%) se sastoji od azota,[92] te je ona veliki izvor azota. Međutim, atmosferski azot ima ograničenu dostupnost za biološke primene, što dovodi do nedostataka upotrebljivog azota u mnogim tipovima ekosistema.
Azotni ciklus je posebno značajan za ekologiju, jer azotna dostupnost može da utiče na brzinu procesa u ekosistemu, uključujući primarnu produkciju i dekompoziciju. Ljudske aktivnosti kao što je sagorevanje fosilnih goriva, upotreba veštačih azotnih đubriva, i ispuštanje azota u vodene tokove su dramatično promenile globalni azotni ciklus.[93][94]
Metabolizam lekova
[uredi | uredi izvor]

Metabolizam lekova je metaboličko razlaganje lekova u živim organizmima, obično posredstvom specijalizovanih enzimatskih sistema. Opštije gledano, ksenobiotički metabolizam (od grčke reči xenos „stranac” i biotic „vezan za živa bića” je set metaboličkih puteva koji modifikuju hemijske strukture ksenobiotika, koji su strana jedinjenja za normalnu biohemiju organizma, kao što su lekovi ili otrovi. Ovi biohemijski putevi su forma biotransformacije koja je prisutna u svim glavnim grupama organizama, i smatra se da su drevnog porekla. Te reakcije obično deluju s ciljem detoksikacije otrovnih jedinjenja[103] (mada u nekim slučajevima intermedijeri ksenobiotičkog metabolizma mogu i sami da uzrokuju toksične efekte). Izučavanje metabolizma lekova se naziva farmakokinetikom. Modifikacija ili degradacija lekova i drugih ksenobiotičkih jedinjenja se prvenstveno vrši putem sledećih sistema:
Svi organizmi su konstantno izloženi jedinjenjima koja oni ne mogu da koriste za hranu i koja mogu da budu štetna ako se akumuliraju u ćelijama, jer nemaju metaboličke funkcije.[104] Ksenobiotici kao što su sintetički lekovi, prirodni otrovi i antibiotici bivaju detoksifikovani posredstvom seta ksenobiotičkih-metabolizirajućih enzima. Kod ljudi, oni obuhvataju citohrom P450 oksidaze,[105] UDP-glukuronoziltransferaze,[106] i glutation S-transferaze.[107] Ovaj sistem enzima deluje u tri stupnja da prvo oksiduje ksenobiotik (faza I) i zatim konjuguje u vodi rastvorne grupe na molekul (faza II). Modifikovani u vodi rastvorni ksenobiotik zatim može da bude ispumpan iz ćelije, i u višećelijskim organizmima može da bude dalje metabolizovan pre nego što se izluči (faza III). U ekologiji, te reakcije su posebno važne pri mikrobnoj biodegradaciji zagađivača i bioremedijaciji kontaminiranog zemljišta i naftnih izlivanja.[108] Mnoge od tih mikrobnih reakcija se odvijaju i u višećelijskim organizmima, ali zbog neverovatne raznolikosti postojećih vrsta mikroba, ovi organizmi su u stanju da metabolizuju daleko širi raspon ksenobiotika od višećelijskih organizama, i mogu da degradiraju čak i perzistentne organske zagađivače kao što su organohloridna jedinjenja.[109]
Srodni problem za aerobne organizme je oksidativni stres.[110] Ovde, procesi koji obuhvataju oksidativna fosforilaciju i formiranje disulfidnih veza tokom proteinskog savijanja proizvode reaktivne vrste kiseonika, kao što je vodonik peroksid.[111] Ovi štetni oksidansi se uklanjaju pomoću antioksidansnih metabolita, kao što je glutation, i enzima, kao što su katalaze i peroksidaze.[112][113]
Metabolizam farmaceutskih lekova je važan aspekt farmakologije i medicine. Na primer, brzina metabolizma određuje trajanje i intenzitet farmakološkog dejstva leka. Metabolizam leka isto tako može da utiče na otpornost na višestruke lekove kod infektivnih bolesti, i na hemoterapiju za tretiranje kancera. Dejstvo nekih lekova kao što supstrati ili inhibitori enzima koji učestvuju u ksenobiotičkom metabolizmu su čest razlog hazardnih interakcija lekova. Ovi putevi su isto tako važni u nauci o životnoj sredini, pri čemu ksenobiotički metabolizam mikroorganizama određuje da li će zagađivač biti razložen tokom procesa bioremedijacije, ili će biti perzistentan u okolini. Enzimi ksenobiotičkog metabolizma, a posebno glutation S-transferaze su takođe važni u poljoprivredi, pošto oni mogu da proizvedu otpornost na pesticide i herbicide.
Permeabilnosne barijere i detoksifikacija
[uredi | uredi izvor]Precizna kompozicija jedinjenja kojima je izložen organizam je u velikoj meri nepredvidljiva i može se s vremenom znatno razlikovati. To je glavna karakteristika ksenobiotskog toksičnog stresa.[114] Glavni izazov sa kojim se suočavaju ksenobiotski sistemi detoksifikacije je da moraju da budu u stanju da uklone skoro neograničen broj ksenobiotskih jedinjenja iz kompleksne mešavine hemikalija koja učestvuje u normalnom metabolizmu. Rešenje koje je evoluiralo za adresiranje ovog problema je elegantna kombinacija fizičkih barijera i nisko specifičnih enzimatskih sistema.
Svi organizmi koriste ćelijske membrane kao hidrofobne permeabilnosne barijere za kontrolu pristupa njihovoj unutrašnjoj sredini. Polarna jedinjenja ne mogu da prođu putem difuzije kroz te ćelijske membrane, i unos korisnih molekula je posredovan transportnim proteinima koji specifično odabiraju supstrate iz ekstracelularne smeše. Ovaj selektivni unos srpečava ulaz većini hidrofilnih molekula u ćelije, pošto njih ne prepoznaje bilo koji specifični transporter.[115] U kontrastu s tim, difuzija hidrofobnih jedinjenja kroz te barijere se ne može kontrolisati, i organizmi stoga ne mogu da isključe ksenobiotike rastvorne u lipidima koristeći membranske barijere.
Međutim, postojanje permeabilnosnih barijera znači da su organizmi uspešno evoluirali detoksifikacione sisteme koji eksploatišu hidrofobnost zajedničku za membransko-permeabilne ksenobiotike. Ovi sistemi stoga rešavaju problem specifičnosti putem posedovanja tako širokih supstratnih specifičnosti da oni metabolizuju skoro sva nepolarna jedinjenja.[114] Korisni metaboliti su isključeni pošto su oni polarni, i generalno sadrže jednu ili više naelektrisanih grupa.
Detoksifikacija reaktivnih nusprodukata normalnog metabolizma se ne može ostvariti gore opisanim sistemima, pošto su ti molekulski entiteti izvedeni iz normalnih ćelijskih konstituenata i obično dele njihove polarne karakteristike. Međutim, pošto ta su ova jedinjenja malobrojna, specifični enzimi mogu da ih prepoznaju i uklone. Primeri takvih specifičnih detoksifikacionih sistema su glioksalazni sistem, koji uklanja reaktivni aldehid metilglioksal,[116] i razni antioksidantski sistemi koji eliminišu reaktivne vrste kiseonika.[117]
Faze detoksifikacije
[uredi | uredi izvor]
Metabolizam ksenobiotika se obično deli u tri faze: modifikacija, konjugacija, i ekskrecija. Ove reakcije deluju u međusobnom skladu tako da se ksenobiotici detoksifikuju i bivaju uklonjeni iz ćelija.
Faza I – modifikacija
[uredi | uredi izvor]U fazi I, dejstvom različitih enzima se uvode reaktivne i polarne grupe u enzimske supstrate. Jedna od najčešćih modifikacija je hidroksilacija koju katalizuje oksidazni sistem mešovite funkcije koji je zavisan od citohroma P-450. Ovi enzimski kompleksi deluju tako što inkorporiraju atom kiseonika u neaktivirane ugljovodonike, što može da dovede bilo do uvođenja hidroksilnih grupa ili N-, O- i S-dealkilacije supstrata.[118] Reakcioni mehanizam P-450 oksidaza se odvija putem redukcije kiseonika vezanog za citohrom i generacije veoma reaktivnih oksiferilnih entiteta, prema sledećoj shemi:[119]
- O2 + NADPH + H+ + RH → NADP+ + H2O + ROH
Reakcije faze I (koje se takođe nazivaju nesintetskim reakcijama) mogu se obuhvataju oksidaciju, redukciju, hidrolizu, ciklizaciju, deciklizaciju, i adiciju kiseonika ili uklanjanje vodonika, posredstvom oksidaza mešovite funkcije, obično u jetri. Ove oksidativne reakcije tipično obuhvataju citohrom P450 monooksigenaze (koje se obično skraćeno obeležavaju sa CYP), NADPH i kiseonik. Klase farmaceutskih lekova koje ovim metodom bivaju metabolizovane obuhvataju na primer fenotiazine, paracetamol, i steroide. Ako su metaboliti reakcija faze I dovoljno polarni, oni lako mogu da budi izlučeni. Međutim, mnogi produkti faze I ne bivaju brzo eliminisani i podležu naknadnoj reakciji u kojoj se endogeni supstrat kombinuje sa novoinkorporiranom grupom čime se formira visoko polarni konjugat.
Česti vid oksidacije u fazi I je konverzija C-H veze u C-OH. Ovom reakcijom se ponekad konvertuje farmakološki neaktivno jedinjenje (prolek) do farmakološki aktivnog jedinjenja. Po istom principu, u fazi I može doći do preobražaja netoksičnog molekula u otrovni (toksifikacija). Jednostavna hidroliza u stomaku je normalno neškodljiva reakcija, međutim postoje izuzeci. Na primer, metabolizmom faze I se konvertuje acetonitril do HOCH2CN, који се брзо дисоцира у формалдехид и водоник цијанид.[120]
Метаболизам фазе I nekog molekula koji je kandidat za lek se može laboratorijski stimulisati koristeći neenzimske katalizatore.[121] Ovaj primer biomimetičke reakcije ima tendenciju stvaranja produkata koji obično sadrže metabolite faze I. Na primer, glavni metabolit farmaceutskog trimebutina, desmetiltrimebutin (nor-trimebutin), se može efikasno proizvesti putem in vitro oksidacije komercijalno dostupnog leka. Hidroksilacija N-metil grupe dovodi do odvajanja molekula formaldehida, dok se oksidacija O-metil grupe odvija u manjoj meri.
- Oksidacija
- Citohrom P450 monooksigenazni sistem
- Monooksigenazni sistem koji sadrži flavin
- Alkoholna dehidrogenaza i aldehidna dehidrogenaza
- Monoaminska oksidaza
- Kooksidacija peroksidazama
Citohrom P450 reduktaza, koja je takođe poznata kao NADPH:ferihemoproteinska oksidoreduktaza, NADPH:hemoproteinska oksidoreduktaza, NADPH:P450 oksidoreduktazae, P450 reduktaza, POR, CPR, CYPOR, je enzim vezan za membranu koji je neophodan pri transferu elektrona do citohroma P450 u mikrozomu eukariotske ćelije od enzima koji sadrže FAD i FMN, NADPH:citohrom P450 reduktazu. Opšta shema protoka elektrona u POR/P450 sistemu je: NADPH → FAD → FMN → P450 → O2
Tokom reakcija redukcije, hemikalija može da uđe u beskorisno kruženje, pri čemu ona stiče elektron slobodnog radikala, zatim ga odmah predaje kiseoniku (da formira superoksidni anjon).
Faza II – konjugacija
[uredi | uredi izvor]U naknadnim reakcijama faze II, ovi aktivirani ksenobiotički metaboliti bivaju konjugovani sa naelektrisanim molekulskim entitetima kao što su glutation (GSH), sulfat, glicin, ili glukuronska kiselina. Mesta na lekovima gde dolazi do reakcija konjugacije su karboksil (-COOH), hidroksil (-OH), amino (NH2), i sulfhidril (-SH) grupe. Produkti reakcija konjugacije imaju povećanu molekulsku težinu i uglavnom su manje aktivni od njihovih supstrata, što je u kontrastu sa reakcijama faze I, koje obično proizvode aktivne metabolite. Adicija velikih anjonskih grupa (kao što je GSH) detoksifikuje reaktivne elektrofile i time se formiraju polarniji metaboliti koji ne mogu da prolaze kroz membrane difuzijom, i je često neophodno da budu aktivno transportovani.
Ove reakcije su katalizovane velikom grupom transferaza sa širokom specifičnošću, koje zajedno mogu da metabolizuju skoro sva hidrofobna jedinjenja koja sadrže nukleofilne ili elektrofilne grupe.[114] Jedna od najvažnijih klasa ove grupe su glutation S-transferaze (GST).
| Mehanizam | Enzimi | Kofaktor | Lokacija | Izvori |
|---|---|---|---|---|
| metilacija | metiltransferaza | S-adenozil-L-metionin | jetra, bubrezi, pluća, CNS | [122] |
| sulfacija | sulfotransferaze | 3'-fosfoadenozin-5'-fosfosulfat | jetra, bubrezi, creva | [122] |
| Acetilacija | Acetil koenzim A | jetar, pluća, slezina, sluznica želuca, crvena krvna zrnca, limfociti | [122] | |
| Glukuronidacija | UDP-glukuronoziltransferaze | UDP-glukuronska kiselina | jetra, burezi, creva, pluća, koža, prostata, mozak | [122] |
| glutationska konjugacija | glutation S-transferaze | glutation | jetra, bubrezi | [122] |
| glicinska konjugacija | Dvostepni proces:
|
glicin | jetra, bubrezi | [123] |
Faza III – dalje modifikacije i ekskrecija
[uredi | uredi izvor]Nakon reakcija faze II, ksenobiotički konjugati mogu dalje da budu metabolizovani. Često korišćeni primer je transformacija glutationskih konjugata do acetilcisteinskih (merkapturinsko kiselinskih) konjugata.[124] Ovde, γ-glutamatni i glicinski ostaci u glutationskom molekulu bivaju uklonjeni posredstvom gama glutamil transferaze i dipeptidaza. U finalnom koraku, cistinski ostatak u konjugatu je acetilisan.
Konjugati i njihovi metaboliti mogu da budu izlučeni iz ćelije u fazi III njihovog metabolizma, pri čemu anjonske grupe deluju kao oznake afiniteta za razne membranske transportere familije proteina za rezistenciju na više lijekova (MRP).[125] Ovi proteini su članovi familije ATP-vezujućih kasetnih transportera i mogu da katalizuju transport koji je zavisan od ATP molekula za ogromno mnoštvo hidrofobnih anjona,[126] i time uklanjaju produkte faze II do ekstracelularnog medijuma, gde oni mogu dalje da budu metabolizovani ili bivaju izlučeni.[127]
Endogeni toksini
[uredi | uredi izvor]Detoksifikacija endogenih reaktivnih metabolita, kao što su peroksidi i reaktivni aldehidi, često ne može da bude ostvarena gore opisanim sistemom. Ovo je posledica toga da su ti entiteti izvedeni iz normalnih ćelijskih konstituenata i obično imaju istovetne polarne karakteristike. Međutim, pošto postoji mali broj ovih jedinjenja, enzimatski sistemi mogu da koriste specifično molekularno prepoznavanje, i da ih na taj način uklone. Sličnost ovih molekula sa korisnim metabolitima stoga znači da su obično neophodni različiti detoksifikacioni enzimi za metabolizam svake grupe endogenih toksina. Primeri ovih specifičnih detoksifikacionih sistema su glioksalazni sistem, kojim se uklanja reaktivni aldehidni metilglioksal,[116] i razni antioksidansni sistemi koji eliminišu reaktivne vrste kiseonika.[117]
Lokacije
[uredi | uredi izvor]Kvantitativno, glatki endoplazmatični retikulum ćelija jetre je glavni organ metabolizma lekova, mada svako biološko tkivo ima izvesnu sposobnost metabolizovanja lekova. Faktori odgovorni za jetreni doprinos metabolizmu lekova su da je to veliki organ, da je to prvi organ kroz koji prolaze hemikalije apsorbovane u gastrointestinalnom traktu, i da u njemu postoji veoma visoka koncentracija većine enzima koji metabolizuju lekove, u poređenju sa ostalim organima. Ako je lek koji je unet u GI trakt ušao u hepatičku cirkulaciju kroz portalnu venu, i postao podrobno metabolizovan, kaže se da ispoljava efekat prvog prolaza.
Druga mesta metabolizma lekova obuhvataju epitelsko tkivo gastrointestinalnog trakta, pluća, bubrege, i kožu. Ta mesta su obično odgovorna za lokalizovane reakcije toksičnosti.
Faktori koji utiču na metabolizam lekova
[uredi | uredi izvor]Trajanje i intenzitet farmakološkog dejstva većine lipofilnih lekova je određen brzinom kojom se oni metabolizuju do neaktivnih produkata. Sistem citohrom P450 monooksigenaze je najvažniji put u tom pogledu. Generalno, sve što povećava vrzinu metabolizma (e.g., enzimska indukcija) farmakološki aktivnog metabolita će smanjiti trajanje i intenzitet dejstva leka. Suprotno isto tako važi (e.g., enzimska inhibicija). Međutim, u slučajevima gde je enzim odgovoran za metabolizovanje proleka u lek, enzimska indukcija može da ubrza tu konverziju i da poveća nivo leka, potencijalno uzrokujući toksičnost.
Razni fiziološki i patološki faktori isto tako mogu da utiču na metabolizam lekova. Fiziološki faktori koji mogu da utiču na metabolizam lekova su starost, individualne varijacije (e.g., farmakogenetika), enterohepatička cirkulacija, ishrana, intestinalna flora, ili polne razlike. Generalno, lekovi se sporije metabolizuju kod fetalnih, neonatalnih i starih ljudi i životinja, nego kod odraslih.
Genetičke varijacije (polimorfizam) doprinose delu varijabilnosti koja ima uticaja na lekove. Kod N-acetiltransferaza (koje učestvuju u reakcijama faze II), individualne varijacije kreiraju grupu osoba koje sporije acetiliraju (spori acetilatori) i one koji brzo acetiliraju, pri čemu je populacija podeljena, npr. 50:50 u Kanadi. Ova varijacija može da ima dramatične posledice, pošto su spori acetilatori skloniji toksičnosti zavisnoj od doze.
Enzimi sistema citohromne P450 monooksigenaze isto tako mogu da variraju među osobama, pri čemu se razlike javljaju kod 1 – 30% ljudi, u zavisnosti od njihovog etničkog porekla.
Doza, frekvencija, ruta administracije, tkivna distribucija i proteinsko vezivanje leka utiču na njegov metabolizam. Patološki faktori isto tako mogu da utiču na metabolizam lekova, čime su obuhvaćene bolesti jetre, bubrega, i srca.
Metode in silico modelovanja i simulacije omogućavaju predviđanje metabolizma lekova kod virtualnih pacijenata pre sprovođenja kliničkih studija na ljudskim subjektima.[128] Ovo se može koristiti za identifikaciju osoba sa najvećim rizikom od nepoželjnih reakcija.
Termodinamika živih organizama
[uredi | uredi izvor]Živi organizmi moraju da podležu zakonima termodinamike, koji opisuju transfer toplote i rada. Drugi princip termodinamike nalaže da u svakom zatvorenom sistemu, količina entropije (nereda) ne može da bude smanjena. Mada izuzetna kompleksnost živih organizama naizgled stoji u kontradikciji sa ovim zakonom, život je moguć jer su svi organizmi otvoreni sistemi koji razmenjuju materiju i energiju sa svojim okruženjem. Stoga živući sistemi nisu u ekvilibrijumu, već su disipativni sistemi koji održavaju svoje stanje visoke kompleksnosti uzrokujući velika povećanja entropije u svojim okruženjima.[129] Metabolizam ćelija ostvaruje to sprezanjem spontanih procesa katabolizma sa nespontanim procesima anabolizma. U termodinamičkom smislu, metabolizam održava red putem kreiranja nereda.[130]
Polje biološke termodinamike ima fokus na principima hemijske termodinamike u biologiji i biohemiji. Pokriveni principi obuhvataju prvi princip termodinamike, drugi princip termodinamike, Gibsovu slobodnu energiju, statističku termodinamiku, reakcionu kinetiku, i hipiteze o poreklu života. Trenutno se biološka termodinamika bavi proučavanjem unutrašnje biohemijske dinamike, kao što je: ATP hidroliza, proteinska stabilnost, DNK vezivanje, membranska difuzija, enzimska kinetika,[131] i drugim esencijalnim energetski kontrolisanim putevima. U pogledu termodinamike, količina energije koja ima sposobnost vršenja rada tokom hemijske reakcije se kvantitativno meri promenom Gibsove slobodne energije. Fizički biolog Alfred Lotka je pokušao da ujedini promenu Gibsove energije sa evolucionom teorijom.
Energija transformacije u biološkim sistemima
[uredi | uredi izvor]Sunce je primarni izvor energije za žive organizme. Nekim živim organizmima poput biljki je neophodna direktna sunčeva svetlost, dok drugi organizmi poput ljudi mogu indirektno da steknu sunčevu energiju.[132] Nezavisno od tipa žive vrste, svi živi organizmi moraju da zarobe, prenose, skladište i koriste energiju da bi opstali.
Odnos između energije prispele sunčeve svetlosti i njene talasne dužine λ ili frekvencije ν je dat izrazom
gde je h Plankova konstanta (6,63x10−34Js), a c je brzina svetlosti (2,998x108 m/s). Biljke koriste svetlosnu energiju za sprovođenje procesa fotosinteze, čime efektivno konvertuju solarnu u hemijsku energiju. Da bi ponovo prenele energiju životinje se hrane biljkama, i koriste energiju svarenog biljnog materijala za kreiranje bioloških makromolekula.
Regulacija i kontrola
[uredi | uredi izvor]Kako se okruženja većine organizama stalno menjaju, reakcije metabolizma moraju da budu delikatno regulisane da bi se održao konstantan set uslova unutar ćelija, stanje koje se naziva homeostaza.[133][134] Metabolička regulacija isto tako omogućava organizmima da odgovore na signale i da formiraju aktivne interakcije sa svojim okruženjem.[135] Dva blisko povezana koncepta su važna za razumevanje načina na koji su metabolički putevi kontrolisani. Prvo, regulacija enzima u biohemijskom putu je način na koji se njegova aktivnost povećava i umanjuje u responsu na signale. Drugo, kontrola koju vrši taj enzim je efekat koji te promene aktivnosti imaju na sveukupnu brzinu puta (fluks kroz put).[136] Na primer, enzim može da ispolji velike promene u aktivnosti (i.e. on je visoko regulisan), ali ako te promene imaju malo uticaja na fluks metaboličkog puta, onda taj enzim ne učestvuje u kontroli tog puta.[137]

Postoje višestruki nivoi metaboličke regulacije. U unutrašnjoj regulaciji, metabolički put sam reguliše odgovore na promene nivoa supstrata ili produkata; na primer, smanjenje količine proizvoda može povećati fluks kroz put radi kompenzovanja promene.[136] Ovaj tip regulacije često obuhvata alosternu regulaciju aktivnosti višestrukih enzima na putu.[138] Spoljašnja kontrola obuhvata ćeliju u višećelijskom organizmu koja menja svoj metabolizam kao odgovor na signale od drugih ćelija. Ti signali su obično u formi rastvornih glasnika, kao što su hormoni i faktori rasta, a njih detektuju specifični receptori na površini ćelije.[139] Ti signali se zatim transmituju unutar ćelije putem sistema sekundarnih glasnika, što često obuhvata fosforilaciju proteina.[140]
Vrlo dobro izučen primer eksterne kontrole je regulacija metabolizma glukoze pomoću hormona insulina.[141] Insulin se proizvodi u responsu na povećanje nivoa krvne glukoze. Vezivanje hormona za insulinske receptore na ćelijama zatim aktivira kaskadu proteinskih kinaza, što uzrokuje da ćelija preuzme glukozu i konvertuje je u skladišne molekule, kao što su masne kiseline i glikogen.[142] Metabolizam glikogena je kontrolisan aktivnošću fosforilaze, enzima koji razlaže glikogen, i glikogenske sintaze, enzima koji posreduje njegovo formiranje. Ovi enzimi su regulisani u recipročnom maniru, pri čemu fosforilacija inhibira glikogensku sintazu, i aktivira fosforilazu. Insulin uzrokuje sintezu glikogena aktiviranjem proteinske fosfataze i proizvodeći smanjenje fosforilacije tih enzima.[143]
Regulatorni enzimi su obično prvi u sekvenci multienzimskog sistema: proizvod reakcije katalizovan prvim enzimom je supstrat drugog enzima, tako da ćelija može da kontroliše količinu dobijenog proizvoda regulacijom aktivnosti prvog enzima metaboličkog puta. Postoji više strategija aktivacije i deaktivacije regulatornih enzima. Regulatorni enzimi zahtevaju dodatni proces aktivacije i moraju proći kroz izvesne modifikacije u svojoj prostornoj strukturi, kako bi postali funkcionalni, na primer, katalizujući enzimi (regulatorni enzimi). Regulacija aktivacije katalizujućih enzima je neophodna da bi se regulisala sveukupna brzina reakcije, i da bi se dobila količina proizvoda koja je neophodna u datom trenutku, te stoga regulatorni enzimi imaju biološku važnost. Postoje dva tipa aktivacije regulatornih enzima: alosterna i kovalentno modulisana; mada, enzim može da kombinuje oba tipa regulacije.
Alosterni enzimi
[uredi | uredi izvor]Ovaj tip enzima sadrži dva mesta vezivanja: supstratno i efektorsko. Efektori su mali molekuli koji modulišu enzimsku aktivnost; oni funkcionišu putem reverzibilnog, nekovalentnog vezivanja regulatornog metabolita u alosternom mestu (koje nije aktivno mesto). Kad su vezani, ovi metaboliti ne učestvuju direktno u katalizi, ali su uprkos toga oni esencijalni: oni dovode do konformacionih promena u datom delu enzima. Ove promene utiču na sveukupnu konformaciju aktivnog mesta, uzrokujući promene aktivnosti reakcije.[144]
- Svojstva
Alosterni enzimi generalno imaju veću masu od drugih enzima. Osim enzima sa jednom podjedinicom, postoje i oni sa više podjedinica, koji mogu da imaju aktivno mesto i regulatorno mesto na različitim podjedinicama. Oni ispoljavaju specijalnu kinetiku: kooperaciju. U ovom slučaju, konfiguracione promene u svakom proteinskom lancu proizvode promene u drugim lancima. Ove promene se javljaju na tercijarnim i kvaternarnim nivoima organizacije. Na osnovu modulacije, oni se mogu klasifikovati u dve različite grupe:
- Homotropni alosterni enzimi: supstrat i efektor učestvuju u modulaciji enzima, što utiče na enzimsku katalitičku aktivnost.
- Heterotropni alosterni enzimi: samo efektor učestvuje u modulaciji.
- Povratna inhibicija
U nekim multienzimskim sistemima, enzim biva inhibiran krajnjim produktom, kad god je njegova koncentracija prevaziđe potrebe ćelije. Stoga se brzina reakcije može kontrolisati količinom produkta koji je neophodan ćeliji (što su potrebe manje, to sporije reakcija teče).
Povratna inhibicije je jedna od najvažnijih funkcija proteina. Putem povratne inhibicije, ćelija može da zna da li je količina produkta dovoljna za njeno izdržavanje, ili postoji nedostatak produkta (ili je koncentracija produkta prevelika). Ćelija ima sposobnost reagovanja na tu vrstu situacije na mehanički način i da tako rešava problem količine produkta. Jedan primer povratne inhibicije u ljudskim ćelijama je protein akonitaza (enzim koji katalizuje izomerizaciju citrata u izocitrat). Kad je ćeliji potrebno gvožđe, ovaj enzim gubi molekul gvožđa i njegova forma se menja. Kad dođe do toga, akonitaza se konvertuje u IRPF1, translacioni represor ili iRNK stabilizator, koji suzbija formiranje proteina koji vezuju gvožđe i pospešuje formiranje proteina koji mogu da uzmu gvožđe iz ćelijskih rezervi.[144][145]
Kovalentno modulisani enzimi
[uredi | uredi izvor]Pri ovom vidu kontrole aktivne i neaktivne forme enzima se menjaju usled kovalentne promene njihovih struktura, što je katalizovano drugim enzimima. Ovaj tip regulacije se sastoji od adicije ili eliminacije pojedinih molekula koji mogu da budu vezani za enzim. Najvažnije grupe koje se koriste kao modifikatori su fosfati, metil, uridin, adenin i adenozin difosfat ribozil. Ove grupe bivaju dodate ili eliminisane sa proteinskih struktura posredstvom drugih enzima. Najznačajnija kovalentna modifikacija je fosforilacija. Serin, treonin i tirozin su obično aminokiseline koje učestvuju u kovalentnim modifikacijama i koje se koriste za kontrolu enzimskih katalitičkih aktivnosti. Kinaze i fosfataze su najpoznatije klase enzima koje posreduju ove modifikacije, kojima se uzrokuju promene konformacionih stanja i time afinitet vezivanja supstrata.
Evolucija
[uredi | uredi izvor]
Centralni putevi metabolizma, koji su opisani gore, kao što su glikoliza i ciklus limunske kiseline, prisutni su u sva tri domena živih organizama i bili su prisutni kod zadnjeg univerzalnog zajedničkog pretka.[4][146] Ta univerzalna predačka ćelija je bila prokariotska i verovatno je bila metanogena. Ona je imala ekstenzivni aminokiselinski, nukleotidni, ugljeno hidratni i lipidni metabolizam.[147][148] Zadržavanje ovih drevnih puteva tokom kasnije evolucije je verovatno posledica toga da su ove reakcije optimalno rešenje specifičnog metaboličkog problema, pri čemu putevi kao što su glikoliza i ciklus limunske kiseline proizvode svoje krajnje proizvode veoma efikasno i u minimalnom broju koraka.[5][6] Moguće je da su prvi putevi enzimski posredovanog metabolizma bili delovi purinskog nukleotidnog metabolizma, dok su prethodni metabolički putevi bili deo drevnog RNK sveta.[149]
Mnogi modeli su predloženi za opisivanje mehanizama pomoću kojih novi metabolički putevi evoluiraju. Time je ovuhvaćena sekvencijalna adicija novih enzima na kratke predačke puteve, duplikacija i zatim divergencija celokupnih puteva, kao i regrutovanje postojećih enzima i njihovo sastavljanje u nove reakcione puteve.[150] Relativna važnost tih mehanizama nije razjašnjena, ali su genomske studije pokazale da je za enzime u putu verovatnije da imaju zajedničko poreklo, iz čega proizilazi da su mnogi putevi evoluirali u korak-po-korak maniru, pri čemu su nove funkcije kreirane iz postojećih koraka u putu.[151] Jedan alternativni model potiče iz studije koja prati evoluciju struktura proteina u metaboličkim mrežama. Taj model sugeriše da enzimi u znatnoj meri bivaju regrutovani ili pozajmljeni da izvode slične funkcije u različitim metaboličkim putevima. Ovo je evidentno u MANET bazi podataka.[152] Ovi procesi regrutovanja dovode do evolucionog enzimatskog mozaika.[153] Treća mogućnost je da neki delovi metabolizma mogu da postoje kao „moduli” koji se mogu ponovo koristiti u različitim putevima i vršiti slične funkcije na različitim molekulima.[154]
Osim evolucije novih metaboličkih puteva, evolucija može izazvati i gubitak metaboličkih funkcija. Na primer, u nekim parazitima metabolički procesi koji nisu esencijalni za opstanak su izgubljeni, i postojeće aminokiseline, nukleotidi i ugljeni hidrati se umesto toga uzimaju od domaćina.[155] Slične redukovane metaboličke sposobnosti su uočene kod endosimbiotskih organizama.[156]
Istraživanja
[uredi | uredi izvor]
Klasično, metabolizam se proučavan koristeći redukcionistički pristup koji je usredsređen na pojedinačni metabolički put. Posebno je vredna upotreba radioaktivnih obeleživača na nivoima celog organizma, tkiva i ćelija, koji definišu puteve od prekurzora do finalnih produkata tako što identifikuju radioaktivno obeležene intermedijere i produkte.[157] Enzimi koji katalizuju ove hemijske reakcije mogu zatim da budu prečišćeni i njihova kinetika i responsi na inhibitore istraženi. Paralelni pristup je da se identifikuju mali molekuli u ćelijama ili tkivima. Kompletan set tih molekula se naziva metabolom. Sveukupno, ove studije daju dobar uvid u strukturu i funkciju jednostavnih metaboličkih puteva, ali su neadekvatne kad se primene na kompleksnije sisteme kao što je metabolizam kompletne ćelije.[158]
Ideja kompleksnosti metaboličke mreže u ćelijama koje sadrže hiljade različitih enzima je ilustrovana slikom na kojoj su prikazane interakcije između samo 43 proteina i 40 metabolita. Genomska sekvenca sadrži oko 45.000 gena, znatan deo kojih biva izražen u specifičnim ćelijskim tipovima.[159] U današnje vreme je moguće da se koriste genomski podaci za rekonstruisanje kompletnih mreža biohemijskih reakcija i da se formiraju holistički matematički modeli, koji bolje objašnjavaju i predviđaju ponašanje metaboličkih mreža.[160] Ovi modeli su posebno korisni kad se koriste pri integraciji biohemijskih puteva i metaboličkih podataka prikupljenih primenom klasičnih metoda sa podacima o izražavanjima gena iz proteomskih studija i iz DNK mikročipova.[161] Koristeći te tehnike, proizveden je model ljudskog metabolizma, koji nalazi primenu u usmeravanju budućih aktivnosti na otkrivanju lekova, kao i u biohemijskim istraživanjima.[162] Ovi matematički modeli se koriste u analizi mreža, za klasifikovanje ljudskih bolesti u grupe sa zajedničkim proteinima ili metabolitima.[163][164]
Bakterijske metaboličke mreže su upečatljiv primer organizacije „leptir-mašne”[165][166][167], arhitekture koja ima sposobnost unosa širokog opsega nutrijenata i koja proizvodi mnoštvo raznovrsnih proizvoda i složenih makromolekula koristeći relativno mali broj intermedijernih zajedničkih komponenti.
Glavni vid tehnološke primene ovih informacija je metabolički inženjering. Organizmi kao što su kvasac, biljke ili bakterije se genetički modifikuju da bi se učinili korisnijim u biotehnološkim primenama i da bi se omogućila produkcija pojedinih lekova, kao što su antibiotici, ili industrijske hemikalije, kao što su 1,3-propandiol i šikiminska kiselina.[168][169][170] Cilj genetičke modifikacije obično je da se redukuju količina energije koja se koristi pri proizvodnji proizvoda, da se poveća prinos i da se redukuje nastanak otpada.[171]
Istorija
[uredi | uredi izvor]Istorija istraživanja metabolizma je par milenijuma duga. Termin metabolizam je izveden iz grčke reči Μεταβολισμός – Metabolismos sa značenjem „promena”, ili „prebačaj”.[172]


Aristotelov rad Delovi životinja postavio je dovoljno detalja o njegovom gledištu na metabolizam da se može formirati model otvorenog protoka. On je smatrao da u svakom stupnju procesa, materijali iz hrane bivaju transformisani, uz oslobađanje toplote kao klasičnog elementa vatre, i uz izlučivanje rezidualnih materijala kao što su urin, žuč, ili fekalije.[173]
Jedan od ranih koncepata metabolizma seže iz 13. veka od Ibn al-Nafisa (1213-1288), koji je ustanovio da su telo i njegovi delovi u stalnom stanju trošenja energije i hranjenja, pa se stoga u telu odvijaju stalne promene.[174] Istorija naučnog izučavanja metabolizma obuhvata nekoliko vekova i prešla je sa ispitivanja celih životinja u ranim studijama, na ispitivanje individualnih metaboličkih reakcija u modernoj biohemiji. Prvi kontrolisani eksperiment objavio je Santorio Santorio 1614. godine u svojoj knjizi Ars de statica medecina,[175] gde je opisao promene svoje težine pre i posle jela, spavanja, rada, polnog odnosa, posta, pijenja, naprezanja. Otkrio je da većina pojedene hrane je izgubljena u procesu koji je on nazvao „insenzibilna perspiracija“.
U tim ranim studijama, mehanizam metaboličkih procesa nije bio određen, i smatralo se da vitalna sila animira živa tkiva.[176] U 19. veku je istraživanjem alkoholnog vrenja, pretvaranja šećera u alkohol pomoću kvasaca, Luj Paster je zaključio da vrenje katalizuje materija unutar gljivica, koju je nazvao „ferment“.[177] Dalje je zaključio da je alkoholno vrenje proces povezan za životom ćelija gljivica, a ne sa smrću ćelija. To otkriće, zajedno s radom Fridriha Velera iz 1828. godine o hemijskoj sintezi uree,[178] dokazalo je da se organska jedinjenja i hemijske reakcije iz ćelija ne razlikuju u svojim načelima od ostale materije.
Izučavanje načina na koji ljudi transformišu supstance koje su progutali ili na neki drugi način uneli u telo je započelo u sredinom devetnaestog veka, sa otkrićem da organski molekuli kao što je benzaldehid mogu da budu oksidovani i konjugovani do aminokiselina u ljudskom telu.[179] Tokom ostatka devetnaestog veka, nekoliko drugih osnovih reakcija detoksifikacije je otkriveno, kao što su metilacija, acetilacija, i sulfonacija.
Otkriće enzima na početku 20. veka (Eduard Buhner) odvojilo je istraživanje hemijskih reakcija metabolizma od biološkog istraživanja ćelije i označilo nastanak biohemije.[180] U brojnim otkrićima na području biohemije u prvoj polovini 20. veka, posebno se ističe ono Hansa Krebsa, koji je napravio ogromne doprinose izučavanju metabolizma.[181] On je otkrio ciklus uree[182] i kasnije, radeći sa Hansom Kornbergom, ciklus limunske kiseline i ciklus glioksilata.[54][183][184] Moderna biohemijska istraživanja su značajno napredovala upotrebom novih tehnika hromatografije, difrakcije x-zraka, NMR spektroskopije, radioizotopnog označavanja, elektronske mikroskopije i molekularno dinamičkih simulacija. Ove tehnike su omogućile otkriće i detaljnu analizu mnogih molekula i metaboličkih puteva u ćelijama.
U ranom dvadesetom veku, rad je prešao na ispitivanje enzima i puteva koji su odgovorni za proizvodnju ovih metabolita. Ovo polje je postalo definisano kao posebna oblast studiranja sa objavljivanjem knjige Ričarda Vilijama Detoksikacioni mehanizmi 1947. godine.[185] Ova moderna biohemijska istraživanja rezultirala su u identifikaciji glutation S-transferaza 1961. godine,[186] čemu su sledila otkrića citohroma P450 u 1962. godine,[187] i poimanje njihove centralne uloge u ksenobiotičkom metabolizmu 1963. godine.[188][189]
Vidi još
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Voet D, Voet J (1995). Biochemistry (2 izd.). Wiley.
- ^ a b Friedrich, C. (1998). „Physiology and genetics of sulfur-oxidizing bacteria”. Adv Microb Physiol. Advances in Microbial Physiology. 39: 235—89. ISBN 9780120277391. PMID 9328649. doi:10.1016/S0065-2911(08)60018-1.
- ^ Pace, N. R. (2001). „The universal nature of biochemistry”. Proc. Natl. Acad. Sci. U.S.A. 98 (3): 805—8. Bibcode:2001PNAS...98..805P. PMC 33372
 . PMID 11158550. doi:10.1073/pnas.98.3.805.
. PMID 11158550. doi:10.1073/pnas.98.3.805.
- ^ a b Smith E, Morowitz H (2004). „Universality in intermediary metabolism”. Proc Natl Acad Sci USA. 101 (36): 13168—73. Bibcode:2004PNAS..10113168S. PMC 516543
 . PMID 15340153. doi:10.1073/pnas.0404922101.
. PMID 15340153. doi:10.1073/pnas.0404922101.
- ^ a b Ebenhöh O, Heinrich R (2001). „Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems”. Bull Math Biol. 63 (1): 21—55. PMID 11146883. doi:10.1006/bulm.2000.0197.
- ^ a b Meléndez-Hevia E, Waddell T, Cascante M (1996). „The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution”. J Mol Evol. 43 (3): 293—303. PMID 8703096. doi:10.1007/BF02338838.
- ^ Michie K, Löwe J (2006). „Dynamic filaments of the bacterial cytoskeleton”. Annu Rev Biochem. 75: 467—92. PMID 16756499. doi:10.1146/annurev.biochem.75.103004.142452.
- ^ a b v g d Nelson & Cox 2005, str. 841
- ^ Kelleher J, Bryan 3rd B, Mallet R, Holleran A, Murphy A, Fiskum G (1987). „Analysis of tricarboxylic acid-cycle metabolism of hepatoma cells by comparison of 14CO2 ratios”. Biochem J. 246 (3): 633—639. PMC 346906
 . PMID 6752947.
. PMID 6752947.
- ^ Hothersall J, Ahmed A (2013). „Metabolic fate of the increased yeast amino acid uptake subsequent to catabolite derepression”. J Amino Acids. 2013: e461901. PMC 3575661
 . PMID 23431419. doi:10.1155/2013/461901.
. PMID 23431419. doi:10.1155/2013/461901.
- ^ Fahy E, Subramaniam S, Brown H, Glass C, Merrill A, Murphy R, Raetz C, Russell D, Seyama Y, Shaw W, Shimizu T, Spener F, van Meer G, VanNieuwenhze M, White S, Witztum J, Dennis E (2005). „A comprehensive classification system for lipids”. J Lipid Res. 46 (5): 839—61. PMID 15722563. doi:10.1194/jlr.E400004-JLR200. Arhivirano iz originala 24. 08. 2010. g. Pristupljeno 13. 04. 2017.
- ^ „Nomenclature of Lipids”. IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Pristupljeno 8. 3. 2007.
- ^ Hegardt, F. (1999). „Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis”. Biochem J. 338 (Pt 3): 569—82. PMC 1220089
 . PMID 10051425. doi:10.1042/0264-6021:3380569.
. PMID 10051425. doi:10.1042/0264-6021:3380569.
- ^ Raman R, Raguram S, Venkataraman G, Paulson J, Sasisekharan R (2005). „Glycomics: an integrated systems approach to structure-function relationships of glycans”. Nat Methods. 2 (11): 817—24. PMID 16278650. doi:10.1038/nmeth807.
- ^ Sierra S, Kupfer B, Kaiser R (2005). „Basics of the virology of HIV-1 and its replication”. J Clin Virol. 34 (4): 233—44. PMID 16198625. doi:10.1016/j.jcv.2005.09.004.
- ^ a b Wimmer M, Rose I (1978). „Mechanisms of enzyme-catalyzed group transfer reactions”. Annu Rev Biochem. 47: 1031—78. PMID 354490. doi:10.1146/annurev.bi.47.070178.005123.
- ^ Mitchell, P. (1979). „The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems”. Eur J Biochem. 95 (1): 1—20. PMID 378655. doi:10.1111/j.1432-1033.1979.tb12934.x.
- ^ a b v g Dimroth P, von Ballmoos C, Meier T (2006). „Catalytic and mechanical cycles in F-ATP synthases: Fourth in the Cycles Review Series”. EMBO Rep. 7 (3): 276—82. PMC 1456893
 . PMID 16607397. doi:10.1038/sj.embor.7400646.
. PMID 16607397. doi:10.1038/sj.embor.7400646.
- ^ Coulston, Kerner & Hattner 2006
- ^ Pollak N, Dölle C, Ziegler M (2007). „The power to reduce: pyridine nucleotides – small molecules with a multitude of functions”. Biochem J. 402 (2): 205—18. PMC 1798440
 . PMID 17295611. doi:10.1042/BJ20061638.
. PMID 17295611. doi:10.1042/BJ20061638.
- ^ a b Heymsfield S, Waki M, Kehayias J, Lichtman S, Dilmanian F, Kamen Y, Wang J, Pierson R (1991). „Chemical and elemental analysis of humans in vivo using improved body composition models”. Am J Physiol. 261 (2 Pt 1): E190—8. PMID 1872381.
- ^ Sychrová, H. (2004). „Yeast as a model organism to study transport and homeostasis of alkali metal cations” (PDF). Physiol Res. 53 Suppl 1: S91—8. PMID 15119939.
- ^ Levitan, I. (1988). „Modulation of ion channels in neurons and other cells”. Annu Rev Neurosci. 11: 119—36. PMID 2452594. doi:10.1146/annurev.ne.11.030188.001003.
- ^ Dulhunty, A. (2006). „Excitation-contraction coupling from the 1950s into the new millennium”. Clin Exp Pharmacol Physiol. 33 (9): 763—72. PMID 16922804. doi:10.1111/j.1440-1681.2006.04441.x.
- ^ Mahan D, Shields R (1998). „Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight”. J Anim Sci. 76 (2): 506—12. PMID 9498359.
- ^ Husted S, Mikkelsen B, Jensen J, Nielsen N (2004). „Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics”. Anal Bioanal Chem. 378 (1): 171—82. PMID 14551660. doi:10.1007/s00216-003-2219-0.
- ^ Finney L, O'Halloran T (2003). „Transition metal speciation in the cell: insights from the chemistry of metal ion receptors”. Science. 300 (5621): 931—6. Bibcode:2003Sci...300..931F. PMID 12738850. doi:10.1126/science.1085049.
- ^ Cousins R, Liuzzi J, Lichten L (2006). „Mammalian zinc transport, trafficking, and signals”. J Biol Chem. 281 (34): 24085—9. PMID 16793761. doi:10.1074/jbc.R600011200. Arhivirano iz originala 05. 11. 2008. g. Pristupljeno 13. 04. 2017.
- ^ Dunn L, Rahmanto Y, Richardson D (2007). „Iron uptake and metabolism in the new millennium”. Trends Cell Biol. 17 (2): 93—100. PMID 17194590. doi:10.1016/j.tcb.2006.12.003.
- ^ „Metabolizam i faktori koji utiču na brzinu metabolizma - Dijeta.net”. Dijeta.net (na jeziku: srpski). 4. 9. 2016. Pristupljeno 1. 3. 2018.
- ^ Nealson K, Conrad P (1999). „Life: past, present and future”. Philos Trans R Soc Lond B Biol Sci. 354 (1392): 1923—39. PMC 1692713
 . PMID 10670014. doi:10.1098/rstb.1999.0532.
. PMID 10670014. doi:10.1098/rstb.1999.0532.
- ^ a b Nelson N, Ben-Shem A (2004). „The complex architecture of oxygenic photosynthesis”. Nat Rev Mol Cell Biol. 5 (12): 971—82. PMID 15573135. doi:10.1038/nrm1525.
- ^ Häse C, Finkelstein R (1993). „Bacterial extracellular zinc-containing metalloproteases”. Microbiol Rev. 57 (4): 823—37. PMC 372940
 . PMID 8302217.
. PMID 8302217.
- ^ Gupta R, Gupta N, Rathi P (2004). „Bacterial lipases: an overview of production, purification and biochemical properties”. Appl Microbiol Biotechnol. 64 (6): 763—81. PMID 14966663. doi:10.1007/s00253-004-1568-8.
- ^ Hoyle, T. (1997). „The digestive system: linking theory and practice”. Br J Nurs. 6 (22): 1285—91. PMID 9470654.
- ^ Souba W, Pacitti A (1992). „How amino acids get into cells: mechanisms, models, menus, and mediators”. JPEN J Parenter Enteral Nutr. 16 (6): 569—78. PMID 1494216. doi:10.1177/0148607192016006569.
- ^ Barrett M, Walmsley A, Gould G (1999). „Structure and function of facilitative sugar transporters”. Curr Opin Cell Biol. 11 (4): 496—502. PMID 10449337. doi:10.1016/S0955-0674(99)80072-6.
- ^ Bell G, Burant C, Takeda J, Gould G (1993). „Structure and function of mammalian facilitative sugar transporters”. J Biol Chem. 268 (26): 19161—4. PMID 8366068.
- ^ a b Bouché C, Serdy S, Kahn C, Goldfine A (2004). „The cellular fate of glucose and its relevance in type 2 diabetes”. Endocr Rev. 25 (5): 807—30. PMID 15466941. doi:10.1210/er.2003-0026. Arhivirano iz originala 04. 12. 2012. g. Pristupljeno 05. 04. 2018.
- ^ Wipperman, Matthew, F.; Thomas, Suzanne, T.; Sampson, Nicole, S. (2014). „Pathogen roid rage: Cholesterol utilization by Mycobacterium tuberculosis”. Crit. Rev. Biochem. Mol. Biol. 49 (4): 269—93. PMC 4255906
 . PMID 24611808. doi:10.3109/10409238.2014.895700.
. PMID 24611808. doi:10.3109/10409238.2014.895700.
- ^ Sakami W, Harrington H (1963). „Amino acid metabolism”. Annu Rev Biochem. 32: 355—98. PMID 14144484. doi:10.1146/annurev.bi.32.070163.002035.
- ^ Brosnan, J. (2000). „Glutamate, at the interface between amino acid and carbohydrate metabolism”. J Nutr. 130 (4S Suppl): 988S—90S. PMID 10736367.
- ^ Young V, Ajami A (2001). „Glutamine: the emperor or his clothes?”. J Nutr. 131 (9 Suppl): 2449S—59S; discussion 2486S—7S. PMID 11533293.
- ^ Miziorko H, Lorimer G (1983). „Ribulose-1,5-bisphosphate carboxylase-oxygenase”. Annu Rev Biochem. 52: 507—35. PMID 6351728. doi:10.1146/annurev.bi.52.070183.002451.
- ^ Dodd A, Borland A, Haslam R, Griffiths H, Maxwell K (2002). „Crassulacean acid metabolism: plastic, fantastic”. J Exp Bot. 53 (369): 569—80. PMID 11886877. doi:10.1093/jexbot/53.369.569.
- ^ Hügler M, Wirsen C, Fuchs G, Taylor C, Sievert S (2005). „Evidence for Autotrophic CO2 Fixation via the Reductive Tricarboxylic Acid Cycle by Members of the ɛ Subdivision of Proteobacteria”. J Bacteriol. 187 (9): 3020—7. PMC 1082812
 . PMID 15838028. doi:10.1128/JB.187.9.3020-3027.2005.
. PMID 15838028. doi:10.1128/JB.187.9.3020-3027.2005.
- ^ Strauss G, Fuchs G (1993). „Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle”. Eur J Biochem. 215 (3): 633—43. PMID 8354269. doi:10.1111/j.1432-1033.1993.tb18074.x.
- ^ Wood, H. (1991). „Life with CO or CO2 and H2 as a source of carbon and energy”. FASEB J. 5 (2): 156—63. PMID 1900793.
- ^ Shively J, van Keulen G, Meijer W (1998). „Something from almost nothing: carbon dioxide fixation in chemoautotrophs”. Annu Rev Microbiol. 52: 191—230. PMID 9891798. doi:10.1146/annurev.micro.52.1.191.
- ^ Boiteux A, Hess B (1981). „Design of glycolysis”. Philos Trans R Soc Lond B Biol Sci. 293 (1063): 5—22. Bibcode:1981RSPTB.293....5B. PMID 6115423. doi:10.1098/rstb.1981.0056.
- ^ Pilkis S, el-Maghrabi M, Claus T (1990). „Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics”. Diabetes Care. 13 (6): 582—99. PMID 2162755. doi:10.2337/diacare.13.6.582.
- ^ a b Ensign, S. (2006). „Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation”. Mol Microbiol. 61 (2): 274—6. PMID 16856935. doi:10.1111/j.1365-2958.2006.05247.x.
- ^ Finn P, Dice J (2006). „Proteolytic and lipolytic responses to starvation”. Nutrition. 22 (7–8): 830—44. PMID 16815497. doi:10.1016/j.nut.2006.04.008.
- ^ a b Kornberg H, Krebs H (1957). „Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle”. Nature. 179 (4568): 988—91. Bibcode:1957Natur.179..988K. PMID 13430766. doi:10.1038/179988a0.
- ^ Rademacher T, Parekh R, Dwek R (1988). „Glycobiology”. Annu Rev Biochem. 57: 785—838. PMID 3052290. doi:10.1146/annurev.bi.57.070188.004033.
- ^ Opdenakker G, Rudd P, Ponting C, Dwek R (1993). „Concepts and principles of glycobiology”. FASEB J. 7 (14): 1330—7. PMID 8224606.
- ^ McConville M, Menon A (2000). „Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review)”. Mol Membr Biol. 17 (1): 1—16. PMID 10824734. doi:10.1080/096876800294443.
- ^ Chirala S, Wakil S (2004). „Structure and function of animal fatty acid synthase”. Lipids. 39 (11): 1045—53. PMID 15726818. doi:10.1007/s11745-004-1329-9.
- ^ White S, Zheng J, Zhang Y (2005). „The structural biology of type II fatty acid biosynthesis”. Annu Rev Biochem. 74: 791—831. PMID 15952903. doi:10.1146/annurev.biochem.74.082803.133524.
- ^ Ohlrogge J, Jaworski J (1997). „Regulation of fatty acid synthesis”. Annu Rev Plant Physiol Plant Mol Biol. 48: 109—136. PMID 15012259. doi:10.1146/annurev.arplant.48.1.109.
- ^ Dubey V, Bhalla R, Luthra R (2003). „An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants” (PDF). J Biosci. 28 (5): 637—46. PMID 14517367. doi:10.1007/BF02703339. Arhivirano iz originala (PDF) 15. 4. 2007. g.
- ^ a b Kuzuyama T, Seto H (2003). „Diversity of the biosynthesis of the isoprene units”. Nat Prod Rep. 20 (2): 171—83. PMID 12735695. doi:10.1039/b109860h.
- ^ Grochowski L, Xu H, White R (2006). „Methanocaldococcus jannaschii Uses a Modified Mevalonate Pathway for Biosynthesis of Isopentenyl Diphosphate”. J Bacteriol. 188 (9): 3192—8. PMC 1447442
 . PMID 16621811. doi:10.1128/JB.188.9.3192-3198.2006.
. PMID 16621811. doi:10.1128/JB.188.9.3192-3198.2006.
- ^ Lichtenthaler, H. (1999). „The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants”. Annu Rev Plant Physiol Plant Mol Biol. 50: 47—65. PMID 15012203. doi:10.1146/annurev.arplant.50.1.47.
- ^ a b Schroepfer, G. (1981). „Sterol biosynthesis”. Annu Rev Biochem. 50: 585—621. PMID 7023367. doi:10.1146/annurev.bi.50.070181.003101.
- ^ Lees N, Skaggs B, Kirsch D, Bard M (1995). „Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review”. Lipids. 30 (3): 221—6. PMID 7791529. doi:10.1007/BF02537824.
- ^ Himmelreich R, Hilbert H, Plagens H, Pirkl E, Li BC, Herrmann R (1996). „Complete sequence analysis of the genome of the bacterium Mycoplasma pneumoniae”. Nucleic Acids Res. 24 (22): 4420—49. PMC 146264
 . PMID 8948633. doi:10.1093/nar/24.22.4420.
. PMID 8948633. doi:10.1093/nar/24.22.4420.
- ^ Guyton & Hall 2006, str. 855–6
- ^ Ibba M, Söll D (2001). „The renaissance of aminoacyl-tRNA synthesis”. EMBO Rep. 2 (5): 382—7. PMC 1083889
 . PMID 11375928. doi:10.1093/embo-reports/kve095. Arhivirano iz originala 1. 5. 2011. g.
. PMID 11375928. doi:10.1093/embo-reports/kve095. Arhivirano iz originala 1. 5. 2011. g.
- ^ Lengyel P, Söll D (1969). „Mechanism of protein biosynthesis”. Bacteriol Rev. 33 (2): 264—301. PMC 378322
 . PMID 4896351.
. PMID 4896351.
- ^ a b Rudolph, F. (1994). „The biochemistry and physiology of nucleotides”. J Nutr. 124 (1 Suppl): 124S—127S. PMID 8283301. Zrenner R, Stitt M, Sonnewald U, Boldt R (2006). „Pyrimidine and purine biosynthesis and degradation in plants”. Annu Rev Plant Biol. 57: 805—36. PMID 16669783. doi:10.1146/annurev.arplant.57.032905.105421.
- ^ Stasolla C, Katahira R, Thorpe T, Ashihara H (2003). „Purine and pyrimidine nucleotide metabolism in higher plants”. J Plant Physiol. 160 (11): 1271—95. PMID 14658380. doi:10.1078/0176-1617-01169.
- ^ Davies O, Mendes P, Smallbone K, Malys N (2012). „Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism”. BMB Reports. 45 (4): 259—64. PMID 22531138. doi:10.5483/BMBRep.2012.45.4.259.
- ^ Smith, J. (1995). „Enzymes of nucleotide synthesis”. Curr Opin Struct Biol. 5 (6): 752—7. PMID 8749362. doi:10.1016/0959-440X(95)80007-7.
- ^ Capaldi R, Aggeler R (2002). „Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor”. Trends Biochem Sci. 27 (3): 154—60. PMID 11893513. doi:10.1016/S0968-0004(01)02051-5.
- ^ Hosler J, Ferguson-Miller S, Mills D (2006). „Energy Transduction: Proton Transfer Through the Respiratory Complexes”. Annu Rev Biochem. 75: 165—87. PMC 2659341
 . PMID 16756489. doi:10.1146/annurev.biochem.75.062003.101730.
. PMID 16756489. doi:10.1146/annurev.biochem.75.062003.101730.
- ^ Schultz B, Chan S (2001). „Structures and proton-pumping strategies of mitochondrial respiratory enzymes”. Annu Rev Biophys Biomol Struct. 30: 23—65. PMID 11340051. doi:10.1146/annurev.biophys.30.1.23.
- ^ Friedrich B, Schwartz E (1993). „Molecular biology of hydrogen utilization in aerobic chemolithotrophs”. Annu Rev Microbiol. 47: 351—83. PMID 8257102. doi:10.1146/annurev.mi.47.100193.002031.
- ^ Weber K, Achenbach L, Coates J (2006). „Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction”. Nat Rev Microbiol. 4 (10): 752—64. PMID 16980937. doi:10.1038/nrmicro1490.
- ^ Jetten M, Strous M, van de Pas-Schoonen K, Schalk J, van Dongen U, van de Graaf A, Logemann S, Muyzer G, van Loosdrecht M, Kuenen J (1998). „The anaerobic oxidation of ammonium”. FEMS Microbiol Rev. 22 (5): 421—37. PMID 9990725. doi:10.1111/j.1574-6976.1998.tb00379.x.
- ^ Simon, J. (2002). „Enzymology and bioenergetics of respiratory nitrite ammonification”. FEMS Microbiol Rev. 26 (3): 285—309. PMID 12165429. doi:10.1111/j.1574-6976.2002.tb00616.x.
- ^ Conrad, R. (1996). „Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)”. Microbiol Rev. 60 (4): 609—40. PMC 239458
 . PMID 8987358.
. PMID 8987358.
- ^ Barea J, Pozo M, Azcón R, Azcón-Aguilar C (2005). „Microbial co-operation in the rhizosphere”. J Exp Bot. 56 (417): 1761—78. PMID 15911555. doi:10.1093/jxb/eri197.
- ^ D.A. Bryant & N.-U. Frigaard (2006). „Prokaryotic photosynthesis and phototrophy illuminated”. Trends Microbiol. 14 (11): 488—96. PMID 16997562. doi:10.1016/j.tim.2006.09.001.
- ^ Tsygankov, A. A.; Khusnutdinova, A. N. (2015). „Hydrogen in metabolism of purple bacteria and prospects of practical application”. Microbiology. 84 (1): 1—22. doi:10.1134/S0026261715010154. Pristupljeno 8. 10. 2017.
- ^ Green BR (2003). Light-Harvesting Antennas in Photosynthesis. str. 8. ISBN 978-0-7923-6335-4.
- ^ Sakurai H, Ogawa T, Shiga M, Inoue K (2010). „Inorganic sulfur oxidizing system in green sulfur bacteria”. Photosynthesis Research. 104 (2–3): 163—76. PMID 20143161. doi:10.1007/s11120-010-9531-2.
- ^ van der Meer M, Schouten S, Bateson M, Nübel U, Wieland A, Kühl M, de Leeuw J, Sinninghe Damsté J, Ward D (2005). „Diel Variations in Carbon Metabolism by Green Nonsulfur-Like Bacteria in Alkaline Siliceous Hot Spring Microbial Mats from Yellowstone National Park”. Appl Environ Microbiol. 71 (7): 3978—86. PMC 1168979
 . PMID 16000812. doi:10.1128/AEM.71.7.3978-3986.2005.
. PMID 16000812. doi:10.1128/AEM.71.7.3978-3986.2005.
- ^ Tichi M, Tabita F (2001). „Interactive Control of Rhodobacter capsulatus Redox-Balancing Systems during Phototrophic Metabolism”. J Bacteriol. 183 (21): 6344—54. PMC 100130
 . PMID 11591679. doi:10.1128/JB.183.21.6344-6354.2001.
. PMID 11591679. doi:10.1128/JB.183.21.6344-6354.2001.
- ^ Allen J, Williams J (1998). „Photosynthetic reaction centers”. FEBS Lett. 438 (1–2): 5—9. PMID 9821949. doi:10.1016/S0014-5793(98)01245-9.
- ^ Munekage Y, Hashimoto M, Miyake C, Tomizawa K, Endo T, Tasaka M, Shikanai T (2004). „Cyclic electron flow around photosystem I is essential for photosynthesis”. Nature. 429 (6991): 579—82. Bibcode:2004Natur.429..579M. PMID 15175756. doi:10.1038/nature02598.
- ^ Carroll & Salt 2004, str. 93
- ^ Kuypers, MMM; Marchant, HK; Kartal, B (2011). „The Microbial Nitrogen-Cycling Network”. Nature Reviews Microbiology. 1 (1): 1—14. PMID 29398704. doi:10.1038/nrmicro.2018.9.
- ^ Galloway, J. N.; et al. (2004). „Nitrogen cycles: past, present, and future generations”. Biogeochemistry. 70: 153—226. doi:10.1007/s10533-004-0370-0.
- ^ Sigel, Sigel & Sigel 2007, str. 561–97
- ^ Nelson, D. „Cytochrome P450 Homepage”. University of Tennessee. Arhivirano iz originala 27. 06. 2010. g. Pristupljeno 13. 11. 2014.
- ^ Habig WH, Pabst MJ, Jakoby WB (1974). „Glutathione S-transferases. The first enzymatic step in mercapturic acid formation”. J. Biol. Chem. 249: 7130—7139. PMID 4436300.
- ^ Jakoby, W.B. (1978). „The glutathione S-transferases: a group of multifunctional detoxification proteins”. Adv. Enzymol. Relat. Areas Mol. Biol. 46: 383—383. PMID 345769.
- ^ Jakoby, W.B. (1985). „Glutathione transferases: an overview”. Methods Enzymol. 113: 495—499. PMID 4088070.
- ^ Keen, J.H. & Jakoby, W.B. (1978). „Glutathione transferases. Catalysis of nucleophilic reactions of glutathione”. J. Biol. Chem. 253: 5654—5657. PMID 670218.
- ^ Sheehan D, Meade G, Foley VM, Dowd CA (2001). „Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily”. Biochem. J. 360: 1—16. PMID 11695986.
- ^ PDB: 1R5A; Udomsinprasert R, Pongjaroenkit S, Wongsantichon J, Oakley AJ, Prapanthadara LA, Wilce MC, Ketterman AJ (2005). „Identification, characterization and structure of a new Delta class glutathione transferase isoenzyme”. Biochem. J. 388 (Pt 3): 763—71. PMC 1183455
 . PMID 15717864. doi:10.1042/BJ20042015.
. PMID 15717864. doi:10.1042/BJ20042015.
- ^ „Toxicology Primer”. UIC. Arhivirano iz originala 31. 10. 2013. g. Pristupljeno 21. 4. 2013.
- ^ Testa B, Krämer S (2006). „The biochemistry of drug metabolism—an introduction: part 1. Principles and overview”. Chem Biodivers. 3 (10): 1053—101. PMID 17193224. doi:10.1002/cbdv.200690111.
- ^ Danielson, P. (2002). „The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans”. Curr Drug Metab. 3 (6): 561—97. PMID 12369887. doi:10.2174/1389200023337054.
- ^ King C, Rios G, Green M, Tephly T (2000). „UDP-glucuronosyltransferases”. Curr Drug Metab. 1 (2): 143—61. PMID 11465080. doi:10.2174/1389200003339171.
- ^ Sheehan D, Meade G, Foley V, Dowd C (2001). „Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily”. Biochem J. 360 (Pt 1): 1—16. PMC 1222196
 . PMID 11695986. doi:10.1042/0264-6021:3600001.
. PMID 11695986. doi:10.1042/0264-6021:3600001.
- ^ Galvão T, Mohn W, de Lorenzo V (2005). „Exploring the microbial biodegradation and biotransformation gene pool”. Trends Biotechnol. 23 (10): 497—506. PMID 16125262. doi:10.1016/j.tibtech.2005.08.002.
- ^ Janssen D, Dinkla I, Poelarends G, Terpstra P (2005). „Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities”. Environ Microbiol. 7 (12): 1868—82. PMID 16309386. doi:10.1111/j.1462-2920.2005.00966.x.
- ^ Davies, K. (1995). „Oxidative stress: the paradox of aerobic life”. Biochem Soc Symp. 61: 1—31. PMID 8660387. doi:10.1042/bss0610001.
- ^ Tu B, Weissman J (2004). „Oxidative protein folding in eukaryotes: mechanisms and consequences”. J Cell Biol. 164 (3): 341—6. PMC 2172237
 . PMID 14757749. doi:10.1083/jcb.200311055.
. PMID 14757749. doi:10.1083/jcb.200311055.
- ^ Sies, H. (1997). „Oxidative stress: oxidants and antioxidants” (PDF). Exp Physiol. 82 (2): 291—5. PMID 9129943. doi:10.1113/expphysiol.1997.sp004024. Arhivirano iz originala (PDF) 25. 03. 2009. g. Pristupljeno 07. 04. 2018.
- ^ Vertuani S, Angusti A, Manfredini S (2004). „The antioxidants and pro-antioxidants network: an overview”. Curr Pharm Des. 10 (14): 1677—94. PMID 15134565. doi:10.2174/1381612043384655.
- ^ a b v Jakoby WB, Ziegler DM (1990). „The enzymes of detoxication”. J. Biol. Chem. 265 (34): 20715—8. PMID 2249981. Arhivirano iz originala 21. 06. 2009. g. Pristupljeno 11. 04. 2018.
- ^ Mizuno N, Niwa T, Yotsumoto Y, Sugiyama Y (2003). „Impact of drug transporter studies on drug discovery and development”. Pharmacol. Rev. 55 (3): 425—61. PMID 12869659. doi:10.1124/pr.55.3.1.
- ^ a b Thornalley, P. J. (1990). „The glyoxalase system: new developments towards functional characterization of a metabolic pathway fundamental to biological life”. Biochem. J. 269 (1): 1—11. PMC 1131522
 . PMID 2198020.
. PMID 2198020.
- ^ a b Sies, H. (1997). „Oxidative stress: oxidants and antioxidants” (PDF). Exp. Physiol. 82 (2): 291—5. PMID 9129943. doi:10.1113/expphysiol.1997.sp004024. Arhivirano iz originala (PDF) 25. 03. 2009. g. Pristupljeno 07. 04. 2018.
- ^ Guengerich, F. P. (2001). „Common and uncommon cytochrome P450 reactions related to metabolism and chemical toxicity”. Chem. Res. Toxicol. 14 (6): 611—50. PMID 11409933. doi:10.1021/tx0002583.
- ^ Schlichting I, Berendzen J, Chu K, Stock AM, Maves SA, Benson DE, Sweet RM, Ringe D, Petsko GA, Sligar SG (2000). „The catalytic pathway of cytochrome p450cam at atomic resolution”. Science. 287 (5458): 1615—22. Bibcode:2000Sci...287.1615S. PMID 10698731. doi:10.1126/science.287.5458.1615.
- ^ „Acetonitrile (EHC 154, 1993)”. www.inchem.org. Pristupljeno 3. 5. 2017.
- ^ Akagah B, Lormier AT, Fournet A, Figadère B (2008). „Oxidation of antiparasitic 2-substituted quinolines using metalloporphyrin catalysts: scale-up of a biomimetic reaction for metabolite production of drug candidates”. Org. Biomol. Chem. 6 (24): 4494—7. PMID 19039354. doi:10.1039/b815963g.
- ^ a b v g d Liston HL, Markowitz JS, DeVane CL (2001). „Drug glucuronidation in clinical psychopharmacology”. J Clin Psychopharmacol. 21 (5): 500—15. PMID 11593076. doi:10.1097/00004714-200110000-00008.
- ^ Badenhorst CP, van der Sluis R, Erasmus E, van Dijk AA (2013). „Glycine conjugation: importance in metabolism, the role of glycine N-acyltransferase, and factors that influence interindividual variation”. Expert Opinion on Drug Metabolism & Toxicology. 9 (9): 1139—1153. PMID 23650932. doi:10.1517/17425255.2013.796929.
- ^ Boyland E, Chasseaud LF (1969). „The role of glutathione and glutathione S-transferases in mercapturic acid biosynthesis”. Adv. Enzymol. Relat. Areas Mol. Biol. Advances in Enzymology – and Related Areas of Molecular Biology. 32: 173—219. ISBN 9780470122778. PMID 4892500. doi:10.1002/9780470122778.ch5.
- ^ Homolya L, Váradi A, Sarkadi B (2003). „Multidrug resistance-associated proteins: Export pumps for conjugates with glutathione, glucuronate or sulfate”. BioFactors. 17 (1–4): 103—14. PMID 12897433. doi:10.1002/biof.5520170111.
- ^ König J, Nies AT, Cui Y, Leier I, Keppler D (1999). „Conjugate export pumps of the multidrug resistance protein (MRP) family: localization, substrate specificity, and MRP2-mediated drug resistance”. Biochim. Biophys. Acta. 1461 (2): 377—94. PMID 10581368. doi:10.1016/S0005-2736(99)00169-8.
- ^ Commandeur JN, Stijntjes GJ, Vermeulen NP (1995). „Enzymes and transport systems involved in the formation and disposition of glutathione S-conjugates. Role in bioactivation and detoxication mechanisms of xenobiotics”. Pharmacol. Rev. 47 (2): 271—330. PMID 7568330.
- ^ Rostami-Hodjegan A, Tucker GT (2007). „Simulation and prediction of in vivo drug metabolism in human populations from in vitro data”. Nat Rev Drug Discov. 6 (2): 140—8. PMID 17268485. doi:10.1038/nrd2173.
- ^ von Stockar U, Liu J (1999). „Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth”. Biochim Biophys Acta. 1412 (3): 191—211. PMID 10482783. doi:10.1016/S0005-2728(99)00065-1.
- ^ Demirel Y, Sandler S (2002). „Thermodynamics and bioenergetics”. Biophys Chem. 97 (2–3): 87—111. PMID 12050002. doi:10.1016/S0301-4622(02)00069-8.
- ^ M.J. Farabee. „Reactions and Enzymes”. On-Line Biology Book. Estrella Mountain Community College. Arhivirano iz originala 28. 12. 2012. g. Pristupljeno 12. 04. 2018.
- ^ Haynie 2001, str. 1–16
- ^ Albert, R. (2005). „Scale-free networks in cell biology”. J Cell Sci. 118 (Pt 21): 4947—57. PMID 16254242. doi:10.1242/jcs.02714.
- ^ Brand, M. (1997). „Regulation analysis of energy metabolism”. J Exp Biol. 200 (Pt 2): 193—202. PMID 9050227.
- ^ Soyer O, Salathé M, Bonhoeffer S (2006). „Signal transduction networks: topology, response and biochemical processes”. J Theor Biol. 238 (2): 416—25. PMID 16045939. doi:10.1016/j.jtbi.2005.05.030.
- ^ a b Salter M, Knowles R, Pogson C (1994). „Metabolic control”. Essays Biochem. 28: 1—12. PMID 7925313.
- ^ Westerhoff H, Groen A, Wanders R (1984). „Modern theories of metabolic control and their applications (review)”. Biosci Rep. 4 (1): 1—22. PMID 6365197. doi:10.1007/BF01120819.
- ^ Fell D, Thomas S (1995). „Physiological control of metabolic flux: the requirement for multisite modulation”. Biochem J. 311 (Pt 1): 35—9. PMC 1136115
 . PMID 7575476.
. PMID 7575476.
- ^ Hendrickson, W. (2005). „Transduction of biochemical signals across cell membranes”. Q Rev Biophys. 38 (4): 321—30. PMID 16600054. doi:10.1017/S0033583506004136.
- ^ Cohen, P. (2000). „The regulation of protein function by multisite phosphorylation—a 25 year update”. Trends Biochem Sci. 25 (12): 596—601. PMID 11116185. doi:10.1016/S0968-0004(00)01712-6.
- ^ Lienhard G, Slot J, James D, Mueckler M (1992). „How cells absorb glucose”. Sci Am. 266 (1): 86—91. PMID 1734513. doi:10.1038/scientificamerican0192-86.
- ^ Roach, P. (2002). „Glycogen and its metabolism”. Curr Mol Med. 2 (2): 101—20. PMID 11949930. doi:10.2174/1566524024605761.
- ^ Newgard C, Brady M, O'Doherty R, Saltiel A (2000). „Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1” (PDF). Diabetes. 49 (12): 1967—77. PMID 11117996. doi:10.2337/diabetes.49.12.1967.
- ^ a b Nelson, DL; Cox, MM (2009). Lehninger: Principios de bioquímica (5th izd.). Barcelona: Omega. str. 220–228. ISBN 978-84-282-1486-5.
- ^ Copley, SD (2012). „Moonlighting is Mainstream: Paradigm Adjustment Required”. BioEssays. 34 (7): 578—588. PMID 22696112. doi:10.1002/bies.201100191.
- ^ Romano A, Conway T (1996). „Evolution of carbohydrate metabolic pathways”. Res Microbiol. 147 (6–7): 448—55. PMID 9084754. doi:10.1016/0923-2508(96)83998-2.
- ^ Koch, A. (1998). „How did bacteria come to be?”. Adv Microb Physiol. Advances in Microbial Physiology. 40: 353—99. ISBN 978-0-12-027740-7. PMID 9889982. doi:10.1016/S0065-2911(08)60135-6.
- ^ Ouzounis C, Kyrpides N (1996). „The emergence of major cellular processes in evolution”. FEBS Lett. 390 (2): 119—23. PMID 8706840. doi:10.1016/0014-5793(96)00631-X.
- ^ Caetano-Anolles G, Kim HS, Mittenthal JE (2007). „The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture”. Proc Natl Acad Sci USA. 104 (22): 9358—63. Bibcode:2007PNAS..104.9358C. PMC 1890499
 . PMID 17517598. doi:10.1073/pnas.0701214104.
. PMID 17517598. doi:10.1073/pnas.0701214104.
- ^ Schmidt S, Sunyaev S, Bork P, Dandekar T (2003). „Metabolites: a helping hand for pathway evolution?”. Trends Biochem Sci. 28 (6): 336—41. PMID 12826406. doi:10.1016/S0968-0004(03)00114-2.
- ^ Light S, Kraulis P (2004). „Network analysis of metabolic enzyme evolution in Escherichia coli”. BMC Bioinformatics. 5: 15. PMC 394313
 . PMID 15113413. doi:10.1186/1471-2105-5-15. Alves R, Chaleil R, Sternberg M (2002). „Evolution of enzymes in metabolism: a network perspective”. J Mol Biol. 320 (4): 751—70. PMID 12095253. doi:10.1016/S0022-2836(02)00546-6.
. PMID 15113413. doi:10.1186/1471-2105-5-15. Alves R, Chaleil R, Sternberg M (2002). „Evolution of enzymes in metabolism: a network perspective”. J Mol Biol. 320 (4): 751—70. PMID 12095253. doi:10.1016/S0022-2836(02)00546-6.
- ^ Kim HS, Mittenthal JE, Caetano-Anolles G (2006). „MANET: tracing evolution of protein architecture in metabolic networks”. BMC Bioinformatics. 7: 351. PMC 1559654
 . PMID 16854231. doi:10.1186/1471-2105-7-351.
. PMID 16854231. doi:10.1186/1471-2105-7-351.
- ^ Teichmann SA, Rison SC, Thornton JM, Riley M, Gough J, Chothia C (2001). „Small-molecule metabolsim: an enzyme mosaic”. Trends Biotechnol. 19 (12): 482—6. PMID 11711174. doi:10.1016/S0167-7799(01)01813-3.
- ^ Spirin V, Gelfand M, Mironov A, Mirny L (2006). „A metabolic network in the evolutionary context: Multiscale structure and modularity”. Proc Natl Acad Sci USA. 103 (23): 8774—9. Bibcode:2006PNAS..103.8774S. PMC 1482654
 . PMID 16731630. doi:10.1073/pnas.0510258103.
. PMID 16731630. doi:10.1073/pnas.0510258103.
- ^ Lawrence, J. (2005). „Common themes in the genome strategies of pathogens”. Curr Opin Genet Dev. 15 (6): 584—8. PMID 16188434. doi:10.1016/j.gde.2005.09.007. Wernegreen, J. (2005). „For better or worse: genomic consequences of intracellular mutualism and parasitism”. Curr Opin Genet Dev. 15 (6): 572—83. PMID 16230003. doi:10.1016/j.gde.2005.09.013.
- ^ Pál C, Papp B, Lercher M, Csermely P, Oliver S, Hurst L (2006). „Chance and necessity in the evolution of minimal metabolic networks”. Nature. 440 (7084): 667—70. Bibcode:2006Natur.440..667P. PMID 16572170. doi:10.1038/nature04568.
- ^ Rennie, M. (1999). „An introduction to the use of tracers in nutrition and metabolism”. Proc Nutr Soc. 58 (4): 935—44. PMID 10817161. doi:10.1017/S002966519900124X.
- ^ Phair, R. (1997). „Development of kinetic models in the nonlinear world of molecular cell biology”. Metabolism. 46 (12): 1489—95. PMID 9439549. doi:10.1016/S0026-0495(97)90154-2.
- ^ Sterck L, Rombauts S, Vandepoele K, Rouzé P, Van de Peer Y (2007). „How many genes are there in plants (... and why are they there)?”. Curr Opin Plant Biol. 10 (2): 199—203. PMID 17289424. doi:10.1016/j.pbi.2007.01.004.
- ^ Borodina I, Nielsen J (2005). „From genomes to in silico cells via metabolic networks”. Curr Opin Biotechnol. 16 (3): 350—5. PMID 15961036. doi:10.1016/j.copbio.2005.04.008.
- ^ Gianchandani E, Brautigan D, Papin J (2006). „Systems analyses characterize integrated functions of biochemical networks”. Trends Biochem Sci. 31 (5): 284—91. PMID 16616498. doi:10.1016/j.tibs.2006.03.007.
- ^ Duarte NC, Becker SA, Jamshidi N, et al. (2007). „Global reconstruction of the human metabolic network based on genomic and bibliomic data”. Proc. Natl. Acad. Sci. U.S.A. 104 (6): 1777—82. Bibcode:2007PNAS..104.1777D. PMC 1794290
 . PMID 17267599. doi:10.1073/pnas.0610772104.
. PMID 17267599. doi:10.1073/pnas.0610772104.
- ^ Goh KI, Cusick ME, Valle D, Childs B, Vidal M, Barabási AL (2007). „The human disease network”. Proc. Natl. Acad. Sci. U.S.A. 104 (21): 8685—90. Bibcode:2007PNAS..104.8685G. PMC 1885563
 . PMID 17502601. doi:10.1073/pnas.0701361104.
. PMID 17502601. doi:10.1073/pnas.0701361104.
- ^ Lee DS, Park J, Kay KA, Christakis NA, Oltvai ZN, Barabási AL (2008). „The implications of human metabolic network topology for disease comorbidity”. Proc. Natl. Acad. Sci. U.S.A. 105 (29): 9880—9885. Bibcode:2008PNAS..105.9880L. PMC 2481357
 . PMID 18599447. doi:10.1073/pnas.0802208105. Arhivirano iz originala 08. 04. 2018. g. Pristupljeno 07. 04. 2018.
. PMID 18599447. doi:10.1073/pnas.0802208105. Arhivirano iz originala 08. 04. 2018. g. Pristupljeno 07. 04. 2018.
- ^ Csete M, Doyle J (2004). „Bow ties, metabolism and disease”. Trends Biotechnol. 22 (9): 446—50. PMID 15331224. doi:10.1016/j.tibtech.2004.07.007.
- ^ Ma HW, Zeng AP (2003). „The connectivity structure, giant strong component and centrality of metabolic networks”. Bioinformatics. 19 (11): 1423—30. CiteSeerX 10.1.1.605.8964
 . PMID 12874056. doi:10.1093/bioinformatics/btg177.
. PMID 12874056. doi:10.1093/bioinformatics/btg177.
- ^ Zhao J, Yu H, Luo JH, Cao ZW, Li YX (2006). „Hierarchical modularity of nested bow-ties in metabolic networks”. BMC Bioinformatics. 7: 386. PMC 1560398
 . PMID 16916470. doi:10.1186/1471-2105-7-386.
. PMID 16916470. doi:10.1186/1471-2105-7-386.
- ^ Thykaer J, Nielsen J (2003). „Metabolic engineering of beta-lactam production”. Metab Eng. 5 (1): 56—69. PMID 12749845. doi:10.1016/S1096-7176(03)00003-X.
- ^ González-Pajuelo M, Meynial-Salles I, Mendes F, Andrade J, Vasconcelos I, Soucaille P (2005). „Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol”. Metab Eng. 7 (5–6): 329—36. PMID 16095939. doi:10.1016/j.ymben.2005.06.001.
- ^ Krämer M, Bongaerts J, Bovenberg R, Kremer S, Müller U, Orf S, Wubbolts M, Raeven L (2003). „Metabolic engineering for microbial production of shikimic acid”. Metab Eng. 5 (4): 277—83. PMID 14642355. doi:10.1016/j.ymben.2003.09.001.
- ^ Koffas M, Roberge C, Lee K, Stephanopoulos G (1999). „Metabolic engineering”. Annu Rev Biomed Eng. 1: 535—57. PMID 11701499. doi:10.1146/annurev.bioeng.1.1.535.
- ^ „Metabolism”. The Online Etymology Dictionary. Pristupljeno 20. 2. 2007.
- ^ Leroi, Armand Marie (2014). The Lagoon: How Aristotle Invented Science. Bloomsbury. str. 400–401. ISBN 978-1-4088-3622-4.
- ^ Dr. Abu Shadi Al-Roubi (1982), "Ibn Al-Nafis as a philosopher", Symposium on Ibn al-Nafis, Second International Conference on Islamic Medicine: Islamic Medical Organization, Kuwait (cf. Ibn al-Nafis As a Philosopher, Encyclopedia of Islamic World [1])
- ^ Eknoyan, G. (1999). „Santorio Sanctorius (1561–1636) – founding father of metabolic balance studies”. Am J Nephrol. 19 (2): 226—33. PMID 10213823. doi:10.1159/000013455.
- ^ Williams, H. S. (1904) „A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences”. Pristupljeno 26. 3. 2007. Harper and Brothers (New York)
- ^ Dubos J. (1951). „Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)—chance and the prepared mind”. Trends Biotechnol. 13 (12): 511—515. PMID 8595136. doi:10.1016/S0167-7799(00)89014-9.
- ^ Kinne-Saffran E, Kinne R (1999). „Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs”. Am J Nephrol. 19 (2): 290—4. PMID 10213830. doi:10.1159/000013463.
- ^ Murphy, P. J. (2001). „Xenobiotic metabolism: a look from the past to the future”. Drug Metab. Dispos. 29 (6): 779—80. PMID 11353742. Arhivirano iz originala 21. 06. 2009. g. Pristupljeno 11. 04. 2018.
- ^ Eduard Buchner's 1907 Nobel lecture at http://nobelprize.org Accessed 2007-03-20
- ^ Kornberg, H. (2000). „Krebs and his trinity of cycles”. Nat Rev Mol Cell Biol. 1 (3): 225—8. PMID 11252898. doi:10.1038/35043073.
- ^ Cox, Michael M. (1. 1. 2013). Lehninger principles of biochemistry. Freeman. ISBN 9781429234146. OCLC 901647690.
- ^ Krebs HA, Henseleit K (1932). „Untersuchungen über die Harnstoffbildung im tierkorper”. Z. Physiol. Chem. 210: 33—66. doi:10.1515/bchm2.1932.210.1-2.33.
- ^ Krebs H, Johnson W (1937). „Metabolism of ketonic acids in animal tissues”. Biochem J. 31 (4): 645—60. PMC 1266984
 . PMID 16746382. doi:10.1042/bj0310645.
. PMID 16746382. doi:10.1042/bj0310645.
- ^ Neuberger A, Smith RL (1983). „Richard Tecwyn Williams: the man, his work, his impact”. Drug Metab. Rev. 14 (3): 559—607. PMID 6347595. doi:10.3109/03602538308991399.
- ^ Booth J, Boyland E, Sims P (1961). „An enzyme from rat liver catalysing conjugations with glutathione”. Biochem. J. 79 (3): 516—24. PMC 1205680
 . PMID 16748905.
. PMID 16748905.
- ^ Omura T, Sato R (1962). „A new cytochrome in liver microsomes”. J. Biol. Chem. 237: 1375—6. PMID 14482007. Arhivirano iz originala 21. 06. 2009. g. Pristupljeno 11. 04. 2018.
- ^ Estabrook, R. W. (2003). „A passion for P450s (remembrances of the early history of research on cytochrome P450)”. Drug Metab. Dispos. 31 (12): 1461—73. PMID 14625342. doi:10.1124/dmd.31.12.1461.
- ^ Estabrook RW, Cooper DY, Rosenthal O (1963). „The light reversible carbon monoxide inhibition of steroid C-21 hydroxylase system in adrenal cortex”. Biochem Z. 338: 741—55. PMID 14087340.
Literatura
[uredi | uredi izvor]- Coulston, Ann; Kerner, John; Hattner, JoAnn; Srivastava, Ashini (2006). „Nutrition Principles and Clinical Nutrition”. Stanford School of Medicine Nutrition Courses. SUMMIT.
- M.J. Farabee. „Reactions and Enzymes”. On-Line Biology Book. Estrella Mountain Community College. Arhivirano iz originala 28. 12. 2012. g. Pristupljeno 12. 04. 2018.
- Carroll, Steven B.; Salt, Steven D. (2004). Ecology for gardeners. Timber Press. str. 93. ISBN 978-0-88192-611-8.
- Guyton, Arthur C.; Hall, John E. (2006). Textbook of Medical Physiology. Philadelphia: Elsevier. ISBN 978-0-7216-0240-0.
- Sigel, Roland; Sigel, Astrid; Sigel, Helmut (2007). The Ubiquitous Roles of Cytochrome P450 Proteins: Metal Ions in Life Sciences. New York: Wiley. ISBN 978-0-470-01672-5.
- Nelson, David L.; Cox, Michael M. (2005). Lehninger Principles of Biochemistry. New York: W. H. Freeman and company. str. 841. ISBN 978-0-7167-4339-2.
- Lane, N. (2004). Oxygen: The Molecule that Made the World. (Oxford University Press. USA). ISBN 978-0-19-860783-0.
- Rose, S.; Mileusnic, R. (1999). The Chemistry of Life. (Penguin Press Science). ISBN 978-0-14-027273-4.
- Berg, J.; Tymoczko, J.; Stryer, L. (2002). Biochemistry. (W. H. Freeman and Company). ISBN 978-0-7167-4955-4.
- Schneider, E. D.; Sagan, D. (2005). Into the Cool: Energy Flow, Thermodynamics, and Life. University Of Chicago Press. ISBN 978-0-226-73936-6.
- Brock, Thomas D.; Madigan, M. T.; Martinko, J.; Parker J. (2002). Brock's Biology of Microorganisms. (Benjamin Cummings). ISBN 978-0-13-066271-2.
- Cox, M.; Nelson, D. L. (2004). Lehninger Principles of Biochemistry. (Palgrave Macmillan). ISBN 978-0-7167-4339-2.
- Price, N.; Stevens, L. (1989). Fundamentals of Enzymology: Cell and Molecular Biology of Catalytic Proteins. (Oxford University Press. 1999). ISBN 978-0-19-850229-6.
- Da Silva J.J.R.F.; Williams, R. J. P. (1991). The Biological Chemistry of the Elements: The Inorganic Chemistry of Life. (Clarendon Press. 1991). ISBN 978-0-19-855598-8.
- Nicholls, D. G.; Ferguson, S. J. (2002). Bioenergetics. (Academic Press Inc.). ISBN 978-0-12-518121-1.
- Parvez H, Reiss C (2001). Molecular Responses to Xenobiotics. Elsevier. ISBN 978-0-345-42277-4.
- Ioannides, C. (2001). Enzyme Systems That Metabolise Drugs and Other Xenobiotics. John Wiley and Sons. ISBN 978-0-471-89466-7.
- Awasthi, Y. C. (2006). Toxicology of Glutathionine S-transferses. CRC Press Inc. ISBN 978-0-8493-2983-8.
- Richardson, M. (1996). Environmental Xenobiotics. Taylor & Francis Ltd. ISBN 978-0-7484-0399-8.
- Alberty, Robert A. (2006). Biochemical Thermodynamics: Applications of Mathematica. Methods of Biochemical Analysis. Wiley-Interscience.
- Haynie, D. (2001). Biological Thermodynamics. Cambridge: Cambridge University Press.
- Ioannides, C. (1996). Cytochromes P450: Metabolic and Toxicological Aspects. CRC Press Inc. ISBN 978-0-8493-9224-5.
Spoljašnje veze
[uredi | uredi izvor]- Pregled biohemije Arhivirano na sajtu Wayback Machine (17. mart 2019) školski nivo
- MIT Biologija Arhivirano [Date missing] na sajtu Portuguese Web Archive|Portuguese Web Archive, vodič za molekularnu biologiju
Ljudski metabolizam
- Teme u medicinskoj biohemiji, vodič za ljudske metaboličke puteve, školski nivo
- Medicinska biohemija, opširni resurs o ljudskom metabolizmu
Baze podataka
- Grafikon protoka metaboličkih puteva, ExPASy
- SuperCYP: Baza podataka o citohromnom metabolizmu lekova Arhivirano na sajtu Wayback Machine (3. novembar 2011)
Metabolički putevi
- Referenca metaboličkih puteva Arhivirano na sajtu Wayback Machine (23. februar 2009)
- The Nitrogen cycle and Nitrogen fixation