Водоник
Водоник (H, лат. hydrogenium — стваралац воде) први је и најлакши хемијски елемент.[1][2] При стандардним условима притиска и температуре, водоник је двоатомни гас без боје, мириса и укуса. Није отрован, и знатно је лакши од ваздуха. На собној температури није посебно реактиван, док при вишим температурама улази у низ реакција. Узрок томе ја јака једнострука ковалентна веза.
Водоник нема одређен положај у периодном систему и углавном се проучава засебно. Може се сматрати равноправним чланом 1. или 17. групе. Разлог томе је да поседује један протон и један валентни електрон као и алкални метали, али од њих се разликује много већом енергијом јонизације. За стабилну електронску конфигурацију недостаје му један електрон, што наводи да би се водоник могао сматрати халогеним елементом, али од њих има мању електронегативност и афинитет према електрону.
Овај елемент сачињава 75% видљиве масе свемира, те је исходишна материја из које су нуклеарном фузијом настали остали елементи. Звезде у главном низу се углавном састоје од водоника, у облику плазме. Елементарни водоник на Земљи је присутан у врло малим количинама.[3]
Елементарни водоник састоји се од обичног водоника (протијум, 1H) (>99,98%), док остатак (готово 0,02%) чини тешки водоник (деутеријум, 2H, D) с траговима супертешког водика (трицијума, 3H, T).[4] Пошто је један од стабилних изотопа два пута тежи од другог, они се међусобно доста разликују по хемијским својствима.[5] Водоник ствара хемијске везе са највећим бројем елемената, посебно у органским једињењима. При стандардном притиску и температури, водоник је гас без боје, мириса и укуса, 14,4 пута је лакши од ваздуха. Неотрован је. Слабо је растворљив у поларним, а боље у неполарним растварачима.
Индустријски се највише добија из земног гаса, а ређе електролизом воде. Највише се користи у производњи фосилних горива (хидрокраковање – повећање квалитета горива) и за добивање амонијака, у производњи вештачких ђубрива. У металургији није пожељан, јер многе метале чини ломљивим и кртим, па ствара потешкоће у изградњи цевовода и металних спремника.[6][7]
Историја
[уреди | уреди извор]Водоник (лат. Hydrogenium) је дефинисао Британац Хенри Кавендиш 1766. Он није први изоловао овај елемент, већ је то урадио Парацелзус у 16. веку реакцијом метала и јаке киселине[8], и назвао га „запаљивим ваздухом“. Кавендиш је формирао водоник реакцијом цинка и хлороводоничне киселине. Дефинисао је о ком гасу је реч и доказао да реакцијом водоника и кисеоника настаје вода. Због тог својства Антоан Лавоазје га 1783. назива hydrogène, од грчког "онај који ствара воду" (грч. ὕδωρ = вода, γενής = стваратељ).
Течни водоник је први формирао Џејмс Девар 1898, а годину дана касније је произвео и чврсти водоник. Деутеријум је добио 1931. Харолд Клејтон Јури, а следеће године је формирана тешка вода. 1934. Ернест Радерфорд и његов тим су произвели трицијум.[9]
Жак Шарлс је изумео први балон на топли ваздух 1783. године. Фердинанд фон Цепелин је направио летилицу на водоник, која је имала први лет 1900, и касније је названа цепелин.
Никал – водоникове батерије су први пут кориштене 1977, а касније их је користила Међународна свемирска станица, свемирске летелице Одисеја на Марсу 2001. и Марсов глобални геометар, те свемирски телескоп Хабл, коме је прво паковање батерија трајало 19 година.[10]

Улога у квантној теорији
[уреди | уреди извор]Због своје једноставне атомске структуре, која се састоји од једног протона и електрона, атом водоника са својим спектралним линијама светлости (емисија и апсорпција – Балмерова серија, Лајманова серија итд.), имао је средишњу улогу у развоју теорије атомске структуре. Осим тога, атом водоника и одговарајући катјони H2+ су имали важну улогу у разумевању природе хемијских веза, теорија којих се развила 1920-их.[11]
Пре развоја квантне механике, Максвел је уочио да специфични топлотни капацитет молекула H2 има необјашњиво одступање на ниским температурама, где се H2 почиње више понашати као једноатомни гас. Према квантној теорији, та појава се дешава због простора енергетских нивоа, који су нашироко распоређени код H2 због мале масе. Тај велики простор енергетских нивоа онемогућује равномерну расподелу топлотне енергије код водоника на ниским температурама.[12]
Својства
[уреди | уреди извор]При стандардним условима притиска и температуре, водоник је гас без боје, мириса и укуса, који је 14.4 пута лакши од ваздуха. Није отрован. Слабо је растворан у поларним, а боље у неполарним растварачима.
Охлађен на температуру кључања, кондензује се у безбојну течност која је најлакша од свих течности. Даљим одвођењем топлоте долази до очвршћавања у прозирну чврсту материју хексагоналне кристалне структуре.
Запаљив је са границом експлозивности у ваздуху од 4-94%. Минимална енергија иницијације паљења 0,02 MJ. Температура пламена при стехиометријском сагоревању је 1930 °C. Запаљен на ваздуху при 560 °C, изгара готово невидљивим пламеном формирајући воду:
На собној температури није посебно реактиван, док при вишим температурама улази у низ реакција. Раствара се у многим металима, као што је платина.
При собној температури без катализатора, реагује само с флуором и ванадијумом у праху. Узрок слабој реактивности молекуларног водоника при собној температури је јачина једноструке ковалентне везе молекула. Та веза је најјача од свих једноструких ковалентних веза између два истоимена атома. При повишеној температури спаја се и с кисеоником из многих оксида, те тако делује као редукционо средство.
Линијски спектар водоника
[уреди | уреди извор]Линијски спектар водоника је приказан на траци црне позадине са уским линијама различитих боја: две љубичасте, једна плава и једна црвена. Емисионе линије спектра водоника припадају видљивом спектру светлости. То су четири видљиве линије Балмерове серије.
Због релативно једноставне атомске структуре, тј. због тога што се атом водоника састоји само од протона и електрона, уз спектар светлости који производи или га апсорбује, водоник је био централна фигура за развој теорије структуре атома. Штавише, одговарајућа једноставност молекула водоника и одговарајућих катјона H2+, водила је до потпунијег разумевања природе хемијских веза, која је уследила убрзо након појаве квантно-механичког третмана атома водоника средином 1920-их.

Међу првим примећеним квантним ефектима код водоника је управо његов линијски спектар, пола века пре увођења теорије квантне механичке. А. Ангстрем је 1853. направио експеримент у којем је гас водоника у стакленом суду (при ниском притиску) побуђивао електричном струјом (довођењем напона на крајеве суда). Овај гас је емитовао зрачење из којег је издвојени узак сноп доведен на призму давао правилно раздвојена четири снопа светлости различитих боја.
Други примећен ефекат (није био објашњен у то време) је произашао из Максвеловог посматрања водоника. Максвел је приметио да специфична топлота H2 испод собне температуре, необјашњиво одступа од оне код других диатомних гасова и почиње да личи на ону код једноатомских гасова на Криогеним температурама. Овај ефекат је касније објашњен уз помоћ квантне теорије, односно утицајем квантоване енергије нивоа на расподелу топлотне енергије у ротационо кретање код водоника на ниским температурама. Диатомни гасови који се састоје од тежих атома немају широко распоређене нивое и не показују исти ефекат као водоник.
Заступљеност
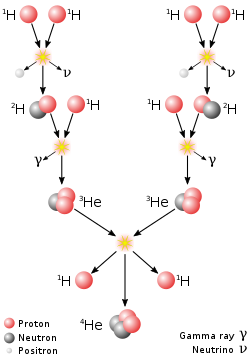
[уреди | уреди извор]Водоник чини 75% масе свемира, те је исходишна материја из које су нуклеарном фузијом настали остали елементи. По броју атома, водоника има 90% у свемиру. Има га у огромним количинама у звездама и гасним дивовима. Молекуларни облаци са H2 су повезани са рођењем звезда. Водоник има одлучујућу улогу у стварању снаге и топлотне енергије у нуклеарној фузији, која се одвија у језграма звезда, кроз низ протон – протон и низ угљеник – азот – кисеоник процесе.[13][14]
У свемиру водоник се углавном налази у атомском стању или као плазма, чија су својства сасвим друкчија од молекуларног водоника H2. Као плазма, водоникови електрони и протони нису повезани заједно, и производе веома јаку електричну проводност и велику емисију топлоте (ствара се електромагнетско зрачење, укључујући светлост са Сунца и осталих звезда). На наелектрисане честице водоника снажно утичу магнетна и електрична поља. На пример, Сунчев ветар делује на Земљину магнетосферу, стварајући поларну светлост и Биркеландову струју.[15]
Елементарни водоник на Земљи је широко распрострањен, мада у малим количинама. Присутан је у атмосфери, земном гасу, вулканским гасовима, итд. Због тога што га гравитација тешко може задржати, водоник у горњим деловима атмосфере излази у свемир. Иако је водоник најзаступљенији елемент у васиони, на Земљи се јавља у малим количинама (0,9% у горњим слојевима), углавном у облику хемијских једињења (вода). У облику једињења, има га у огромним количинама, понајвише у облику воде, која прекрива готово две трећине Земљине површине. Саставни је део многих органских једињења, киселина и растварача. Неке алге и бактерије стварају гасовити водоник.[16] Он је он биогени елемент. По броју атома, трећи је, одмах након кисеоника и силицијума, а по масеном уделу је на десетом месту.
У слободном облику јавља се у виду двоатомних молекула H2. Катјон водоника H+ (у воденим растворима је хидратисан: оксонијум јон H3O+, Цунделов (Zundel) катјон, H5O2+, Ајгенов (Eigen) катјон, H9O4+) настаје услед дисоцијације киселина. Концентрација водоникових јона изражава се помоћу pH вредности.
Добијање
[уреди | уреди извор]Лабораторијско добијање
[уреди | уреди извор]Најчешће се добија онако како га је први пут добио Кавендиш, тј. реакцијом цинка и хлороводичне киселине, уместо које се често користи и разређена сумпорна киселина:
- Zn(s) + 2 H+ → Zn2+ + H2(g)
За развијање гасова у лабораторији најпогоднији је Кипов апарат, јер се реакција у њему може прекинути и на тај начин производе само потребне количине гаса.
Може се добити и реакцијом воде с чврстим хидридима, као што је калцијум хидрид:
- 2 H2O + CaH2(s) → 2 H2(g) + Ca2+ + 2 OH-,
те реакцијом метала негативног редукцијског потенцијала с базама, ако ти метали стварају хидроксо-комплексе:
- 2 Al(s) + 6 H2O + 2 OH- → 2 Al(OH)4- + 3 H2(g)
Индустријско добијање
[уреди | уреди извор]Зависно од цене електричне енергије и енергената, водоник се добија на неколико начина.
У земљама с јефтином електричном енергијом, добија се електролизом воде, залужене алкалијским хидроксидом због повећања проводности:
- 2 H2O → 2 H2(g) + O2(g)
Водоник се добија и као нуспродукт при производњи хлора методом хлоралкалне електролизе.
Једна од најраширенијих и најјефтинијих метода је пиролиза угљоводоника, као што је етана:
- C2H2(g) → C2H4(g) + H2(g)
Када је лако доступан метан, користи се његова реакција с воденом паром на 1100 °C:
- CH4(g) + H2O ⇄ CO(g) + 3 H2(g) = 214.4 kJ mol-1
Када је лако доступан и јефтин угљен, користи се редукција водене паре:
- C(s) + H2O ⇄ CO(g) + H(g) = 131.25 kJ mol-1

Добијена смеша се зове водени гас.
Угљен(II) оксид од водоника се одваја реакцијом с додатном воденом паром, при чему настаје додатна количина водоника:
- CO(g) + H2O(g) → H2(g) + CO2(g)
Настали угљен(IV) оксид уклања се из смеше апсорпцијом у лужини или испирањем водом под притиском. Лако се уклања и хлађењем течним ваздухом. Трагови неизреагованог угљеник(II) оксида уклањају се превођењем гаса преко загрејаног натријум хидроксида при чему настаје натријум метаноат.
Термохемијски процеси
[уреди | уреди извор]Постоји више од 200 термохемијских процеса, који се могу искористити за раздвајање воде. Око 10-так процеса се истражује и испитује за добивање водоника и кисеоника из воде, те грејањем без употребе електричне струје, а ти су процеси на пример: циклус гвожђе оксида, циклус церијум (IV) оксид - церијум (III) оксид, циклус цинк – цинк оксид, циклус сумпор – јод, циклус бакар – хлор и циклус хибридни сумпор. Велики број лабораторија у Француској, Немачкој, Грчкој, Јапану и САД развијају термохемијске процесе уз кориштење Сунчеве енергије и воде.[17][18]
Анаеробна корозија
[уреди | уреди извор]
Без присуства кисеоника, гвожђе и легирани челик се полако оксидују уз помоћ протона из воде, који се претварају у гасовити водоник H2. Анаеробна корозија ствара прво жељезни хидроксид (зелена корозија) и та се хемијска реакција може описати као:
- Fe + 2 H2O → Fe(OH)2 + H2
У другом кораку, без присуства кисеоника, гвожђе хидроксид се може оксидовати уз помоћ протона из воде и створа се магнетит и гасовити водоник. Тај се процес назива Шикоровом реакцијом:
- 3 Fe(OH)2 → Fe3O4 + 2 H2O + H2
Добро кристализирани магнетит (Fe3O4) је термодинамички пуно стабилнији од гвожђе хидроксида. Тај се процес обично дешава за вриеме анаеробне корозије гвожђа и челика, у подземним водама које немају кисеоника, и у редукованим тлу у којем има доста влаге.
Геолошко стварање – серпентација
[уреди | уреди извор]Без присуства кисеоника, у дубоким геолошким слојевима, који су далеко од Земљине атмосфере, гасовити водоник се ствара током процеса серпентације, што је анаеробна оксидација протона воде (H+) и гвожђе (Fe2+) силиката, који је присутан у кристалима фајалита (Fe2SiO4 – крајњи члан оливина). Та реакција доводи до стварања магнетита (Fe3O4), кварца (SiO2) и водоника (H2), на следећи начин:
- 3 Fe2SiO4 + 2 H2O → 2 Fe3O4 + 3 SiO2 + 3 H2
Једињења
[уреди | уреди извор]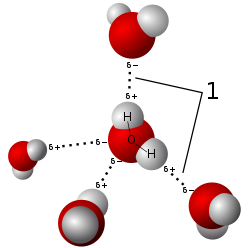
Једињења водоника могу се поделити на једињења у којима је присутан у негативном (-1) и позитивном ступњу оксидације (+1). Прва се називају хидридима, и представљају мањину водоникових једињења, док су друга пуно заступљенија и важнија. Водоник је саставни је део живог света, у којем игра једну од кључних улога.
Ковалентна и органска једињења
[уреди | уреди извор]На собној температури није реактиван, док при вишим температурама улази у низ реакција. Познати су милиони угљоводоника, који су подручје проучавања органске хемије. Водоник ствара једињења и са елементима који имају већу електронегативност, као што су халогени елементи (F, Cl, Br, I). Када се спаја са флуором, кисеоником или азотом, водоник се може везати јаком нековалентном везом, која се зове водонична веза, и која је критична у стабилности многих биолошких молекула. Водоник се везује и за мање електронегативне елементе, као што су метали и полуметали.
Хидриди
[уреди | уреди извор]Хидриди су једињења разних хемијских елемената с водоником. s-блок чине елементи прве и друге групе периодног система елемената. p-блок чине елементи 13—17. групе периодног система елемената. То су најважнији хидриди, и често се користе у пракси. Деле се на киселе, базне, амфотерне и неутралне. Кисели хидриди су они хидриди који у реакцији с водом дају киселине. Базни хидриди у реакцији с водом дају базе. Амфотерни хидриди се зависно од реакције могу понашати и као киселине и као базе. Неутрални хидриди не реагирају с водом.
Изотопи
[уреди | уреди извор]
Елементарни водоник састоји се од обичног водоника (Протијума) (>99,98%), док остатак (готово 0,02%) чини тешки водоник (деутеријум) с траговима супертешког водоника (трицијума).
- 1H или протијум је далеко најзаступљенији изотоп водоника, којег има више од 99,98%. Има један протон и један електрон. За разлику од свих осталих изотопа, он нема неутрон.
- 2H или деутеријум, има један протон и један неутрон у нуклеусу, те један електрон. Сматра се да сав деутеријум у свемиру потиче још од времена Великог праска. Деутеријум није радиоактиван, и не преставља значајну опасност за здравље. Он се користи и код нуклеарне магнетно резонантне спектроскопије, за означавање нерадиоактивних материја у растварачу. Вода која садржи атоме деутеријума се назива тешком водом. Тешка вода се користи у нуклеарним реакторима за смањивање брзине брзих неутрона, као и за хлађење нуклеарних реактора. Деутеријум преставља могуће гориво за добивање електричне енергије из нуклеарне фузије.
- 3H или трицијум, има један протон и два неутрона у нуклеусу, те један електрон. Трицијум је радиоактиван, распада се у хелијум-3 изотоп, уз појаву бета-честица и има време полураспада од 12,32 године. Толико је радиоактиван да се користи за луминисцентне боје, које се користе и код сатова, код којих се може видети вријеме и у мраку. Стакло спречава да мала количина радиоактивности изађе. У природи се трицијум може наћи у врло малим количинама у атмосфери, а настаје услијед деловања космичких зрака. Трицијум може настати код тестирања нуклеарног оружја. Трицијум преставља могуће гориво за добивање електричне енергије из нуклеарне фузије. Он се користи у хемијским и биолошким експериментима као радиоактивни означивач.
Молекуларни изомери
[уреди | уреди извор]Приликом испитивања вибрацијско-ротацијског спектра водоника пронађене су промене у интензитету ротацијских трака, које су протумачене хипотезом о постојању два облика водоника који се разликују по нуклеарним спиновима у молекулу водоника. Ако су спинови два протона из молекула антипаралелни, резултантни спин је нула, те је стање недегенерисано. Такав водоник зове се пара-водоник. Ако су паралелни, резултантни спин је 1, а стање је троструко дегенерисано, што доводи до орто-водоника.
При собној температури, елементарни се водоник састоји од 75% орто-водоника и 25% пара-водоника. Орто- и пара-водоник разликују се по неким физичким својствима, као што су енергија дисоцијације, топлотни капацитет, притисак паре и слично.
Између њих постоји равнотежа:
- o-H2 ⇄ p-H2 < 0,
која се хлађењем помиче удесно.
На ниским температурама могуће је изоловати готово чисти пара-водоник, док чисти орто-водоник није могуће изоловати, јер повећањем температуре не долази до повећања његовог удела изнад 75%.
Однос између орто- и пара-водоника је врло битан код спремања течног водоника у спремник, јер претварање орто-водоника у пара-водоник ствара додатно топлоте, која може довести до испаравања, а тиме и губитка течног водоника. Због тога треба користити катализаторе, као што је гвожђе(III) оксид, активни угљеник, платинизирани азбест, метали ретких земаља, уранова једињења, хромов оксид и неки једињења никла.
Молекуларни облик јона триатомног водоника или H3+, је пронађен у међузвезданој материји, који је настао јонизацијом водоника са космичким зрацима. Тај облик молекула је такође пронађен у горњој атмосфери Јупитера. То је прилично стабилно у тим околинама, због малих температура и густине. То је један од најраширенијих јона у свемиру.
Примена
[уреди | уреди извор]Водоник је врло важна индустријска сировина. Користи се, између осталог у:
- синтези амонијака и метанола,
- производњи горива за моторна возила хидрогенацијом угљеника, нафте и катрана
- заваривању и топљењу метала
- пуњењу ваздушних балона и бродова
- редукцији металних оксида у метале
- хидрогенацији уља у масти
- процесима сагоревања (индустрије стакла, обрада драгог камења, сечења и заваривања метала)
- хемијској индустрији за производњу синтезних смеса, редукцији, хидрогенизацији и десулфуризацији
- производњи електричне енергије
- инструменталној аналитици
- метеорологији, у производњи ел. енергије итд.
- електроници
- производњи полупроводника
- стварању редукционих атмосфера у металургији, рафинацији метала, у термичкој обради метала
Ради се на кориштењу водоника као горива. Технологија је врло слабо распрострањена.
- висока енергетска вредност
- неограничене количине доступне у једињењима
- изгарањем настаје хемијски чиста воду
- цевоводима се може разводити
- лакше се складишти и чува него електрична енергија
Недостаци који спречавају раширенију употребу су:
- висока цена и често слаба исплативост издвајања водоника из једињења
- обилно цурење водоника кроз спремнике и цевоводе, због екстремно малих молекула
- водоник дифузијом продире у разне метале и нарушава њихову кристалну решетку чинећи их кртима
- опасност за озонски слој јер редукује озон у воду
У хемијском смислу, водоник није извор, већ спремник енергије, јер није природно набављив у елементарном облику. У случају успешне и одрживе нуклеарне фузије у нуклеарној електрани, био би извор огромних количина енергије.
Велике количине H2 се користе у нафтној и хемијској индустрији. Највећа примена је код побољшања фосилних горива и у производњи амонијака. У петрохемији H2 се користи у процесима као што су: хидрокрековање, каталитичко реформирање бензина, изомеризација и алкилација. H2 се исто користи у повећању засићења незасићених масти и уља (користи се за добивање маргарина). Такође је сировина за добивање хлороводоничне киселине, а користи се и као редукциони агенс за минералне сировине или руде.[19]
Водоник је изузетно растворан у многим ретким и прелазним металима, а растворан је и у нанокристалима и аморфним металима. Растворљивост у металима утиче на локалне деформације или нечистоће у кристалним решеткама, тако да метали постају кртији и ломљивији, што ствара велике проблеме у металургији, у изради цевовода и металних резервоара. Понекад се то може решити, ако водоник се прочисти проласком кроз дискове паладијума.[20]
Гасовити водоник H2 се користи за хлађење ротора електричних генератора у електранама, зато што има највећу топлотну проводљивост од свих гасова. Течни H2 се користи у испитивању суперпроводности код врло ниских температура. Будући да је гасовити водоник H2 скоро 15 пута лакши од ваздуха, некад се користио за балоне на врући ваздух.
У новије време, гасовити водоник H2 се меша са азотом, за добивање формирајућег гаса (око 5% водоника у азоту), који се користи код поступка лоцирања или утврђивања пропуштања код разних цевовода у аутомобилској, хемијској индустрији, електранама, ваздухопловству и телекомуникацијама. Водоник се користи као додатак храни (Е 949) за проверу конзервиране хране.[21]
Носилац енергије
[уреди | уреди извор]
Водоник није извор енергије, осим у могућим електранама на нуклеарну фузију, које би користиле деутеријум и трицијум, што је још далеко од комерцијалне употребе. Водонику који се добије из сунчевих, биолошких или електричних извора, потребно је више енергије него што од њега може добити изгарањем, зато он више има улогу као батерија, за складиштење енергије. Водоник се може добити из метана, али ти се извори називају неодрживим изворима енергије.[22]
Густина енергије по јединици запремине, за течни или компримирани водоник, је пуно мања од познатих фосилних горива, иако по јединици масе, густина енергије је већа. Ипак, о водонику се доста расправља као о будућем носиоцу енергије. Тако рецимо, везивање угљен-диоксида из ваздуха, може бити повезано са стварањем H2 као фосилног горива. Тада би водоник био релативно чисти извор енергије, уз мало испуштање азотних оксида, али без стварања угљен-диоксида. Ипак, улагање у инфраструктуру би било знантно.[23]
Производња полупроводника
[уреди | уреди извор]У производњи полупроводника, водоник се користи за засићење лабилних веза у аморфном силицијуму и аморфном угљенику, да би им се повећао квалитет. Он је исто могући додатак у различитим оксидима, као: ZnO, SnO2, CdO, MgO, ZrO2, HfO2, La2O3, Y2O3, TiO2, SrTiO3, LaAlO3, SiO2, Al2O3, ZrSiO4, HfSiO4 и SrZrO3.[24]
Поступак и материјали
[уреди | уреди извор]- Рад са гасом захтева примену посебних прописа и мера заштите.
- Препоручује се употреба легура алуминијума, магнезијума и никла. Могу се применити синтетски каучук и слични полимери (све само за гасовити водоник).
- У челичним судовима - боцама, под притиском од 150 бара. Боце су појединачне или у батеријама - палетама са заједничким вентилом за пуњење и пражњење, у батеријама судова - боца трајно уграђеним на транспортно возило или у течном агрегатном стању специјалним транспортним возилима до резервоара корисника.
Биолошка улога
[уреди | уреди извор]Водоник се као састојак воде, налази се у сваком биолошком организму у знатним количинама. Осим у води, налази се и у готово свим органским једињењима унутар организма, везан ковалентно за елементе попут угљеника или азота. У воденим растворима који су део сваког организма, присутан је у облику H3O+ јона, те као такав има изванредно важну, темељну улогу у регулацији ћелијских процеса.
H2 се ствара код неких врста врења или ферментација, а стварају га неки микроорганизми, обично уз помоћ катализатора, које садрже ензиме са гвожђем или никлом, који се називају хидрогеназе.
Раздвајање воде у протоне, електроне и кисеоник, јавља се код готово свих биљака које врше фотосинтезу. Неки организми, као што су модрозелене алге су развиле и други корак, који се одвија у тами и којим се ствара гасовити водоник H2 уз помоћ специјалних хидрогеназа у хлоропласту. У току су испитивања на генетски модификованим модрозеленим алгама, с циљем њихове примене у стварању H2, чак и у присуству кисеоника, т.ј. њихове примене у биореакторима.[25]
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Мишић, Милан, ур. (2005). Енциклопедија Британика. В-Ђ. Београд: Народна књига : Политика. стр. 70. ISBN 86-331-2112-3.
- ^ Palmer D. "Hydrogen in the Universe" [1] publisher=NASA, 1997.
- ^ Palmer, D. (13. 9. 1997). „Hydrogen in the Universe”. NASA. Приступљено 5. 9. 2008.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ "Hydrogen Basics — Production" [2] publisher=Florida Solar Energy Center, 2007.
- ^ Rogers H.C.: "Hydrogen Embrittlement of Metals", journal=Science, 1999.
- ^ Општа и национална енциклопедија у 20 свесака, св. 20. ISBN 978-953-7224-20-2. стр. 281.
- ^ Emsley 2001
- ^ [3] "NTS-2 Nickel-Hydrogen Battery Performance 31", publisher=Aiaa.org, 2009.
- ^ Crepeau Bob: "Niels Bohr: The Atomic Model", journal=Great Scientific Minds, publisher=Great Neck Publishing, 2006.
- ^ Berman R., Cooke, A. H.; Hill, R. W.: "Cryogenics", journal=Annual Review of Physical Chemistry, 1956.
- ^ Steve Gagnon: [4] "Hydrogen", publisher=Jefferson Lab, 2008.
- ^ Haubold Hans, Mathai, A. M., 2007. [5] "Solar Thermonuclear Energy Generation", publisher=Columbia University, 2008.
- ^ Storrie-Lombardi Lisa J.: "Surveys for z > 3 Damped Lyman-alpha Absorption Systems: the Evolution of Neutral Gas", journal=Astrophysical Journal, 2000.
- ^ Wolfgang H. Berger, 2007. [6] "The Future of Methane", publisher=University of California, San Diego, 2008.
- ^ [7] "Development of solar-powered thermochemical production of hydrogen from water"
- ^ [8] "Development of Solar-Powered Thermochemical Production of Hydrogen from Water", DOE Hydrogen Program, 2007, Perret Robert, 2008.
- ^ Chemistry Operations: 2003. [9] "Hydrogen|publisher=Los Alamos National Laboratory" 2008.
- ^ Takeshita Wallace: "Hydrogen solubility in 1:5 compounds between yttrium or thorium and nickel or cobalt", journal=Inorganic Chemistry, 1974.
- ^ Block, Matthias (2004). „Hydrogen as Tracer Gas for Leak Detection”. Sensistor Technologies.
- ^ McCarthy, John (1995). „Hydrogen”. Stanford University. Архивирано из оригинала 14. 3. 2008. г. Приступљено 15. 2. 2017.
- ^ "DOE Seeks Applicants for Solicitation on the Employment Effects of a Transition to a Hydrogen Economy", publisher=US Department of Energy, 2006. [10]
- ^ Van de Walle: "Hydrogen multicentre bonds", journal=Nature Materials, 2007.
- ^ Chris, Williams (2006). „Pond life: the future of energy”. The Register.
Литература
[уреди | уреди извор]- Emsley, John (2001). Nature's Building Blocks. Oxford University Press.
- Chart of the Nuclides (17th изд.). Knolls Atomic Power Laboratory. 2010. ISBN 978-0-9843653-0-2.
- Ferreira-Aparicio, P; Benito, M. J.; Sanz, J. L. (2005). „New Trends in Reforming Technologies: from Hydrogen Industrial Plants to Multifuel Microreformers”. Catalysis Reviews. 47 (4): 491—588. doi:10.1080/01614940500364958.
- Newton, David E. (1994). The Chemical Elements. New York: Franklin Watts. ISBN 978-0-531-12501-4.
- Rigden, John S. (2002). Hydrogen: The Essential Element. Cambridge, Massachusetts: Harvard University Press. ISBN 978-0-531-12501-4.
- Romm, Joseph J. (2004). The Hype about Hydrogen, Fact and Fiction in the Race to Save the Climate. Island Press. ISBN 978-1-55963-703-9.
- Scerri, Eric (2007). The Periodic System, Its Story and Its Significance. New York: Oxford University Press. ISBN 978-0-19-530573-9.
Спољашње везе
[уреди | уреди извор]- Basic Hydrogen Calculations of Quantum Mechanics
- Hydrogen at The Periodic Table of Videos (University of Nottingham)
- High temperature hydrogen phase diagram
- Wavefunction of hydrogen
- Low Energy Linear Accelerator – Monatomic Hydrogen diagram







